|
||||
|
|
Оглавление
2. ЧАСТЬ ПЕРВАЯ. ДИСПЕРСНЫЕ СИСТЕМЫ. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ 2.1. Глава 1. Дисперсные системы 2.1.1. ПРЕДМЕТ КОЛЛОИДНОЙ ХИМИИ 2.1.2. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДС 2.1.4. КРАТКИЙ ИСТОРИЧЕСКИЙ ОЧЕРК 2.1.5. ЗНАЧЕНИЕ КОЛЛОИДНОЙ ХИМИИ 2.2. ГЛАВА 2. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ 2.2.1. ПРИРОДА ПОВЕРХНОСТНОЙ ЭНЕРГИИ 2.2.2. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ 2.2.3. ЗАВИСИМОСТЬ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ОТ ТЕМПЕРАТУРЫ 2.2.4. САМОПРОИЗВОЛЬНЫЕ ПРОЦЕССЫ В ПОВЕРХНОСТНОМ СЛОЕ 2.2.5. АДСОРБЦИЯ. ОБЩИЕ ПОЛОЖЕНИЯ, КЛАССИФИКАЦИЯ 2.3. ГЛАВА 3. АДСОРБЦИЯ НА ГРАНИЦЕ "ЖИДКИЙ РАСТВОР-ГАЗ" 2.3.1. ЗАВИСИМОСТЬ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ОТ ПРИРОДЫ И КОНЦЕНТРАЦИИ РАСТВОРЕННОГО ВЕЩЕСТВА 2.3.2. УРАВНЕНИЕ АДСОРБЦИИ ГИББСА 2.3.3. ПОВЕРХНОСТНАЯ АКТИВНОСТЬ. ПРАВИЛО ДЮКЛО-ТРАУБЕ 2.3.4. ОРИЕНТАЦИЯ МОЛЕКУЛ ПАВ В ПОВЕРХНОСТНОМ СЛОЕ 2.3.6. ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ АДСОРБЦИИ ЛЕНГМЮРА 2.4. ГЛАВА 4. АДСОРБЦИЯ ГАЗОВ И ПАРОВ НА ПОВЕРХНОСТИ ТВЕРДЫХ ТЕЛ 2.4.1. ОСОБЕННОСТИ АДСОРБЦИИ ГАЗА ИЛИ ПАРА НА ТВЕРДОМ АДСОРБЕНТЕ 2.4.2. ЗАВИСИМОСТЬ АДСОРБЦИИ ГАЗА ОТ ЕГО КОНЦЕНТРАЦИИ (ДАВЛЕНИЯ) ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ 2.4.3. ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ АДСОРБЦИИ ЛЕНГМЮРА 2.4.4. ТЕОРИИ ПОЛИМОЛЕКУЛЯРНОЙ АДСОРБЦИИ 2.4.5. КАПИЛЛЯРНАЯ КОНДЕНСАЦИЯ 2.4.6. ЗАВИСИМОСТЬ АДСОРБЦИИ ГАЗОВ ОТ СВОЙСТВ АДСОРБЕНТА 2.4.7. ЗАВИСИМОСТЬ АДСОРБЦИИ ОТ СВОЙСТВ ГАЗА 2.4.8. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ АДСОРБЦИИ ГАЗОВ 2.5. ГЛАВА 5. АДСОРБЦИЯ РАСТВОРЕННОГО В ЖИДКОСТИ ВЕЩЕСТВА НА ТВЕРДОМ АДСОРБЕНТЕ 2.5.1. МОЛЕКУЛЯРНАЯ АДСОРБЦИЯ ИЗ РАСТВОРОВ 2.5.2. ЗАВИСИМОСТЬ МОЛЕКУЛЯРНОЙ АДСОРБЦИИ ОТ РАВНОВЕСНОЙ КОНЦЕНТРАЦИИ АДСОРБТИВА (Cs) 2.5.3. ВЛИЯНИЕ НА МОЛЕКУЛЯРНУЮ АДСОРБЦИЮ ПРИРОДЫ РАСТВОРИТЕЛЯ 2.5.4. ВЛИЯНИЕ НА МОЛЕКУЛЯРНУЮ АДСОРБЦИЮ ПРИРОДЫ АДСОРБЕНТА 2.5.5. ВЛИЯНИЕ НА МОЛЕКУЛЯРНУЮ АДСОРБЦИЮ ПРИРОДЫ АДСОРБТИВА 2.5.6. ВРЕМЯ АДСОРБЦИИ. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА АДСОРБЦИЮ 2.5.7. ИОННАЯ АДСОРБЦИЯ ИЗ РАСТВОРОВ 2.5.11. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ РАССМОТРЕННЫХ ЯВЛЕНИЙ 3. ЧАСТЬ ВТОРАЯ. ЛИОФОБНЫЕ ЗОЛИ (КОЛЛОИДНЫЕ РАСТВОРЫ 3.1. ГЛАВА 6. ПОЛУЧЕНИЕ И ОЧИСТКА КОЛЛОИДНЫХ РАСТВОРОВ 3.1.1. МЕТОДЫ ПОЛУЧЕНИЯ ЛИОФОБНЫХ ЗОЛЕЙ 3.1.2. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ 3.2. ГЛАВА 7. ОПТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ 3.2.2. ПОГЛОЩЕНИЕ СВЕТА И ОКРАСКА ЗОЛЕЙ 3.2.3. ПОГЛОЩЕНИЕ СВЕТА И ОКРАСКА ЗОЛЕЙ 3.2.4. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ КОЛЛОИДНЫХ РАСТВОРОВ 3.3. ГЛАВА 8. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ 3.3.1. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ В ГИДРОФОБНЫХ ЗОЛЯХ 3.3.3. СТРОЕНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ 3.3.4. ФАКТОРЫ, ОТ КОТОРЫХ ЗАВИСИТ ДЗЕТА-ПОТЕНЦИАЛ 3.3.5. МЕТОДЫ ОПРЕДЕЛЕНИЯ ДЗЕТА-ПОТЕНЦИАЛА 3.4. ГЛАВА 9. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ 3.5. ГЛАВА 10. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ. КОАГУЛЯЦИЯ 3.5.1. СЕДИМЕНТАЦИОННАЯ УСТОЙЧИВОСТЬ ДИСПЕРСНЫХ СИСТЕМ 3.5.2. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ. КОАГУЛЯЦИЯ 3.5.3. КИНЕТИКА КОАГУЛЯЦИИ ЭЛЕКТРОЛИТАМИ 3.5.4. ФАКТОРЫ УСТОЙЧИВОСТИ ЛИОФОБНЫХ ЗОЛЕЙ 3.5.5. ВИДЫ КОАГУЛЯЦИИ ЭЛЕКТРОЛИТАМИ 3.5.6. ЗАЩИТА КОЛЛОИДНЫХ ЧАСТИЦ 3.5.8. ГЕТЕРОКОАГУЛЯЦИЯ И ГЕТЕРОАДАГУЛЯЦИЯ 3.6. ГЛАВА. 11. СТРУКТУРИРОВАННЫЕ ДИСПЕРСНЫЕ СИСТЕМЫ 3.6.1. КОАГУЛЯЦИОННЫЕ СТРУКТУРЫ 3.6.2. КОНДЕНСАЦИОННО-КРИСТАЛЛИЗАЦИОННЫЕ СТРУКТУРЫ 3.6.3. СТРУКТУРНО-МЕХАНИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ 4. ЧАСТЬ ТРЕТЬЯ. ЛИОФИЛЬНЫЕ СИСТЕМЫ 4.1. ГЛАВА 12. КОЛЛОИДНЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА 4.1.1. КЛАССИФИКАЦИЯ КОЛЛОИДНЫХ ПАВ 4.1.2. СВОЙСТВА ВОДНЫХ РАСТВОРОВ ПАВ 4.1.3. КРИТИЧЕСКАЯ КОНЦЕНТРАЦИЯ МИЦЕЛЛООБРАЗОВАНИЯ (ККМ) И ЕЕ ОПРЕДЕЛЕНИЕ 4.1.4. ПРИМЕНЕНИЕ КОЛЛОИДНЫХ ПАВ 4.2. ГЛАВА 13. РАСТВОРЫ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ (ВМС) 4.2.1. КЛАССИФИКАЦИЯ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ 4.2.2. ОСНОВНЫЕ ОСОБЕННОСТИ СТРОЕНИЯ ПОЛИМЕРОВ 4.2.3. ВЗАИМОДЕЙСТВИЕ ВМС С РАСТВОРИТЕЛЕМ 4.3. ГЛАВА 14. СТУДНИ. СТУДНЕОБРАЗОВАНИЕ 4.3.1. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОЦЕСС СТУДНЕОБРАЗОВАНИЯ 5. ЧАСТЬ ЧЕТВЕРТАЯ. МИКРОГЕТЕРОГЕННЫЕ СИСТЕМЫ 5.1.1. КЛАССИФИКАЦИЯ СУСПЕНЗИЙ 5.1.2. МЕТОДЫ ПОЛУЧЕНИЯ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ 5.1.3. СВОЙСТВА РАЗБАВЛЕННЫХ СУСПЕНЗИЙ 5.1.4. СЕДИМЕНТАЦИОННАЯ УСТОЙЧИВОСТЬ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ 5.1.5. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ 5.1.6. МЕТОДЫ РАЗРУШЕНИЯ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ 5.1.9. ОБЛАСТИ ПРИМЕНЕНИЯ СУСПЕНЗИЙ 5.2.2. МЕТОДЫ ПОЛУЧЕНИЯ ЭМУЛЬСИЙ 5.2.3. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЭМУЛЬСИЙ 5.2.4. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ ЭМУЛЬСИЙ 5.2.5. ТИПЫ ЭМУЛЬГАТОРОВ НЕОРГАНИЧЕСКИЕ ЭЛЕКТРОЛИТЫ 5.2.6. ОПРЕДЕЛЕНИЕ ТИПА ЭМУЛЬСИИ 5.2.8. СПОСОБЫ РАЗРУШЕНИЯ ЭМУЛЬСИЙ 5.2.9. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭМУЛЬСИЙ 5.3.3. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ПЕН 5.3.7. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ПЕН 5.4.1. КЛАССИФИКАЦИЯ АЭРОЗОЛЕЙ 5.4.2. МЕТОДЫ ПОЛУЧЕНИЯ АЭРОЗОЛЕЙ 5.4.3. ОБЩАЯ ХАРАКТЕРИСТИКА АЭРОЗОЛЕЙ 5.4.4. МЕТОДЫ РАЗРУШЕНИЯ АЭРОЗОЛЕЙ 5.4.6. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ АЭРОЗОЛЕЙ 5.5.2. МЕТОДЫ ПОЛУЧЕНИЯ ПОРОШКОВ 5.5.3. ОБЩАЯ ХАРАКТЕРИСТИКА ПОРОШКОВ 5.5.6. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ПОРОШКОВ ПРЕДИСЛОВИЕ Уважаемые студенты! Коллоидная химия занимает важное место в системе подготовки специалистов для различных областей промышленности. Курс коллоидной химии завершает общехимическую подготовку будущих специалистов и предшествует изучению специальных технологических дисциплин. Значение коллоидной химии для технологии обусловлено тем, что будучи наукой о поверхностных явлениях и физико-химических свойствах дисперсных систем, она является химией реальных тел, так как в любой отрасли промышленности есть вещества, находящиеся в раздробленном состоянии. При производстве пластических масс и синтетических волокон, строительных материалов и продуктов питания, красителей и лекарств, в других областях промышленности возникают многочисленные коллоидно-химические проблемы. Учебник состоит из четырех частей. Часть 1 знакомит вас с дисперсными системами, являющимися основными объектами, изучаемыми коллоидной химией, и их основной особенностью - наличием большой межфазной поверхности и, как следствие, избытка поверхностной энергии. В главах 2-5 подробно рассмотрены различные виды адсорбции - самопроизвольных процессов в поверхностном слое. Этот материал важен не только вследствие большого практического значения адсорбционных процессов, но и для понимания вопросов устойчивости дисперсных систем, методов их получения и разрушения. В конце первой части описаны такие самопроизвольные поверхностные явления, как смачивание и адгезия, играющие важную роль в различных областях человеческой деятельности. Часть 2 посвящена описанию коллоидного состояния вещества. Содержание глав 6-10 составляют методы получения и очистки коллоидных растворов, их основные свойства: оптические, электрические, молекулярно-кинетические, вопросы их кинетической и агрегативной устойчивости. Завершается вторая часть учебника описанием структурно-механических свойств дисперсных систем (глава 11). В части 3 рассматриваются дисперсные системы, свойства которых принципиально отличаются от свойств лиофобных золей. Это отличие состоит в том, что лиофильные коллоидные растворы образуются самопроизвольно и являются термодинамически устойчивыми и обратимыми. Наиболее типичные представители таких систем - растворы коллоидных поверхностно-активных веществ (глава 12) и высокомолекулярных соединений (главы 13, 14). Лиофильные коллоиды находят широкое применение в различных отраслях промышленности и, вместе с тем, используются в качестве стабилизаторов лиофобных золей и микрогетерогенных систем. Значительный интерес представляют микрогетерогенные системы, которым посвящена четвертая часть учебника. Суспензии, эмульсии, пены, аэрозоли, порошки повсеместно распространены в природе, встречаются в различных технологических процессах, с ними связаны сложнейшие экологические проблемы, но в большинстве учебников коллоидной химии им уделяется незаслуженно мало внимания. В главах 15-19 последовательно описываются: а) системы с жидкой дисперсионной средой: суспензии и пасты (дисперсная фаза твердая); эмульсии (дисперсная фаза жидкая); газовые эмульсии и пены (дисперсная фаза газообразная); б) системы с газовой дисперсионной средой: аэрозоли (дисперсная фаза твердая или жидкая); порошки (дисперсная фаза твердая). Каждая глава в учебнике заканчивается кратким заключением. Ознакомившись с ним, вы сможете сосредоточиться на основных положениях и выводах, следующих из данной главы. После этого ответьте на вопросы для самоконтроля и посмотрите перечень знаний, которые вы должны были получить. Надеемся, что предлагаемый учебник окажется вам полезным при изучении специальных технологических дисциплин и в будущей профессиональной деятельности. 2. ЧАСТЬ ПЕРВАЯ. ДИСПЕРСНЫЕ СИСТЕМЫ. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ 2.1. Глава 1. Дисперсные системы 2.1.1. ПРЕДМЕТ КОЛЛОИДНОЙ ХИМИИ Коллоидная химия занимается изучением дисперсных систем. Дисперсная система (ДС) - это система, в которой хотя бы одно вещество находится в раздробленном состоянии. ДС имеет два характерных признака: гетерогенность и дисперсность. Гетерогенность означает, что система состоит как минимум из двух фаз. Казалось бы, в этом нет ничего особенного, ведь с такими системами мы уже встречались при изучении фазовых равновесий или электродных процессов. Особенность ДС состоит в их дисперсности - одна из фаз обязательно должна быть раздробленной, ее называют дисперсной фазой. Сплошная среда, в которой раздроблена дисперсная фаза, называется дисперсионной средой. Фаза считается дисперсной, если вещество раздроблено хотя бы в одном направлении. Если вещество раздроблено только по высоте, образуются пленки (ткани, пластины и т.д.). Если вещество раздроблено и по высоте и по ширине, образуются волокна, нити, капилляры. Наконец, если вещество раздроблено по всем трем направлениям, дисперсная фаза состоит из дискретных частиц. Характерным свойством ДС является наличие большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом. Характерными являются процессы, протекающие на поверхности, а не внутри фазы. Коллоидная химия - это наука о поверхностных явлениях и физико-химических свойствах дисперсных систем (рис. 1.1 2.1.2. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДС Для характеристики ДС используются три величины: 1. Поперечный размер частиц - d. [d] = см; м. Для сферических частиц это диаметр сферы, для кубических частиц - ребро куба. 2. Дисперсность (раздробленность) - Д - величина, обратная поперечному размеру частиц:
3. Удельная поверхность
Для сферической частицы с радиусом r:
Для кубической частицы с ребром куба d:
В общем случае
где 2.1.3. КЛАССИФИКАЦИЯ ДС Классификация ДС может быть проведена на основе различных свойств. КЛАССИФИКАЦИЯ ПО ДИСПЕРСНОСТИ Зависимость величины удельной поверхности от дисперсности Из графика видно, что с уменьшением поперечных размеров частиц величина удельной поверхности существенно возрастает. Если кубик с размером ребра 1 см измельчить до кубических частиц с размерами При • грубодисперсные системы, • микрогетерогенные системы, • коллоидно-дисперсные системы или коллоидные растворы, • истинные растворы, см. Необходимо подчеркнуть, что самую большую удельную поверхность имеют частицы дисперсной фазы в коллоидных растворах. КЛАССИФИКАЦИЯ ПО АГРЕГАТНОМУ СОСТОЯНИЮ ФАЗ Классификация по агрегатному состоянию фаз была предложена Вольфгангом Оствальдом. В принципе возможно 9 комбинаций. Представим их в виде таблицы. Таблица 1.1. Классификация по агрегатному состоянию фаз Агрегатное состояние дисперсной фазы Агрегатное состояние дисперсной среды Условное обозначение ф/с Название системы Примеры г г г/г аэрозоли атмосфера Земли ж г ж/г туман, слоистые облака тв г тв/г дымы, пыли, перистые облака г ж г/ж газовые эмульсии, пены газированная вода, мыльная пена, лечебный кислородный коктель, пивная пена ж ж ж/ж эмульсии молока, масло сливочное, маргарин, кремы и т.д. тв ж тв/ж лиозоли, суспензии лиофобные коллоидные растворы, суспензии, пасты, краски и т.д. г тв г/тв твердые пены пемза, твердые пены, пенопласт, активированный уголь, пенобетон, хлеб, порисные тела в газе и т.д. ж тв ж/тв твердые эмульсии вода в парафине, природные минералы с жидкими включениями, пористые тела в жидкости тв тв тв/тв твердые золи сталь, чугун, цветные стекла, драгоценные камни: золь Au в стекле - рубиновое стекло (0,0001%) (1 т стекла - 1 г Au) КЛАССИФИКАЦИЯ ПО ВЗАИМОДЕЙСТВИЮ ДИСПЕРСНОЙ ФАЗЫ И ДИСПЕРСИОННОЙ СРЕДЫ (ПО МЕЖФАЗНОМУ ВЗАИМОДЕЙСТВИЮ) Эта классификация пригодна только для систем с жидкой дисперсионной средой. Г. Фрейндлих предложил подразделить ДС на два вида: 1) лиофобные, в них дисперсная фаза не способна взаимодействовать с дисперсионной средой, а следовательно, и растворяться в ней, к ним относятся коллоидные растворы, микрогетерогенные системы; 2) лиофильные, в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться, к ним относятся растворы коллоидных ПАВ и растворы ВМС. КЛАССИФИКАЦИЯ ПО МЕЖЧАСТИЧНОМУ ВЗАИМОДЕЙСТВИЮ Согласно этой классификации ДС подразделяют на: 1) свободнодисперсные (бесструктурные); 2) связнодисперсные (структурированные). В свободнодисперсных системах частицы дисперсной фазы не связаны друг с другом и способны независимо передвигаться в дисперсионной среде. В связнодисперсных системах частицы дисперсной фазы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Частицы, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения. 2.1.4. КРАТКИЙ ИСТОРИЧЕСКИЙ ОЧЕРК В истории развития коллоидной химии можно выделить три периода. Первый период. Зарождение коллоидной химии (с древнейших времен до середины XIX в.). Многие коллоидные системы были известны в глубокой древности - в Египте, Греции и Риме. У Аристотеля имеются указания на явления свертывания молока и крови, дубления кож и крашения тканей. Алхимикам (II-IV вв.) были известны коллоидные растворы золота и серебра. В древнерусской рецептурной литературе встречаются многочисленные указания на применение коллоидов - белков, желчи, различных клеев и красок. Самые первые ремесла имели прямое отношение к объектам коллоидной химии: получение керамики, глазури, выделывание кож. В XVI-XVII вв. коллоидные растворы применялись как лечебные препараты. М.В. Ломоносов широко использовал для окрашивания стекол коллоидные пигменты и основал новую отрасль русской промышленности - производство цветных стекол для мозаики. Он же впервые предложил характеризовать твердые материалы по их сопротивлению механическому диспергированию при шлифовании. Первые исследования адсорбции были выполнены русским химиком Ловицем (1792), который применил для очистки растворов от примесей твердый адсорбент - древесный уголь. В 1777 г. Ф. Фонтана и К. Шееле открыли адсорбцию газов. Первые практические сведения о суспензиях содержатся в трудах Й.Я. Берцелиуса (1824-1834). Итальянский ученый Ф. Сельми (1817-1881) обратил внимание на то, что некоторые растворы проявляют аномальные свойства: сильно рассеивают свет, не проявляют заметной диффузии, растворенное вещество в них не проходит через пористые мембраны и легко выпадает в осадок при добавлении небольших количеств индифферентных солей. Сельми назвал такие растворы псевдорастворами. В 1851 г. он описал золи берлинской лазури и серы. М. Фарадей (1857) исследовал коллоидные растворы золота и других металлов и разработал методы их получения. Профессор Московского университета Рейсе (1809) открыл явления электрофореза и электроосмоса в суспензиях и глинах. Дж. Тиндаль (1868) изучал оптические свойства коллоидных растворов и открыл явление опалесценции. Итак, к середине XIX в. был накоплен экспериментальный материал, послуживший основой для возникновения коллоидной химии как самостоятельной науки. Второй период. Становление коллоидной химии как самостоятельной науки (1860-е гг. - конец XIX в.). Основоположником коллоидной химии считают шотландского химика Т. Грэма. Он впервые (1861) ввел термины "коллоид", "золь", "гель", получил коллоидные растворы сульфида мышьяка, кремневой и вольфрамовой кислот, гидроксидов алюминия, железа, хрома. Грэм сконструировал диализатор для очистки коллоидных растворов. Обнаружив неспособность частиц коллоидных растворов, в отличие от обычных молекулярных растворов, проникать через пористые мембраны, он пришел к выводу о том, что все вещества делятся на коллоиды (не проходят через мембрану) и кристаллоиды. Современник Грэма профессор Киевского университета И.Г. Борщов (1868), исследуя скорость диффузии в коллоидных растворах, установил ее зависимость от размеров коллоидных частиц и независимость от химической природы растворенного вещества. В отличие от представлений Грэма о коллоидах как об особом классе химических веществ, он пришел к выводу о микрокристаллическом состоянии коллоидных частиц. Великий русский химик Д.И. Менделеев много внимания уделял коллоидным растворам и в "Основах химии" подробно описал свойства некоторых из них. Еще в 90-х г. прошлого столетия он показал, что все тела в природе могут находиться в коллоидном состоянии. Именно Д.И. Менделееву мы обязаны современным представлениям об универсальности коллоидного состояния вещества. Впоследствии профессор Санкт-Петербургского горного института П. Веймарн (1904) показал, что одно и то же вещество может в одних условиях обладать свойствами кристаллоида, а в других - образовывать коллоидный раствор. Так, например, водный раствор поваренной соли является истинным раствором (NaCl - кристаллоид), а раствор NaCl в бензоле - коллоидный. Подчеркивая важность коллоидных систем для развития науки, Д.И. Менделеев писал, что "вопросы коллоидной химии должно считать передовыми и могущими иметь большое значение во всей физике и химии". На основе фундаментальных исследований, выполненных в конце XIX в., было установлено, что в коллоидных растворах частицы находятся в высокой степени раздробления. Появились понятия "дисперсная фаза", "дисперсионная среда", "степень дисперсности". Веймарн, Оствальд и другие ученые высказывали мысль, что свойства дисперсных систем определяются степенью дисперсности частиц. Третий период. Развитие современной коллоидной химии (XX в.). Начало XX в. ознаменовалось развитием теоретических исследований объектов коллоидной химии. М. С. Цвет (1903) в Варшаве открыл хроматографи-ческий метод анализа, основанный на адсорбционном разделении веществ в пористых адсорбентах. В дальнейшем учение об адсорбции развивалось в работах таких ученых, как Б.А. Шишковский (1908), И. Ленгмюр (1917), Г. Фрейндлих (1926), Н.А. Шилов (1915-1930). Н.Д. Зелинский во время Первой мировой войны создал угольный противогаз. Работы П.А. Ребиндера (с 1923 г.) были посвящены проблемам влияния адсорбционных слоев на свойства коллоидных и грубодисперсных систем. Теория двойного электрического слоя возникла благодаря работам Г. Гун, Д. Чепмена, О. Штерна (1910-1924). Н.П. Песков положил начало учению о лиофильности и лиофобности золей и выяснил значение этих свойств в проблеме устойчивости. Н.П. Пескову принадлежит заслуга в формировании представлений о коллоидной химии как науке о поверхностных явлениях и дисперсных системах (1932). А. Эйнштейн (1908) и М. Смолуховский (1906) разработали теорию броуновского движения и диффузии в коллоидных системах. Ж. Перрен (1909) и Т. Сведберг (1907) экспериментально подтвердили правильность этой теории, которая имела существенное значение для развития молекулярно-кинетических представлений. Перечисленные теоретические вопросы будут нами рассмотрены при изложении различных разделов курса. 2.1.5. ЗНАЧЕНИЕ КОЛЛОИДНОЙ ХИМИИ Коллоидная химия является научной основой многочисленных технологических процессов, включающих использование или образование дисперсных систем. Назовем некоторые из них. • Технологии производства современных композиционных и строительных материалов, силикатов (керамики, стекол и т.д.) • Получение дисперсных, пористых структур - катализаторов и сорбентов. • Производство пластмасс, резины, природных и синтетических волокон, клеев, лакокрасочных материалов. • Технологии производства продуктов питания. • Извлечение нефти из пласта с последующим деэмульгированием. • Технологии флотации руд. • Мембранные процессы разделения и водоподготовки. • Разработка и применение поверхностно-активных веществ: флотореагентов, смачивателей, стабилизаторов пен и эмульсий, пеногасителей и деэмульгаторов, компонентов смазок и охлаждающих жидкостей, моющих средств. Без преувеличения можно сказать, что коллоидная химия - химия реальных тел. Примерами материи в коллоидном состоянии являются типографская краска и бумага, большая часть одежды и обуви, продукты питания, почва, атмосфера Земли, строительные материалы и т.д. Более того, наше тело - пример материи в коллоидном состоянии. По словам И.И. Жукова, крупного российского химика, человек - это ходячий коллоид. Вследствие большого разнообразия объектов, изучаемых коллоидной химией и решаемых ею задач, происходит обособление некоторых разделов в самостоятельные научные дисциплины, а также использование ее методов в смежных областях науки. Так из коллоидной химии выделилась физическая химия растворов полимеров, в значительной степени самостоятельно развиваются наука об аэрозолях, химия поверхности. С коллоидно-химическими проблемами связаны изучение биологических мембран, биохимия, биофизика и т.д. Закончив изучение главы 1, вы должны знать: • количественные характеристики дисперсных систем, формулы для их расчета; • классификацию дисперсных систем по дисперсности, агрегатному состоянию фаз, по взаимодействию дисперсной фазы и дисперсионной среды, по характеру межчастичного взаимодействия. 2.2. ГЛАВА 2. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ 2.2.1. ПРИРОДА ПОВЕРХНОСТНОЙ ЭНЕРГИИ Дисперсные частицы и дисперсионная среда относятся к различным фазам. Система может существовать из разных фаз только в том случае, если межмолекулярные взаимодействия в граничных фазах различны. Единственной системой, в которой межмолекулярные взаимодействия отсутствуют, является идеальный газ. Интенсивность молекулярных взаимодействий возрастает при переходе от реальных газов к твердым телам. Рассмотрим систему, состоящую из жидкости (фаза 1) и газа (фаза 2). Силы межмолекулярного взаимодействия в жидкости Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление. Для жидкостей на границе с воздухом внутреннее давление очень велико, например, для воды Р = 14 800 атм. Внутреннее давление Р стремится втянуть молекулу в глубь фазы 1. Чтобы образовать межфазную поверхность, необходимо перевести часть молекул из объема жидкости на поверхность. Для этого надо совершить работу против внутреннего давления, очевидно, чем оно больше, тем больше энергии требуется затратить. Эта энергия сосредоточивается в молекулах, находящихся на поверхности, и называется поверхностной энергией. 2.2.2. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ Наиболее важной характеристикой поверхности является поверхностное натяжение. Оно характеризует избыток поверхностной энергии, приходящийся на 1 межфазной поверхности. Поверхностное натяжение (
где Обычно работу совершают или при условии постоянства объема и температуры (V, Т = const), или при постоянных температуре и давлении (Р, Т = const). Рассмотрим оба варианта: 1) V, Т = const
где F - свободная энергия Гельмгольца.
Свободная энергия - это энергия, за счет которой можно произвести работу. Таким образом, поверхностное натяжение - это удельная свободная поверхностная энергия, т.е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности. Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше . Для границы "конденсированная фаза (твердая или жидкая) - воздух" можно пренебречь межмолекулярными взаимодействиями в воздухе Таблица 2.1. Поверхностное натяжение на границе с воздухом Жидкость 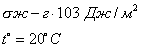 Твердое тело 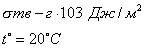 Ртуть 485,0 CaF2 2500 H2O 72,75 PbF2 900 C6H6 28,9 PbI2 130 C2H5OH 21,6 алмаз 11400 2.2.3. ЗАВИСИМОСТЬ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ОТ ТЕМПЕРАТУРЫ Поверхностное натяжение индивидуальных веществ на границе с газом понижается с повышением температуры:
где 2.2.4. САМОПРОИЗВОЛЬНЫЕ ПРОЦЕССЫ В ПОВЕРХНОСТНОМ СЛОЕ Из химической термодинамики вы знаете, что самопроизвольно протекают только те процессы, которые приводят к уменьшению свободной энергии системы. Если процессы проводятся в условиях постоянства объема и температуры, они должны приводить к уменьшению свободной энергии Гельмгольца (dF < 0). Процессы, протекающие при постоянных давлении и температуре, должны сопровождаться уменьшением свободной энергии Гиббса (dG < 0). Если процессы в поверхностном слое не сопровождаются химическими реакциями, состав системы остается постоянным Выше отмечалось, что поверхностное натяжение - это свободная поверхностная энергия, приходящаяся на единицу площади межфазной поверхности. Значит, если процесс протекает при
Соответственно для изобарно-изотермических процессов
Дифференцируя (2.4) и (2.5), получим:
Условием самопроизвольного протекания как изохорно-изотермических, так и изобарно-изотермических процессов является
Для индивидуальных веществ поверхностное натяжение постоянно • стремление капель жидкости или пузырьков газа принять сферическую форму (сферические частицы имеют самую маленькую удельную поверхность); • слипание твердых частиц дисперсной фазы (коагуляция); • слипание капель в эмульсиях или пузырьков газа в пенах (коалесценция); • рост кристаллов. Если площадь межфазной поверхности остается постоянной 2.2.5. АДСОРБЦИЯ. ОБЩИЕ ПОЛОЖЕНИЯ, КЛАССИФИКАЦИЯ Адсорбцией называется самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с его концентрацией в объеме фазы. Более плотную фазу (определяющую форму поверхности) принято называть адсорбентом, вещество, молекулы которого могут адсорбироваться - адсорбтивом, уже адсорбированное вещество - адсорбатом. Процесс, обратный адсорбции, называют десорбцией. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ АДСОРБЦИИ Для количественного описания адсорбции применяют три величины. 1. Избыточная, или гиббсовская адсорбция ( Это избыток i-гo компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади поверхности.
где Учитывая, что молярная концентрация, умноженная на объем, - это количество вещества,
2. Абсолютная адсорбция. В тех случаях, когда способность вещества к адсорбции резко выражена, и вследствие этого
где 3. Удельная адсорбция. В тех случаях, когда измерить площадь поверхности трудно, количество i-гo компонента (или его массу Если адсорбтивом является газ, вместо его количества (моль) или массы (кг) применяют его объем, исходя из того, что при нормальных условиях (0 Если КЛАССИФИКАЦИЯ АДСОРБЦИОННЫХ ПРОЦЕССОВ В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической. Физическая адсорбция обусловлена силами межмолекулярного взаимодействия. Вы помните, что если молекулы полярны, возникают ориентационное, индукционное и дисперсионное взаимодействия. В случае неполярных молекул возможны только дисперсионные взаимодействия. Особенности физической адсорбции: 1. Обратимость. Имеет место динамическое равновесие:
Десорбция обусловлена тепловым движением. Например, при адсорбции уксусной кислоты на угле на поверхности возникает адсорбционный комплекс:
При десорбции комплекс разрушается и адсорбтив выделяется в химически неизменном виде. 2. Малая специфичность. На полярных адсорбентах адсорбируются полярные вещества, на неполярных - неполярные. 3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8-40 кДж/моль, т.е. соизмерима с теплотой конденсации. 4. С повышением температуры адсорбция уменьшается: Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Процесс происходит только на поверхности адсорбента. Особенности химической адсорбции: 1. Необратимость. При десорбции с поверхности уходит поверхностное соединение. Десорбция обусловлена какими-то внешними воздействиями. Например, адсорбция кислорода на угле:
При нагревании происходит десорбция:
2. Специфичность. Адсорбция происходит, только если возможна химическая реакция. 3. Высокая теплота адсорбции, которая может достигать 800-1000 кДж/моль, т.е. сопоставима с тепловыми эффектами химических реакций. 4. Повышение температуры приводит к увеличению хемосорбции, так как увеличивается скорость химического взаимодействия. В дальнейшем мы будем рассматривать только физическую адсорбцию и поэтому будем ее называть просто адсорбцией (рис. 2.2 ). ЗАКЛЮЧЕНИЕ Особенностью дисперсных систем является наличие большой межфазной поверхности. Молекулы, находящиеся на поверхности раздела фаз, вследствие нескомпенсированности действующих на них сил, обладают повышенной энергией. Мерой поверхностной энергии является поверхностное натяжение (), равное термодинамически обратимой изотермической работе, которую необходимо затратить для увеличения площади межфазной поверхности на единицу. Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше поверхностное натяжение. Любые процессы протекают самопроизвольно, если они сопровождаются уменьшением свободной энергии. Уменьшение свободной поверхностной энергии возможно либо за счет уменьшения величины межфазной поверхности, либо за счет уменьшения поверхностного натяжения. Стремление частиц принять сферическую форму, процессы коагуляции и коалесценции характерны для индивидуальных веществ, поверхностное натяжение которых постоянно. В тех случаях, когда постоянна площадь межфазной поверхности, самопроизвольно происходят процессы адсорбции - накопления в поверхностном слое частиц, понижающих поверхностное натяжение. Различные виды адсорбции будут рассмотрены в следующих главах. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ 1. В чем состоят характерные особенности дисперсных систем? 2. Какова причина возникновения избыточной поверхностной энергии? 3. Что называется поверхностным натяжением? От чего зависит величина ? В каких единицах она измеряется? 4. В чем заключаются причины самопроизвольных поверхностных явлений? 5. Какие поверхностные явления связаны с уменьшением величины межфазной поверхности? 6. Что называется адсорбцией? Чем она обусловлена? 7. Чем можно объяснить тот факт, что деревянную палочку диаметром 1 см сломать легко, а стальной стержень такого же диаметра - практически невозможно? 8. Найдите общую поверхность 1 кг сферических частиц угля, если средний диаметр частиц 9. Удельная поверхность силикагеля равна 10. Поверхностное натяжение на границе ртуть-воздух равно Изучив главу 2, вы должны знать: • сущность поверхностного натяжения, почему оно возникает; • условия самопроизвольного протекания процессов в поверхностном слое; • сущность процесса адсорбции; • понятия "избыточная", "абсолютная" и "удельная" адсорбция; • особенности физической и химической адсорбции. 2.3. ГЛАВА 3. АДСОРБЦИЯ НА ГРАНИЦЕ "ЖИДКИЙ РАСТВОР-ГАЗ" Этот вид адсорбции заключается в том, что растворенное в жидкости вещество концентрируется на поверхности жидкого раствора на границе с газом. Особенности таких систем состоят в следующем: • поверхность жидкости однородна, а следовательно, равноценна для адсорбции; • молекулы адсорбтива (растворенного вещества) могут свободно передвигаться по поверхности жидкости под действием теплового движения, т.е. они не закреплены жестко с каким-то одним участком поверхности; • можно пренебречь силовым полем газовой фазы, так как силы взаимодействия в газе пренебрежимо малы. 2.3.1. ЗАВИСИМОСТЬ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ОТ ПРИРОДЫ И КОНЦЕНТРАЦИИ РАСТВОРЕННОГО ВЕЩЕСТВА Измерения поверхностного натяжения растворов показали, что различные растворенные вещества по-разному влияют на поверхностное натяжение растворов. 1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). По отношению к водным растворам поверхностно-активными являются спирты, жирные кислоты и их соли, амины и другие вещества, имеющие дифильное строение, т.е. полярную часть (функциональные группы) и неполярную часть (углеводородный радикал). Молекулу ПАВ принято изображать так:
Поверхностно-активными по отношению к воде являются вещества менее полярные, чем вода (так, дипольный момент воды равен 1,84 Д, а у этанола - 1,70 Д). Они взаимодействуют с водой слабее, чем молекулы воды между собой, значит, попадая на поверхность, они уменьшают поверхностное натяжение. 2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К ним относятся сильные электролиты: соли, щелочи, кислоты. Ионы, образующиеся в результате диссоциации, взаимодействуют с водой сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды в объем раствора. Однако немногие оставшиеся на поверхности ионы создают вблизи поверхности силовое поле, тем самым повышая поверхностное натяжение. Существуют вещества, растворение которых практически не приводит к изменению поверхностного натяжения. Такие вещества являются поверхностно-неактивными. К ним относятся вещества, которые имеют много полярных групп, например сахароза Зависимость поверхностного натяжения от концентрации растворенного вещества = f(c) для указанных групп веществ представлена на рис. 3.1 . Из графика видно, что для поверхностно-активных веществ Необходимо обратить внимание на то, что для ПАВ характерно резкое снижение СУ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение поверхностного натяжения под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю. Необходимо подчеркнуть, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением (). 2.3.2. УРАВНЕНИЕ АДСОРБЦИИ ГИББСА Выше (п. 2.2.4) мы пришли к выводу, что процесс адсорбции обусловлен снижением поверхностного натяжения. Очевидно, чем в большей степени ПАВ снижает поверхностное натяжение, тем большей должна быть его адсорбция. Напротив, ПИВ должна быть присуща отрицательная адсорбция. Исходя из второго закона термодинамики американский ученый Дж. Гиббс в 70-х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:
где - избыточная адсорбция i-гo компонента (см. 2.10), В такой форме уравнение Гиббса применяется для разбавленных растворов. Вы, очевидно, помните, что для концентрированных растворов концентрацию нужно заменить активностью:
Уравнение Гиббса было выведено теоретически. В дальнейшем оно было подтверждено экспериментально Мак-Беном методом среза тонких слоев с последующим их химическим анализом. Аналогичные исследования были проведены Сазаки с использованием метода радиоактивных индикаторов. Проанализируем уравнение Гиббса. Если
Точно так же можно рассчитать значение избыточной адсорбции для любой концентрации и заполнить таблицу (табл. 3.1.). Таблица 3.1. Значение избыточной адсорбции для любой концентрации ci Zi Гi ci Zi Гi c1 1Z1 Г1 c4 4Z4 Г4 c2 2Z2 Г2 ... ... ... ... c3 3Z3 Г3 ... ... ... ... Данные, приведенные в таблице, позволяют построить изотерму адсорбции 2.3.3. ПОВЕРХНОСТНАЯ АКТИВНОСТЬ. ПРАВИЛО ДЮКЛО-ТРАУБЕ Из уравнения Гиббса следует, что характеристикой поведения вещества при адсорбции является величина производной , однако ее значение изменяется при изменении концентрации (см. рис. 3.2). Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция. Поверхностную активность можно определить графически как отрицательное значение тангенса угла наклона касательной, проведенной к кривой = f(c) в точке ее пересечения с осью ординат. Таким образом, для ПАВ: Было установлено следующее. 1. Поверхностная активность (g) возрастает с уменьшением полярности вещества. Поэтому поверхностная активность органических кислот больше величины g для их солей, например:
Этим же объясняется инактивность сахарозы, молекула которой наряду с неполярным углеводородным каркасом имеет много полярных групп, поэтому в молекуле имеется баланс полярной и неполярной части. 2. В гомологическом ряду прослеживаются четкие закономерности в изменении поверхностной активности (g): она возрастает по мере увеличения длины углеводородного радикала. На основании большого экспериментального материала в конце XIX в. Дюкло и Траубе сформулировали правило: Поверхностная активность предельных жирных кислот в водных растворах возрастает в 3-3,5 раза при удлинении углеводородной цепи на одно звено (группу Рис. 3.4
На рис. 3.4 приведены изотермы поверхностного натяжения для ряда кислот. Итак, Вы помните, что, зная = f(с), можно построить изотерму гиббсовской адсорбции = f(c). На рис. 3.5 представлены изотермы адсорбции для пяти рассматриваемых кислот. Анализ изотерм адсорбции выявляет следующие закономерности:
То, что во всех случаях стремится к , объяснимо, так как адсорбция мономолекулярна. Но чем можно объяснить, что максимальная адсорбция внутри гомологического ряда не зависит от длины углеводородного радикала? Вероятно, только строго определенным расположением молекул в поверхностном слое. 2.3.4. ОРИЕНТАЦИЯ МОЛЕКУЛ ПАВ В ПОВЕРХНОСТНОМ СЛОЕ В 1915 г. американец И. Ленгмюр ввел понятие об ориентации молекул ПАВ в поверхностном слое. Он исходил из того, что молекулы ПАВ состоят из двух частей - полярной группы (например, При малых концентрациях углеводородные цепи, вытолкнутые в воздух, "плавают" на поверхности воды, тогда как полярная группа погружена в воду (рис. 3.6а), такое положение возможно из-за гибкости углеродной цепи. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. Какие-то из них принимают вертикальное положение (рис. 3.6б). В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой "частоколом" из вертикально ориентированных молекул ПАВ (рис. 3.6в), значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого жидкого ПАВ на границе с воздухом. Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция () не зависит от длины "хвоста" (углеводородного радикала), а определяется только размерами поперечного сечения молекулы, которые в гомологическом ряду остаются неизменными. Экспериментально найденная величина дает возможность рассчитать поперечный размер молекулы ( Предельная избыточная адсорбция ПАВ равна:
где
где Подставляя полученное значение в уравнение (3.5), получаем
Так было найдено, что поперечный размер молекул всех жирных кислот равен Масса 1 поверхностного слоя равна
где М - молярная масса ПАВ. В то же время плотность
так как объем 1 поверхностного слоя равен 5. Из формул (3.8) и (3.9) следует:
Экспериментальные данные показали, что длина молекулы ПАВ пропорциональна числу атомов углерода в углеводородном радикале Таким образом, размеры молекул впервые в истории химии были определены коллоидно-химическим методом. В дальнейшем эти результаты были подтверждены другими методами. 2.3.5. УРАВНЕНИЕ ШИШКОВСКОГО В 1908 г. киевский ученый Б.А. Шишковский эмпирическим путем получил уравнение, связывающее поверхностное натяжение водных растворов ПАВ с их концентрацией:
где - поверхностное натяжение воды; - поверхностное натяжение раствора; с - концентрация раствора; В - константа, мало зависящая от природы ПАВ внутри данного гомологического ряда; К - удельная капиллярная постоянная, которая увеличивается в 3-3,5 раза при удлинении углеводородного радикала на одно звено (группу -СН2-). Для того чтобы выяснить физический смысл постоянной В, обратимся к уравнению Гиббса:
Разделим переменные и примем, что Г = .
Интегрируем это уравнение, принимая во внимание, что - величина постоянная:
где А - постоянная интегрирования. Уравнение (3.12) получено в результате преобразования уравнения Гиббса для предельной адсорбции. Теперь для этих же условий запишем уравнение Шишковского, принимая во внимание, что максимальная адсорбция может быть достигнута при достаточно больших концентрациях ПАВ.
Сравнивая уравнения (3.13) и (3.12), видим, что
Теперь становится понятным, почему величина В в уравнении Шишковского остается постоянной в пределах одного гомологического ряда. Однако смысл удельной капиллярной постоянной К пока остается неясным. 2.3.6. ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ АДСОРБЦИИ ЛЕНГМЮРА Отметим основные положения этой теории. 1. Адсорбция мономолекулярна. 2. При адсорбции устанавливается динамическое равновесие, которое можно рассматривать как квазихимическое. В условиях равновесия скорости процессов адсорбции и десорбции равны. Константа адсорбционного равновесия
где Исходя из данной теории было выведено уравнение, которое мы приводим без вывода:
где - максимальная адсорбция ПАВ; Г - адсорбция при концентрации с; К - константа адсорбционного равновесия. Зависимость величины адсорбции от концентрации представлена на рис. 3.7 . На кривой четко видны три участка: I участок - прямая линия, выходящая из начала координат. Действительно, из уравнения Ленгмюра (3.15) при малых концентрациях III участок - соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом II участок - соответствует криволинейной части графика и описывается полным уравнением Ленгрмюра (3.15). Чтобы найти постоянные в уравнении Ленгмюра, его следует привести к линейной форме. Для этого правую и левую части уравнения надо "перевернуть":
Умножим обе части уравнения (3.16) на с:
На рис. 3.8 показан график Тангенс угла наклона прямой к оси абсцисс
Отрезок, отсекаемый прямой на оси ординат,
Доказано, что К в уравнении Шишковского (удельная капиллярная постоянная) и К в уравнении Ленгмюра (константа адсорбционного равновесия) - это одна и та же величина. Построив график , можно найти предельную адсорбцию и константу адсорбционного равновесия К, Так как адсорбция рассматривается как псевдохимическая реакция, на основе химической термодинамики можно записать
где Шишковский эмпирическим путем установил, что константа К увеличивается в 3-3,5 раза при удлинения цепи на одно звено . Напишем выражение для разности работ адсорбции двух соседних членов гомологического ряда.
где n - число атомов углерода в углеводородном радикале. Это означает, что для перевода каждой В заключение отметим, что помимо уравнения Гиббса, Шишковского и Ленгмюра существует уравнение Фрумкина, позволяющее рассчитать изменение поверхностного натяжения в результате адсорбции:
ЗАКЛЮЧЕНИЕ Адсорбция поверхностно-активных веществ (ПАВ) на поверхности "жидкий раствор-газ" - самопроизвольный процесс, обусловленный уменьшением поверхностного натяжения. Для поверхностно-инактивных веществ (ПИВ), повышающих поверхностное натяжение, характерна отрицательная адсорбция. Основным уравнением адсорбции является уравнение Гиббса, связывающее величину избыточной адсорбции с концентрацией ПАВ и его поверхностной активностью. Кривая, выражающая зависимость поверхностного натяжения от концентрации ПАВ при постоянной температуре, называется изотермой поверхностного натяжения. Тангенс угла наклона к оси абсцисс касательной к изотерме поверхностного натяжения при позволяет определить поверхностную активность. Аналитическим выражением изотермы поверхностного натяжения является уравнение Шишковского, выведенное на основе экспериментальных данных. Если известны постоянные этого уравнения и поверхностное натяжение растворителя, можно рассчитать поверхностное натяжение раствора заданной концентрации. Поверхностная активность ПАВ, согласно теории Ленгмюра, обусловлена дифильным строением их молекул: полярные группы втягиваются в глубь фазы, а неполярные углеводородные части выталкиваются в неполярную среду (воздух, газ), снижая тем самым поверхностное натяжение. С увеличением углеродной цепи на одну поверхностная активность увеличивается в 3-3,5 раза (правило Дюкло-Траубе). Исходя из теории Ленгмюра, были впервые рассчитаны площадь, занимаемая одной молекулой, и длина молекулы ПАВ. Зависимость величины адсорбции ПАВ от концентрации выражается уравнением Ленгмюра, выведенным исходя из представлений о скоростях процессов адсорбции и десорбции. Соответствующий график Г = f(c) называется изотермой Ленгмюра. Изменение поверхностного натяжения в зависимости от адсорбции рассчитываются по уравнению Фрумкина. ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ 1. Какие вещества называются поверхностно-активными, поверхностно-инактивными? 2. В чем состоят особенности строения молекул ПАВ и ПИВ и их адсорбции? 3. Как зависит поверхностное натяжение от концентрации ПАВ в растворе? 4. Что называется поверхностной активностью? Как ее можно определить графически и аналитически? 5. В чем заключается правило Дюкло-Траубе? 6. Как графически и аналитически можно определить предельную адсорбцию? 7. Как рассчитать площадь, занимаемую молекулой, и толщину поверхностного слоя? 8. Для водных растворов изоамилового спирта константы уравнения Шишковского: a) определите поверхностное натяжение растворов концентраций: 0,012; 0,016; ... 0,032 б) постройте изотерму поверхностного натяжения, в) определите графически поверхностную активность спирта, г) по уравнению Гиббса вычислите адсорбцию спирта для заданных в п. а) концентраций, д) постройте изотерму адсорбции и определите графически предельную адсорбцию, е) определите площадь, занимаемую одной молекулой спирта в поверхностном слое. 9. Сравните поверхностную активность этанола и н-бутанола в водных растворах одинаковой концентрации. 10. Изотерма адсорбции ПАВ описывается уравнением Ленгмюра 11. Предельная адсорбция пропионовой кислоты равна Закончив изучение главы 3, вы должны 1) знать: • понятия "поверхностно-активные" и "поверхностно-инактивные" вещества, "поверхностная активность"; • от чего зависит поверхностная активность ПАВ; • сущность теории мономолекулярной адсорбции Ленгмюра; • уравнения Гиббса, Шишковского, Ленгмюра, Фрумкина, какие зависимости каждое из них выражает; 2) уметь: • строить изотерму поверхностного натяжения и определять графически поверхностную активность; • рассчитывать поверхностную активность по уравнению Гиббса; • рассчитывать поверхностное натяжение по уравнению Шишковского; • строить изотерму гиббсовской адсорбции и определять предельную адсорбцию ПАВ; • исходя из предельной адсорбции рассчитывать поперечный размер и длину молекул . 2.4. ГЛАВА 4. АДСОРБЦИЯ ГАЗОВ И ПАРОВ НА ПОВЕРХНОСТИ ТВЕРДЫХ ТЕЛ На поверхности твердых тел при их контакте с газом или паром происходит положительная адсорбция, т.е. в условиях равновесия концентрация газа на поверхности выше, чем в объеме системы. 2.4.1. ОСОБЕННОСТИ АДСОРБЦИИ ГАЗА ИЛИ ПАРА НА ТВЕРДОМ АДСОРБЕНТЕ 1. Поверхность твердого тела, в отличие от поверхности жидкости, имеет сложный, неоднородный характер. Даже полированное зеркало имеет на поверхности выступы размерами до 2. Адсорбция происходит не на всей поверхности, а лишь на активных центрах. 3. Адсорбция кинетически обратима - наряду с адсорбцией газа происходит его десорбция. Адсорбционное равновесие устанавливается очень быстро. Молекула газа считается адсорбированной, если она находится в поверхностном слое в течение определенного времени, называемого временем адсорбции В зависимости от природы адсорбционных сил адсорбция газов и паров может быть физической и химической (см. параграф 2.2.5). С повышением температуры физическая адсорбция уменьшается, так как возрастает интенсивность теплового движения молекул газа, стремящихся равномерно распределиться по всему объему системы. Это приводит к уменьшению времени адсорбции, а следовательно, к уменьшению количества адсорбированного вещества. При хемосорбции молекулы адсорбата образуют с адсорбентом химические соединения. Хемосорбция может быть поверхностной (химическая реакция протекает только в пределах поверхностного слоя). Например, при адсорбции кислорода на поверхности алюминия происходит реакция:
в результате которой алюминий покрывается прочной оксидной пленкой. Хемосорбция может быть и объемной, когда слой вещества, образовавшегося в результате реакции на поверхности, не препятствует дальнейшему проникновению газа в объем твердого адсорбента, например:
Хемосорбция, в отличие от физической адсорбции, является необратимой. Обычно имеют место промежуточные случаи, когда основная масса адсорбированного вещества связана с адсорбентом сравнительно слабо, а следы его связаны прочно и могут быть удалены лишь путем длительного прогревания и откачивания. Водород на никеле при низких температурах адсорбируется физически ввиду малой скорости химической реакции, но при повышении температуры начинает протекать адсорбция с заметной энергией активации по типу химических реакций. 4. Поверхность адсорбента часто бывает пористой. Наличие пор приводит к тому, что адсорбция сопровождается капиллярной конденсацией. 5. Наряду с адсорбцией, представляющей собой поверхностный процесс, может происходить поглощение газа или пара всем объемом твердого тела (например, поглощение водорода металлическим палладием или платиной). Это явление называется адсорбцией. Адсорбцию газа на твердом адсорбенте количественно характеризуют величиной а:
где Иногда вместо количества газа указывают его массу (
Часто количество газа выражают через его объем, приведенный к нормальным условиям:
Каким образом охарактеризована адсорбция, легко установить по размерности приведенной величины . Величина адсорбции газа на твердом адсорбенте зависит от следующих факторов: • температуры; • концентрации (равновесного давления) пара или газа в поверхностном слое; • природы твердого тела; • природы газа. 2.4.2. ЗАВИСИМОСТЬ АДСОРБЦИИ ГАЗА ОТ ЕГО КОНЦЕНТРАЦИИ (ДАВЛЕНИЯ) ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ Адсорбцию газа можно характеризовать: 1. Зависимостью количества адсорбированного вещества а от температуры при постоянном равновесном давлении р. Кривые а = f(p) называются изобарами адсорбции. Выше отмечалось, что при физической адсорбции с повышением температуры адсорбция уменьшается: da / dT < 0. 2. Зависимостью количества адсорбированного вещества от равновесного давления при постоянной температуре. Графики а = f(p) при Т = const называются изотермами адсорбции. Изотермы имеют решающее значение при изучении адсорбции, поэтому мы будем рассматривать именно эти кривые. На рис. 4.1 представлены типичные изотермы физической адсорбции при двух температурах. Изотермы имеют три участка. Начальный почти прямолинейный участок I свидетельствует о том, что при малых давлениях адсорбция практически пропорциональна давлению. Это отвечает ситуации, когда поверхность адсорбента практически свободна. Горизонтальный участок III показывает, что при больших давлениях адсорбция практически не зависит от давления. Это связано с тем, что поверхность уже насыщена адсорбтивом. Промежуточный участок кривой II соответствует частичному заполнению поверхности. В соответствии со сказанным выше о влиянии температуры на адсорбцию, верхняя кривая на рис. 4.1, отвечающая более низкой температуре, лежит выше нижней. Для аналитического описания адсорбции Фрейндлих вывел эмпирическое уравнение:
где b и 1/n - константы, зависящие от природы газа и температуры и не зависящие от равновесного давления газа в системе. Уравнение Фрейндлиха представляет собой уравнение параболы. С его помощью можно описать не всю изотерму, а только ее криволинейный участок II. Для линейного участка I константа 1/n должна быть равной единице. Тогда уравнение Фрейндлиха примет вид:
Таким образом, величина адсорбции при малых давлениях газа прямо пропорциональна давлению (закон Генри). Для описания горизонтального участка III константа 1/n должна быть равна нулю. Тогда Итак, уравнение Фрейндлиха справедливо только для криволинейного участка изотермы. Постоянные в уравнении Фрейндлиха b и 1/n находят на основе опытных данных. Для этого степенное уравнение логарифмируют.
В координатах ln a - ln p - это уравнение прямой (рис. 4.2 ), не проходящей через начало координат. Тангенс угла наклона Следует отметить, что для описания адсорбции на твердых адсорбентах справедливо также фундаментальное уравнение Гиббса (3.1), однако практическое применение этого уравнения затруднено из-за невозможности непосредственного измерения поверхностного натяжения на границе "твердое тело-газ". 2.4.3. ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ АДСОРБЦИИ ЛЕНГМЮРА Эту теорию мы рассматривали применительно к адсорбции растворенного вещества на поверхности жидкости (см. параграф 2.3.6). При разработке теории мономолекулярной адсорбции газа на твердом адсорбенте И. Ленгмюр исходил из следующих допущений: адсорбция локализована (молекулы не перемещаются по поверхности) на отдельных адсорбционных центрах, каждый из которых взаимодействует лишь с одной молекулой газа; в результате образуется мономолекулярный слой; адсорбционные центры энергетически эквивалентны - поверхность адсорбента эквипотенциальна; адсорбированные молекулы не взаимодействуют между собой; адсорбцию газа на твердом адсорбенте можно рассматривать как квазихимическую реакцию, уравнение которой можно записать так:
С увеличением концентрации (давления) газа равновесие сдвигается в сторону образования адсорбционного комплекса и свободных активных центров становится меньше. Константа адсорбционного равновесия:
где Но концентрация комплекса на поверхности - это величина адсорбции, т.е.:
где
Решаем уравнение (4.7) относительно а:
Выражение (4.8) называется уравнением изотермы мономолекулярной адсорбции Ленгмюра. Так как концентрации газов и паров практически пропорциональны парциальным давлениям, изотерма Ленгмюра принимает вид:
Уравнение Ленгмюра хорошо описывает изотерму адсорбции (рис. 4.1), давая при малых и больших давлениях на графике приблизительно прямолинейные участки, чего не дает уравнение Фрейндлиха. Действительно при малых давлениях в знаменателе уравнения (4.9) можно пренебречь величиной
Уравнение Ленгмюра принимает вид, тождественный уравнению (4.2), и соответствует начальному участку изотермы. При больших давлениях р в знаменателе (4.9) можно пренебречь единицей по сравнению с , тогда а = , т.е. адсорбированное количество вещества не зависит от давления, что отвечает прямолинейному участку изотермы, параллельному оси абсцисс. Уравнение Ленгмюра может быть решено графически. Перенесем числитель в уравнении (4.9) в знаменатель, а знаменатель - в числитель:
Умножим обе части уравнения (4.11) на р:
В координатах Котангенс угла наклона прямой к оси абсцисс равен , a отрезок, отсекаемый прямой на оси ординат, равен Таким образом, построив по экспериментальным данным график, представленный на рис. 4.3 , можно определить предельную адсорбцию , а затем - константу адсорбционного равновесия К. С помощью теории мономолекулярной адсорбции можно описать ступенчатую адсорбцию, изотерма которой представлена на рис. 4.4 . Характер изотермы легко объяснить, если принять, что на поверхности адсорбента имеются группы активных центров, резко отличающихся по своей адсорбционной активности. Так, I ступень отвечает заполнению более активных центров, II ступень - заполнению следующих по активности центров и т.д. Уравнение Ленгмюра можно использовать только при условии, что адсорбция вещества сопровождается образованием мономолекулярного слоя. Это условие выполняется достаточно строго при хемосорбции и физической адсорбции газов при небольших давлениях и температурах выше критической (в отсутствии конденсации на поверхности адсорбента). Опыт показывает, что наряду с изотермами адсорбции, представленными на рис. 4.1 и 4.4, встречаются S-образные изотермы, на которых нет участка, параллельного оси давлений и отвечающего насыщению поверхности адсорбента молекулами адсорбтива. Вид таких изотерм представлен на рис. 4.5 . В связи с необходимостью объяснения характера таких изотерм возникла потребность в других теориях. 2.4.4. ТЕОРИИ ПОЛИМОЛЕКУЛЯРНОЙ АДСОРБЦИИ В точке А изотерма, показанная на рис. 4.5, круто поднимается кверху, что указывает на то, что связывание адсорбтива с адсорбентом после образования молекулярного слоя не прекращается. Для объяснения этого Поляни в 1915 г. предложил теорию полимолекулярной адсорбции, называемую также потенциальной. Основные положения теории Поляни: 1) адсорбция обусловлена чисто физическими силами; 2) на поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи поверхности и образуют около этой поверхности непрерывное силовое поле; 3) адсорбционные силы действуют на сравнительно большие расстояния, превышающие размеры отдельных молекул адсорбтива и поэтому можно говорить о существовании у поверхности адсорбента адсорбционного объема, который заполняется молекулами адсорбтива; 4) действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии становится равным нулю; 5) притяжение данной молекулы поверхностью адсорбента не зависит от наличия в адсорбционном пространстве других молекул; 6) адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный объем не изменяется; 7) под воздействием адсорбционного поля возникает возможность образования нескольких слоев молекул адсорбата. Наибольшее притяжение и сжатие испытывает первый адсорбционный слой; газообразные продукты в нем конденсируются в жидкость. Притяжение последующих слоев снижается до тех пор, пока плотность вещества понизится до его плотности в окружающей среде. Теория полимолекулярной адсорбции Поляни позволяет описать адсорбцию на пористых адсорбентах и качественно объяснить характер S-образной изотермы. Однако эта теория не привела к выводу уравнения, описывающего эту изотерму. Брунауэр, Эммет и Теллер разработали теорию применительно к адсорбции паров. Эта теория получила название теории БЭТ в соответствии с начальными буквами фамилий авторов. Эта теория основана на следующих положениях: 1) на поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров; 2) каждая молекула первого слоя представляет собой активный центр для дальнейшей адсорбции, что приводит к образованию второго, третьего и т.д. слоев. При этом построение последующих слоев возможно при незаполненном первом; 3) взаимодействием соседних адсорбированных молекул в рамках одного слоя пренебрегают; 4) молекулы адсорбтива в последующих слоях по сумме статистических состояний подобны молекулам жидкости и отличаются от молекул первого слоя. Таким образом, адсорбированная фаза может быть представлена как совокупность адсорбционных комплексов - молекулярных цепочек, начинающихся молекулами первого слоя, непосредственно связанными с поверхностью адсорбента. При этом цепочки не взаимодействуют между собой. Схема полимолекулярной адсорбции по теории Брунауэра, Эммета и Теллера представлена на рис. 4.6 . Итак, теория БЭТ исходит из наличия на поверхности адсорбента активных центров. В этом состоит ее сходство с теорией Ленгмюра. Вместе с тем, подобно теории Поляни, она допускает возможность образования нескольких адсорбционных слоев. Авторы теории рассматривают адсорбцию как серию последовательных квазихимических реакций:
где А - активный центр, В - молекула адсорбтива, Авторы теории приняли, что во всех слоях, кроме первого, взаимодействуют между собой в основном молекулы адсорбата, как и при конденсации. Поэтому было принято, что:
где Брунауэр, Эммет и Теллер вывели следующее уравнение изотермы адсорбции паров:
В этом уравнении: Уравнение (4.13) называется уравнением полимолекулярной адсорбции БЭТ. При малых значениях р, далеких от , т.е. при На теории БЭТ основан стандартный метод измерения удельной поверхности адсорбентов, катализаторов, порошков и других материалов. Для этого используется уравнение БЭТ в линейной форме:
По экспериментальным данным строят график в координатах Из графика находят , а затем рассчитывают удельную поверхность:
где - число Авогадро, - площадь, занимаемая одной молекулой адсорбтива. В качестве адсорбтива обычно используют газы (азот, аргон, криптон), в которых межмолекулярное взаимодействие на поверхности адсорбента является слабым, что соответствует исходным допущениям теории. Принимаются следующие значения : азот - 0,162 Необходимо отметить, что, несмотря на ряд недостатков, связанных с допущениями, которые лежат в основе теории БЭТ, она является весьма полезной теорией физической адсорбции. 2.4.5. КАПИЛЛЯРНАЯ КОНДЕНСАЦИЯ Капиллярная конденсация - это процесс конденсации паров в порах твердого тела. Это явление характерно для паров веществ и обусловлено наличием у адсорбента мелких пор. В таких порах пары конденсируются при давлениях р, меньших, чем давление насыщенного пара, над плоской поверхностью жидкости при той же температуре - . Это становится возможным при условии смачивания жидкостью стенок капилляра и образования вогнутых менисков (если образовавшаяся жидкость не смачивает поверхность, образуется выпуклый мениск, конденсация пара над которым происходит при давлении, большем давления пара над плоской поверхностью). Количество удерживаемой капиллярными силами жидкости зависит от радиуса кривизны r поверхности раздела "жидкость-пар" согласно уравнению Кельвина (Томсона):
где - поверхностное натяжение жидкости, образующейся при конденсации пара, Капиллярной конденсации предшествует адсорбция пара на поверхности конденсации. Капиллярная конденсация начинается при таком значении адсорбировавшегося вещества, при котором образуется мениск жидкости с радиусом кривизны Согласно уравнению Кельвина, при этом В тех случаях, когда адсорбция осложнена капиллярной конденсацией, изотерма адсорбции отличается от приведенных ранее (см. рис. 4.1, 4.4 и 4.6) и имеет вид, представленный на рис. 4.8 . Капиллярную конденсацию используют для улавливания паров пористыми сорбентами. Большую роль она играет в процессах сушки, удерживания влаги почвами, строительными и другими материалами. 2.4.6. ЗАВИСИМОСТЬ АДСОРБЦИИ ГАЗОВ ОТ СВОЙСТВ АДСОРБЕНТА Рассмотренные особенности адсорбции газов на твердых адсорбентах свидетельствуют о том, что определяющим в этом виде адсорбции является состояние поверхности адсорбента. Все адсорбенты подразделяются на две принципиально разные группы: 1) адсорбенты с гладкой поверхностью (непористые адсорбенты); 2) пористые адсорбенты. При одинаковой степени измельчения пористые адсорбенты имеют гораздо большую удельную поверхность чем непористые, и, кроме того, адсорбция на них может сопровождаться капиллярной конденсацией. НЕПОРИСТЫЕ АДСОРБЕНТЫ Адсобрция на непористых адсорбентах зависит в основном: от сродства адсорбента к адсорбтиву. Это сродство тем сильнее, чем резче выражена склонность к образованию определенных связей. Так, графитированная сажа неполярна, поэтому на ней сильнее адсорбируются неполярные органические соединения. На поверхности ионных кристаллов (полярные адсорбенты) лучше адсорбируются полярные вещества. На поверхности оксидов обычно имеются гидроксильные группы, способные образовывать водородные связи, поэтому они прочно удерживают воду, спирты, амины и т.д.; от дисперсности адсорбента. Вы помните, что чем меньше размер частицы, тем больше ее удельная поверхность . В промышленности получают высокодисперсные порошки с удельной поверхностью порядка сотен квадратных метров на 1 г вещества, однако из-за их легкой вспыливаемости их чаще используют в качестве наполнителей полимеров, лаков и смазок. Отметим наиболее распространенные непористые адсорбенты: оксиды ПОРИСТЫЕ АДСОРБЕНТЫ Пористые тела - это твердые тела, внутри которых имеются поры, обусловливающие наличие внутренней межфазной поверхности. Адсорбция на пористых телах, так же как на непористых, требует достаточного сродства между адсорбентом и адсорбтивом. Однако кроме этого она зависит: от размеров пор; от пористости. В зависимости от размеров пор пористые адсорбенты подразделяют на а) макропористые, б) переходнопористые (капиллярно-пористые), в) микропористые (размеры пор соизмеримы с размерами адсорбированных молекул), в пределах 0,5-1,5 нм, в пределах 500-1000 . Противоположные стенки пор так близко расположены друг к другу, что их силовые поля перекрываются и адсорбция происходит во всем объеме пор. К ним относятся цеолиты и активные угли. Пористость (П) - это отношение объема пор
т.е. пористость определяет объем пор, приходящихся на единицу объема тела, т.е. долю пустот в его структуре. Пористость может измеряться в долях или процентах. Пористость определяет удельную поверхность адсорбента - чем она больше, тем больше емкость адсорбента. Структура пористого тела в значительной мере влияет на кинетику адсорбции, так как появляется стадия переноса вещества внутри пор. Часто эта стадия определяет время установления равновесия. К числу наиболее распространенных пористых адсорбентов относятся активные угли (их получают из каменного угля, торфа дерева, животных костей, ореховых косточек и др., причем лучшими считаются угли, полученные из скорлупы кокосовых орехов или абрикосовых косточек), силикагели и алюмогели (гидратированные Цеолиты (от греч. цео - кипеть, литос - камень) получили свое название за способность эффективно поглощать воду, которая при нагревании испаряется, производя впечатление кипящего камня. Цеолиты являются молекулярными ситами, адсорбирующими лишь определенные компоненты из газовых смесей. Цеолиты представляют собой природные и синтетические алюмосиликаты, имеющие трубчатые полости строго определенного для каждого класса диаметра в диапазоне 0,4-1,1 нм. 2.4.7. ЗАВИСИМОСТЬ АДСОРБЦИИ ОТ СВОЙСТВ ГАЗА Как отмечалось выше, для положительной адсорбции адсорбент должен обладать определенным сродством к адсорбтиву. Газ адсорбируется тем лучше, чем • легче он сжижается; • выше его критическая температура; • выше его температура конденсации; • больше значение константы а в уравнении Ван-дер-Ваальса: (поправка В таблице 4.1 приведены данные, характеризующие связь между адсорбцией и физическими свойствами некоторых газов. Таблица 4.1. Зависимость адсорбции от физических свойств некоторых газов Газ Молярная масса, г/моль Температура кипения, К Критическая температура, К Объем газа в см3 адсорбируемого 1 г угля при температуре 15оС SO2 64 263 430 379,7 NH3 17 240 405 180,9 N2O 44 183 309 54,2 C2H2 26 189 308 48,9 CO2 44 195 242 47,6 CO 28 81 134 9,3 N2 28 77 126 8,0 H2 2 20 33 4,7 Связь между адсорбцией и физическими свойствами газов обнаруживается только при физической адсорбции. При хемосорбции вследствие ее специфичности такой связи обычно нет. 2.4.8. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ АДСОРБЦИИ ГАЗОВ Адсорбция газов на твердых адсорбентах применяется для: • извлечения отдельных компонентов из газовых смесей и для полного разделения смесей; • поглощения отравляющих газов; • рекуперации (восстановления) растворителей: ацетона, бензола, ксилола, хлороформа, сероуглерода и др.; • улавливания различных промышленных выбросов, очистки воздуха от агрессивных газов; • осушки газов в различных целях: повышения теплотворной способности природного газа, предотвращения образования ледяных "пробок" в трубопроводах, обеспечения сухой атмосферы в производствах и т.д.; • осуществления разнообразных гетерогенных реакций на границах раздела фаз. Огромную роль адсорбция играет в гетерогенном катализе, когда на поверхности катализатора происходит концентрирование реагентов, определенное ориентирование молекул, поляризация и переход в наиболее активное состояние, способствующее ускорению процесса. Питание растений углекислым газом из воздуха связано с предварительной адсорбцией газа на листьях. Дыхание животных и человека протекает в результате предварительной адсорбции кислорода на поверхности легких. ЗАКЛЮЧЕНИЕ Адсорбция газов на поверхности твердых тел находит широкое практическое применение, в связи с этим исследование закономерностей адсорбционных процессов представляет значительный интерес. Среди факторов, от которых зависит адсорбция газа на твердом адсорбенте, существенным является структура поверхности. Если в жидкостях свойства поверхности в различных ее участках одинаковы, то на поверхности твердых тел положение атомов фиксировано, и строение поверхности имеет сложный и неоднородный характер. С этим связаны значительные трудности, возникающие при исследовании адсорбционных процессов на твердых адсорбентах. Среди факторов, от которых зависит адсорбция газа или пара на твердом адсорбенте, важным является равновесное давление адсорбтива. Зависимость адсорбции от равновесного давления при постоянной температуре выражается кривыми а = f(р), называемыми изотермами адсорбции. На изотермах мономолекулярной адсорбции имеются три участка. При очень малых давлениях и, следовательно, малых заполнениях поверхности адсорбатом адсорбция прямо пропорциональна давлению (закон Генри). При средних давлениях изотерма становится криволинейной. Для этой области справедливо уравнение Фрейндлиха, которым часто пользуются для практических расчетов. При высоких давлениях адсорбция перестает зависеть от равновесного давления адсорбтива - этот участок изотермы параллелен оси давлений, достигается предельная адсорбция. Строгая теория изотермы мономолекулярной адсорбции была создана И. Ленгмюром. В основу этой теории положена следующая модель. 1. Поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются молекулы адсорбтива. 2. На одном центре адсорбируется только одна молекула адсорбтива. 3. Адсорбция на данном центре не влияет на адсорбцию на других центрах, т.е. взаимодействием адсорбированных молекул можно пренебречь. Этой модели отвечает уравнение Ленгмюра, которое полностью описывает изотерму мономолекулярной адсорбции. С помощью теории Ленгмюра можно также описать ступенчатую адсорбцию. Модель Ленгмюра является идеализированной, она пригодна только в тех случаях, когда имеет место мономолекулярная адсорбция. Модель адсорбции, принципиально отличную от ленгмюровской, предложил Поляни. Согласно этой модели вблизи поверхности адсорбента существует силовое поле, убывающее с удалением от поверхности. Вследствие этого давление адсорбтива, вдали от поверхности равное р, вблизи поверхности возрастает и на некотором расстоянии от нее достигает значения , при котором адсорбтив конденсируется. Эта модель получила название потенциальной теории адсорбции. Теория Поляни позволяет описать адсорбцию на пористых адсорбентах и качественно объяснить характер S-образной изотермы. Дальнейшим развитием теории полимолекулярной адсорбции явилась теория БЭТ. Эта теория постулирует, что при температурах ниже критической каждая молекула, адсорбированная в первом слое, является центром для молекул, образующих второй слой и т.д. При этом считается, что теплота адсорбции во всех слоях, кроме первого, равна теплоте конденсации. Уравнение БЭТ описывает всю S-образную изотерму адсорбции. Решение уравнения БЭТ позволяет определить удельную поверхность адсорбента. Существует еще один механизм, приводящий к дополнительной адсорбции адсорбтивов ниже их критической температуры на пористых адсорбентах. Это капиллярная конденсация. Если в поре образуется вогнутый мениск адсорбата, то в ней начинается конденсация при давлениях, меньших, чем давление насыщенного пара над плоской поверхностью. Капиллярная конденсация приводит к резкому подъему изотермы адсорбции. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. В чем состоят особенности адсорбции газов и паров на твердых поверхностях? 2. Чем отличается физическая адсорбция от хемосорбции? 3. Какие участки есть на изотерме Ленгмюра? Какие математические уравнения характеризуют каждый участок? 4. Перечислите основные положения теории Ленгмюра. 5. Как с помощью теории Ленгмюра можно объяснить ступенчатую адсорбцию? 6. В чем состоит сущность потенциальной теории Поляни? 7. Какие допущения лежат в основе теории БЭТ? 8. Как с помощью теории БЭТ можно определить удельную поверхность адсорбента? 9. Какой процесс называется капиллярной конденсацией? 10. От каких факторов зависит адсорбция на пористых адсорбентах? 11. Какие свойства газов влияют на их адсорбцию? Закончив изучение главы 4, вы должны 1) знать: • основные положения теорий мономолекулярной и полимолекулярной адсорбции газов на твердых поверхностях; • уравнения Фрейндпиха, Ленгмюра, БЭТ, Кельвина, что они характеризуют; • факторы, от которых зависит адсорбция газов и паров на непористых и пористых адсорбентах; 2) уметь: • объяснять характер различных изотерм адсорбции; • определять величины и К с помощью уравнения Ленгмюра; • графически решать уравнение БЭТ. 2.5. ГЛАВА 5. АДСОРБЦИЯ РАСТВОРЕННОГО В ЖИДКОСТИ ВЕЩЕСТВА НА ТВЕРДОМ АДСОРБЕНТЕ Адсорбция на границе раздела "твердое тело-жидкость" - это самопроизвольное концентрирована растворенного вещества вблизи поверхности твердого адсорбента. При рассмотрении адсорбции из растворов на твердом адсорбенте, так же как при исследовании адсорбции на границе раздела "жидкий раствор-газ", необходимо учитывать все межмолекулярные взаимодействия в растворе: между молекулами растворителя, между растворенным веществом и растворителем, между растворенными веществами. В то же время необходимо учитывать сложное строение поверхности твердого тела, его силовое поле, что, как вы понимаете, не так-то просто. Пока не существует единой теории процессов адсорбции на твердых адсорбентах. Нет единого мнения, на что больше похожа адсорбция растворенного вещества на твердых адсорбентах - на адсорбцию газа на твердых телах или на адсорбцию растворенного вещества на поверхности раствора. Одни исследователи считают, что адсорбция растворенного вещества на твердом адсорбенте подчиняется тем же законам, что и адсорбция газов. Другие - что закономерности адсорбции на границе "твердое тело-раствор" ближе к адсорбции на границе "раствор-газ". Так как в обоих случаях решающее значение имеет взаимодействие между молекулами в жидкой фазе, поиски общих закономерностей должны основываться на теории жидкого состояния. Пока единой теории адсорбции не создано используется аппарат как той, так и другой адсорбции. Явления адсорбции из жидких растворов на твердых адсорбентах многообразны и классифицируются обычно в зависимости от природы адсорбтива: молекулярная адсорбция; ионная адсорбция; адсорбция коллоидных частиц. 2.5.1. МОЛЕКУЛЯРНАЯ АДСОРБЦИЯ ИЗ РАСТВОРОВ Молекулярная адсорбция - адсорбция из растворов неэлектролитов или слабых электролитов. В этих случаях растворенные вещества адсорбируются на поверхности твердого тела в виде молекул. Особенность такой адсорбции состоит в том, что наряду с растворенным веществом адсорбируются молекулы растворителя. Активные центры на поверхности твердого тела в той или иной степени заняты молекулами растворителя, для адсорбции растворенного вещества его молекулы должны вытеснить с поверхности молекулы растворителя. Экспериментально адсорбцию растворенных веществ на твердом адсорбенте а изучают, измеряя молярную концентрацию раствора до контакта с адсорбентом (
где а - количество адсорбированного вещества, приходящееся на 1 г адсорбента; m - масса адсорбента, г; V - объем раствора, из которого идет адсорбция, . Факторы, влияющие на молекулярную адсорбцию: • равновесная концентрация растворенного вещества; • природа растворителя; • природа адсорбента; • природа растворенного вещества; • температура, время адсорбции. 2.5.2. ЗАВИСИМОСТЬ МОЛЕКУЛЯРНОЙ АДСОРБЦИИ ОТ РАВНОВЕСНОЙ КОНЦЕНТРАЦИИ АДСОРБТИВА (Cs) Эта зависимость описывается изотермами адсорбции, которые можно свести к следующим пяти типам: 1) изотерма Ленгмюра, которая отвечает мономолекулярной адсорбции и описывается уравнением Ленгмюра:
2) изотерма полимолекулярной адсорбции, которая может быть описана уравнением теории БЭТ; 3) изотерма адсорбции, которая сопровождается абсорбцией; 4) изотерма адсорбции для случаев, когда адсорбент достаточно хорошо адсорбирует растворитель; 5) изотерма отрицательной адсорбции, когда концентрация молекул растворенного вещества в адсорбционном слое меньше, чем в объеме раствора. В области средних концентраций адсорбтива адсорбция достаточно хорошо описывается уравнением Фрейндлиха:
где и 1/n - постоянные величины, значения которых находят из экспериментальных данных. Для описания адсорбции из раствора на твердом теле применимо и уравнение Гиббса:
однако сложность определения s на границе твердое тело-раствор не позволяет непосредственно использовать это уравнение. 2.5.3. ВЛИЯНИЕ НА МОЛЕКУЛЯРНУЮ АДСОРБЦИЮ ПРИРОДЫ РАСТВОРИТЕЛЯ Так как молекулы адсорбтива и молекулы растворителя являются конкурентами при адсорбции, очевидно что чем хуже адсорбируется растворитель, тем лучше будет адсорбироваться растворенное вещество. А растворитель адсорбируется тем хуже, чем больше его поверхностное натяжение (). Отсюда вытекают 2 закономерности: 1) адсорбция на твердом адсорбенте идет лучше из водных растворов и хуже из органических растворов; 2) правило Шилова: чем лучше растворитель растворяет вещество, тем хуже вещество адсорбируется из раствора. 2.5.4. ВЛИЯНИЕ НА МОЛЕКУЛЯРНУЮ АДСОРБЦИЮ ПРИРОДЫ АДСОРБЕНТА Из свойств адсорбента на адсорбцию влияют его полярность и пористость. Экспериментальные данные позволили сформулировать правило: неполярные твердые тела лучше адсорбируют неполярные адсорбтивы и наоборот. Влияние пористости зависит от соотношения размеров пор адсорбента и молекул растворенного вещества. Если молекулы растворенного вещества малы и легко проникают в поры твердого тела, то пористость больше и лучше идет адсорбция. Крупные молекулы не могут попасть в узкие поры адсорбента, и адсорбция уменьшается. Это подтверждает правило Дюкло-Траубе - т.е. с ростом длины молекулы адсорбтива выше определенного критического значения адсорбция уменьшается. 2.5.5. ВЛИЯНИЕ НА МОЛЕКУЛЯРНУЮ АДСОРБЦИЮ ПРИРОДЫ АДСОРБТИВА Определить влияние природы адсорбтива можно, исходя из правила уравнивания полярностей Ребиндера. Процесс адсорбции идет в сторону уравнивания полярностей фаз и тем сильнее, чем больше первоначальная разность полярностей. Полярность фазы можно характеризовать величиной
где Из правила уравнивания полярностей Ребиндера можно сделать ряд важных выводов, касающихся адсорбции ПАВ из растворов. Мы знаем, что ПАВ в силу своей дифильности растворяются как в полярных растворителях, так и в неполярных. В зависимости от вида растворителя должен выбираться подходящий адсорбент. Так, для адсорбции ПАВ из водных растворов следует использовать гидрофобные (неполярные) твердые тела, например, уголь. В этом случае выполняется условие: Для адсорбции ПАВ из неполярных растворителей (бензола, толуола и т.д.) следует использовать гидрофильный адсорбент - силикагель ( Можно отметить также и частные правила. 1. С увеличением молярной массы растворенного вещества его адсорбционная способность возрастает. На этой закономерности основан ферментативный катализ: сложные органические молекулы адсорбируются на ферментах, разлагаются под их действием на более мелкие, которые десорбируются, уступая место более крупным молекулам. 2. Ароматические соединения адсорбируются лучше, чем алифатические. 3. Непредельные органические соединения адсорбируются лучше, чем предельные. 4. При адсорбции предельных органических кислот и спиртов качественно соблюдается эмпирическое правило Дюкло-Траубе: Адсорбционная способность увеличивается в 3-3,5 раза при удлинении углеводородной цепи на одно звено (-). Следует заметить, что указанные частные правила не выполняются для адсорбции на мелкопористых адсорбентах. 2.5.6. ВРЕМЯ АДСОРБЦИИ. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА АДСОРБЦИЮ Адсорбция из растворов идет медленнее адсорбции газов, так как диффузия в жидкостях протекает значительно медленнее. Она может быть ускорена перемешиванием. Особенно медленно происходит адсорбция больших молекул на мелкопористых адсорбентах, так как в этих случаях равновесие устанавливается медленно или вовсе не наступает. Повышение температуры приводит к уменьшению адсорбции, но в меньшей степени, чем при адсорбции газов. 2.5.7. ИОННАЯ АДСОРБЦИЯ ИЗ РАСТВОРОВ Ионная адсорбция - адсорбция из растворов сильных электролитов. В этом случае растворенное вещество адсорбируется в виде ионов. Ионная адсорбция является более сложным процессом по сравнению с молекулярной адсорбцией, так как в растворе присутствуют уже частицы как минимум 3 видов: катионы, анионы растворенного вещества и молекулы растворителя. ОСОБЕННОСТИ ИОННОЙ АДСОРБЦИИ 1. Адсорбируются заряженные частицы (ионы), а не молекулы. 2. Адсорбция происходит только на полярных адсорбентах, часто ее так и называют - полярная адсорбция. 3. Адсорбция сопровождается образованием двойного электрического слоя (ДЭС). 4. Адсорбция является избирательной, т.е. на каждом данном адсорбенте катионы и анионы адсорбируются неодинаково. 5. В основе ионной адсорбции лежат химические силы, и она чаще всего кинетически необратима. 6. Для ионной адсорбции характерно явление обменной адсорбции. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ИОННУЮ АДСОРБЦИЮ 1. Химическая природа адсорбента Чем более полярным является адсорбент, тем лучше он адсорбирует ионы из водных растворов. На активных центрах, несущих положительный заряд, адсорбируются анионы, на отрицательных - катионы. 2. Химическая природа ионов а) На адсорбцию ионов большое влияние оказывает величина радиуса иона. Чем больше кристаллический радиус иона при одинаковом заряде, тем лучше он адсорбируется, так как с увеличением кристаллического радиуса иона возрастает его поляризуемость, а следовательно, способность притягиваться к полярной поверхности - адсорбироваться на ней. Одновременно увеличение кристаллического радиуса приводит к уменьшению гидратации иона, а это облегчает адсорбцию. В соответствии с этим ионы можно расположить в ряды по возрастающей способности к адсорбции, называемые лиотропными рядами, или рядами Гофмейстера:
б) Чем больше заряд иона, тем сильнее ион притягивается противоположно заряженной поверхностью твердого тела, тем сильнее адсорбция:
Особый интерес для коллоидной химии представляет адсорбция ионов поверхностью кристалла, в состав которого входят такие же или родственные ионы. В этом случае адсорбцию можно рассматривать как кристаллизацию, т.е. достройку кристаллической решетки способными адсорбироваться на ней ионами. Это позволило Панету и Фаянсу сформулировать следующее правило: На кристаллической поверхности адсорбируются те ионы, которые способны достраивать кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл. Так, если мы имеем кристалл хлорида серебра nAgCl, а в растворе ионы
2.5.8. ИОНООБМЕННАЯ АДСОРБЦИЯ Ионообменная адсорбция - это процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из жидкого раствора. Первые сообщения об ионообменной адсорбции были сделаны в 1850 г. независимо друг от друга английскими учеными Томпсоном и Уэем. Изучая способность почв к поглощению удобрений и их вымыванию дождем, они обнаружили обмен ионами между почвой и водными растворами солей. ОСОБЕННОСТИ ОБМЕННОЙ АДСОРБЦИИ Обменная адсорбция специфична, т.е. к обмену способны только определенные ионы, по своей природе этот процесс приближается к химическим явлениям; не всегда обратима; протекает более медленно, чем молекулярная адсорбция; может приводить к изменению рН среды. Вещества, проявляющие способность к ионному обмену, называются ионитами. Иониты имеют структуру в виде каркаса, "сшитого", обычно, ковалентными связями. Каркас имеет положительный или отрицательный заряд, скомпенсированный противоположным зарядом подвижных ионов (противоионов), которые могут легко заменяться на другие ионы с зарядом того же знака. Каркас выступает в роли полииона и обусловливает нерастворимость ионита в растворителях. КЛАССИФИКАЦИЯ ИОНИТОВ Единой классификации ионитов нет. Обычно их классифицируют по следующим признакам: по происхождению (природные и синтетические); по составу (неорганические и органические); по знаку заряда обменивающихся ионов (катчониты, аниониты, амфолиты). К природным неорганическим ионитам, обменивающимся катионами, относятся кристаллические силикаты типа цеолитов: шабазит, глауконит и др.; к природным анионитам - некоторые минералы, например, апатит. Природными ионитами органического происхождения являются, например, содержащиеся в почве гуминовые кис-доты - высокомолекулярные соединения с различными функциональными группами, способными к ионному обмену. Они обладают амфотерными свойствами и поэтому могут обменивать как катионы, так и анионы. Природные иониты не нашли широкого практического применения, так как имеют ряд недостатков, в частности, они химически нестойки и не обладают достаточной механической прочностью. Первыми синтетическими ионитами были плавленые и гелеобразные пермутиты - алюмосиликаты, подобные природным цеолитам. Гелеобразные пермутиты сравнительно долго применяли для умягчения воды. Широкое распространение получили иониты на основе органических смол - синтетические ионообменные смолы. Их преимущества: • высокая механическая прочность; • высокая химическая стойкость; • большая сорбционная емкость, так как обмен ионами часто идет по всему объему смолы, а структура смолы обычно проницаема для ионов, находящихся в растворе. Размеры зерен ионитов находятся в пределах от 0,25 до 2,0 мм. Смолы, способные обменивать катионы, называют катионитами, они содержат группы: Смолы, способные обмениваться анионами, называют анионитами, они содержат активные группы: Если ионит привести в контакт с раствором электролита, то через определенное время установится равновесие между ионами в ионите и в растворе, называемое ионообменным равновесием. Ионообменное равновесие в общем виде выглядит так:
где Константа этого равновесия К, называемая константой ионного обмена, равна:
где Часто для характеристики ионного обмена пользуются уравнением Никольского:
Для данного ионита константа обмена отражает свойства обменивающихся ионов и характеризует селективность ионита по отношению к тем или иным ионам. 2.5.9. СМАЧИВАНИЕ Смачивание - это поверхностное явление, заключающееся во взаимодействии жидкости с твердым или другими жидкими телами при наличии одновременного контакта с воздухом. Явления смачивания близки к адсорбционным, так как и те и другие определяются интенсивностью взаимодействия между молекулами различных веществ. Рассмотрим явление смачивания на примере капля жидкости, нанесенной на поверхность твердого тела (существует также явление смачивания одной жидкости другой). При этом могут наблюдаться два крайних случая. 1 случай. Капля жидкости самопроизвольно растекается на поверхности, пока не покроет всю поверхность или пока слой жидкости не станет мономолекулярным. Это полное смачивание. Пример: капля воды на обезжиренном стекле. 2 случай. Капля жидкости на твердой поверхности самопроизвольно принимает почти сферическую форму. В этом случае говорят, что твердая поверхность не смачивается жидкостью, наблюдается полное несмачивание. Пример: капля ртути на неметаллической поверхности. Между этими крайними случаями наблюдаются различные промежуточные, когда поверхность частично смачивается жидкостью. Из термодинамики вы знаете, что самопроизвольно протекают процессы, приводящие к уменьшению свободной энергии системы. В данном случае процесс протекает на поверхности, следовательно, он должен сопровождаться уменьшением свободной поверхностной энергии, которая характеризуется поверхностным натяжением . До того, как каплю нанесли на твердую поверхность, эта поверхность находилась в контакте с воздухом и имела поверхностное натяжение В том случае, когда Мерой смачивания является краевой угол Краевой угол () - это угол, который образует капля с поверхностью твердого тела со стороны жидкости. Это угол между твердой поверхностью и касательной в точке соприкосновения фаз (угол всегда измеряют со стороны жидкости). На рис. 5.1 показаны капли, образующие с поверхностью краевые углы Если вода на твердой поверхности образует Приводим значения краевого угла, образуемого водой на поверхности различных твердых тел в атмосфере воздуха: кварц - 0; малахит - 17; графит - 55-60; тальк - 69; сера - 78; парафин - 106; фторопласт - 108. Очевидно, что чем больше краевой угол, тем в меньшей степени жидкость смачивает поверхность твердого тела. Как было указано выше, степень смачивания, а значит, и краевой угол зависят от соотношения величия поверхностного натяжения на границах: воздух - твердое тело , жидкость - твердое тело В условиях равновесия эта зависимость выражается уравнением Юнга:
Из уравнения (5.7) следует, что если 2.5.10. АДГЕЗИЯ К явлениям адсорбции и смачивания близки также явления адгезии. Адгезия (прилипание) - это взаимодействие между приведенными в контакт поверхностями конденсированных фаз разной природы. Если две взаимно нерастворимые жидкости либо жидкость и твердое тело, либо, наконец, два твердых тела приведены в тесный контакт, то под действием межмолекулярных сил они прочно прилипают друг к другу, так что для их разделения нужно произвести определенную работу. Как правило, адгезия и смачивание сопутствуют друг другу и соответствующим образом характеризуют межфазное взаимодействие. Адгезия обусловлена стремлением системы к уменьшению поверхностной энергии, следовательно, является самопроизвольным процессом. Работа адгезии Полная работа адгезии, приходящаяся на всю площадь S контакта тел, равна:
Возможны три случая адгезии. 1. Адгезия между двумя жидкостями. Предположим, что две жидкости 1 и 3 соприкасаются ДРУГ с другом и находятся в среде 2. Мысленно отделим их Друг от друга (рис. 5.2 ). Тогда образуются две поверхности: жидкости 1 с поверхностным натяжением Работа адгезии будет равна:
Это уравнение впервые вывел Дюпре. Из уравнения Дюпре следует, что работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение. 2. Адгезия между жидкостью и твердым телом. Предположим, что на поверхности твердого тела 3 находится капля жидкости 1 в среде 2. Работу адгезии по уравнению (5.9) вычислить нельзя, так как поверхностные натяжения и обычно неизвестны. Однако эти величины можно исключить из уравнения Дюпре, воспользовавшись уравнением (5.7). Тогда
3. Адгезия между твердыми телами. Работу адгезии в этом случае невозможно вычислить с помощью уравнений (5.9) и (5.10), так как поверхностное натяжение на границе "твердое тело - воздух" обычно неизвестно. Для объяснения адгезии твердого тела к твердому телу был предложен ряд теорий, применимых к различным частным случаям, однако универсальной теории до сих пор не существует. Работу адгезии определяют экспериментально при непосредственном разрушении соединения или косвенными методами. 2.5.11. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ РАССМОТРЕННЫХ ЯВЛЕНИЙ Адсорбция на границе "твердое тело - жидкость" имеет огромное практическое значение. Она лежит в основе: • гетерогенного катализа; • хроматографии; • крашения; • стирки; • процессов извлечения примесей и очистки жидкостей; • разрушения дисперсных систем с жидкой дисперсионной средой; • промышленного производства пищевых продуктов (очистки этанола, осветления пива и вина и т.д., а также домашнего производства пищи). Для осветления бульонов и отваров используется сырой яичный белок. В горячем бульоне он "свертывается", образуя твердую пористую массу, на которой адсорбируются вещества, придающие бульону мутность. Следует отметить, что наши вкусовые ощущения связаны с адсорбцией веществ на определенных участках языка. Большое практическое значение имеет смачивание: • в текстильной технологии хорошее смачивание волокна и тканей является условием качественного крашения, отбеливания, стирки и т.д.; • хорошее смачивание важно для успешного применения инсектофунгицидов, так как листья растений и шерстяной покров животных всегда гидрофобны; • смачивание соответствующими жидкостями металлов облегчает их механическую обработку (резание, сверление, шлифовку, полировку); • бурение нефтяных скважин в горных породах облегчается, если применять специальные бурильные растворы, содержащие смачиватели; • при лужении, спайке и сварке металлов, а также склеивании твердых тел необходимо хорошее смачивание поверхности; • на явлениях избирательного смачивания основана флотация - важнейший метод обогащения руд и т.д. Наряду со смачиванием для многих процессов играет большую роль адгезия. К таким процессам относятся: • склеивание материалов; • нанесение лакокрасочных и гальванических покрытий; • получение материалов на основе связующих и наполнителей (бетон, резина, стеклопластики и т.д.); • сварка и пайка металлов; • печатание; • крашение. Адгезия в значительной степени определяет качество и изделий. ЗАКЛЮЧЕНИЕ Молекулярная адсорбция из растворов - процесс более сложный по сравнению с адсорбцией на границе "жидкость - газ". Наряду с силовым полем твердой фазы необходимо принимать во внимание межмолекулярные взаимодействия в жидкости, которые часто играют решающую роль. При рассмотрении адсорбции газов и паров на твердом адсорбенте исходят из того, что в начальный момент поверхность адсорбента свободна, а затем по мере увеличения давления газа постепенно заполняется адсорбтивом. При адсорбции из раствора поверхность адсорбента всегда полностью занята молекулами растворителя и растворенного вещества. Растворенное вещество может адсорбироваться, только вытесняя с поверхности молекулы растворителя, т.е. происходит обменная молекулярная адсорбция. Таким образом, в молекулярной адсорбции из растворов участвуют как минимум два компонента и между ними имеет место конкуренция за места в поверхностном слое. Адсорбция ПАВ на границе "твердое тело - жидкость" имеет много общего с адсорбцией на границе жидкость - газ. Так, к обоим видам адсорбции применимы уравнения Генри, Фрейндлиха, Ленгмюра и правило Дюкло-Траубе. Вместе с тем, имеются существенные различия. На границе жидкость-газ молекулы ПАВ ориентированы всегда одинаково: гидрофильные полярные части молекул направлены к воде, а гидрофобные неполярные радикалы - к воздуху. Ориентация молекул ПАВ на границе "твердое тело - жидкость" происходит в соответствии с правилом уравнивания полярностей Ребиндера. Молекулярная адсорбция из растворов существенно зависит от свойств растворенного вещества, растворителя и адсорбента. Так, а) вещество адсорбируется тем лучше, чем оно менее растворимо в данном растворителе; б) на твердых поверхностях адсорбируются только вещества, обладающие полярностью, промежуточной между полярностями фаз; в) неполярные твердые тела лучше адсорбируют неполярные адсорбтивы и наоборот. Существует также ряд других частных закономерностей. Из растворов сильных электролитов на поверхности твердых веществ адсорбируются ионы. Адсорбция увеличивается с увеличением кристаллического радиуса и заряда иона, противоположного заряду поверхности. На поверхности кристаллов избирательно сорбируются ионы, способные достраивать кристаллическую решетку (правило Панета - Фаянса). Некоторые твердые вещества - иониты способны обменивать свои ионы на ионы того же знака в растворе. Между ионами в растворе и в ионите устанавливается ионообменное, равновесие, константа которого отражает свойства обменивающихся ионов и селективность ионита. К явлению адсорбции близки явления смачивания и адгезии, определяющиеся интенсивностью взаимодействия между молекулами разных веществ. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Что является причиной адсорбции растворенных веществ на поверхности твердых тел? 2. Какая адсорбция называется молекулярной, от каких факторов она зависит? 3. Какими математическими уравнениями описываются изотермы молекулярной адсорбции? 4. Как зависит молекулярная адсорбция от природы растворенного вещества, растворителя и адсорбента? 5. Сформулируйте правило уравнивания полярностей Ребиндера. 6. Перечислите особенности ионной адсорбции. Как она зависит от размеров и зарядов ионов? 7. Сформулируйте правило Панета - Фаянса. 8. В чем состоит сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует? 9. Какое явление называется смачиванием? Чем оно обусловлено? 10. Что называется углом смачивания? 11. Какие поверхности называются гидрофильными, гидрофобными? 12. Что называется адгезией? От чего зависит работа адгезии? Закончив изучение главы 5, вы должны 1) знать: факторы, от которых зависит молекулярная адсорбция; уравнения Фрейндлиха, Ленгмюра, Гиббса; от чего зависит ионная адсорбция; сущность явлений смачивания и адгезии, чем они обусловлены; 2) уметь: предсказывать величину молекулярной адсорбции в зависимости от природы адсорбента, состава и строения адсорбтива, природы растворителя; сопоставлять величины ионной адсорбции различных ионов на поверхности кристаллов; рассчитывать угол смачивания и работу адгезии. 3. ЧАСТЬ ВТОРАЯ. ЛИОФОБНЫЕ ЗОЛИ (КОЛЛОИДНЫЕ РАСТВОРЫ 3.1. ГЛАВА 6. ПОЛУЧЕНИЕ И ОЧИСТКА КОЛЛОИДНЫХ РАСТВОРОВ Коллоидными растворами называются высокодисперсные гетерогенные системы, в которых хотя бы одно вещество находится в коллоидном состоянии. Коллоидное состояние - это высокодисперсное состояние, когда вещество раздроблено до частиц размерами Среда, в которой распределены частицы дисперсной фазы, называется дисперсионной средой. 3.1.1. МЕТОДЫ ПОЛУЧЕНИЯ ЛИОФОБНЫХ ЗОЛЕЙ Общие условия получения лиофобных золей - нерастворимость или очень малая растворимость вещества дисперсной фазы в дисперсионной среде и наличие в среде веществ, которые способны стабилизировать частицы дисперсной фазы - стабилизаторов. Если вспомнить график зависимости удельной поверхности частиц дисперсной фазы от их размеров d (см. рис. 1.2), станет ясно, что лиофобные золи занимают промежуточное положение между истинными растворами и грубодисперсными системами. Следовательно, получить коллоидные растворы можно измельчением крупных частиц до коллоидных размеров (диспергационные методы) я укрупнением молекул и ионов (конденсационные методы). ДИСПЕРГАЦИОННЫЕ МЕТОДЫ Диспергационные методы - это способы получения лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров. Существенные черты диспергационных методов: 1. Измельчение производится в инертной среде. 2. Диспергирование является несамопроизвольным процессом. Образование дополнительной межфазной поверхности связано с накоплением дополнительной свободной поверхностной энергии и происходит за счет совершения внешней работы. В зависимости от вида внешней работы, которая совершается над грубодисперсной системой, диспергационные методы можно подразделить на механическое, ультразвуковое и электрическое диспергирование. Механическое дробление грубодисперсных систем осуществляется путем: раздробления, удара, истирания, расщепления. Измельчение частиц до размеров в несколько десятков микрон осуществляется с помощью шаровых мельниц. Шаровая мельница - это полый цилиндрический сосуд, частично заполненный шарами из того же материала, что и сам цилиндр (сталь, агат, фарфор и др.), занимающими 30-40% от общего объема сосуда. При медленном вращении цилиндра шары перекатываются, истирая и дробя материал. Очень тонкое раздробление (до 0,1-1 микрона) достигается на специальных коллоидных мельницах с узким зазором между быстро вращающимся ротором (10-20 тыс. об/мин) и неподвижным корпусом, причем частицы разрываются или истираются в зазоре. Работами П.А. Ребиндера установлено явление понижения сопротивления твердых тел упругим и пластическим деформациям, а также механическому разрушению од влиянием адсорбции поверхностно-активных веществ. Эти явления обусловлены облегчением развития микрощелей в поверхностных слоях деформируемого и разрушаемого тела. Поверхностно-активные вещества облегчают диспергирование и способствуют значительному повышению степени дисперсности. Следует иметь в виду, что механическое диспергирование является очень энергоемким процессом. Достаточно отметить, что энергия, расходуемая в стране на размол цемента, превышает энергию, вырабатываемую Волжской ГЭС. Диспергирование ультразвуком происходит за счет разрывающих усилий. Они возникают в жидкости или твердом теле при прохождении через них ультразвуковых колебаний с частотой более 20000 Гц в секунду (эти колебания не улавливаются человеческим ухом). При прохождении звуковой волны в системе возникают местные, быстро чередующиеся сжатия и расширения вещества, которые приводят к его разрушению. Этот метод применим и является эффективным только при диспергировании малопрочных веществ (сера, графит, крахмал, краски и т.д.). Электрическое диспергирование. Этим методом получают коллоидные растворы металлов путем распыления в вольтовой дуге электродов из металла, погруженных в воду. Метод был изобретен Г. Бредигом в 1898 г. Для получения более стойких гидрофобных золей в воду вводят следы стабилизирующих электролитов. Таким образом получают гидрозоли щелочных металлов. Сведберг усовершенствовал этот метод, сделав его пригодным для получения органозолей. Для этого он применил переменный ток высокой частоты, а сами электроды помещал в металлический порошок, лежащий на дне сосуда в дисперсионной среде. Таким образом получены органозоли железа, никеля, алюминия, хрома и других металлов. Таким образом, сущность метода заключается в распылении металла электрода в вольтовой дуге, а также в конденсации паров металла, образующихся при высокой температуре. Поэтому электрический способ соединяет в себе черты диспергационных и конденсационных методов. КОНДЕНСАЦИОННЫЕ МЕТОДЫ Конденсационные методы - это способы получения коллоидных растворов путем объединения (конденсации) молекул и ионов в агрегаты коллоидных размеров. Система из гомогенной превращается в гетерогенную, т.е. возникает новая фаза (дисперсная фаза). Обязательным условием является пересыщенностъ исходной системы. Конденсационные методы классифицируют по природе явлений, вызывающих конденсацию, на физическую конденсацию и химическую конденсацию. Физическая конденсация. Первоначально вещество находится в виде молекул или ионов. Необходимо создать условия, при которых оно будет конденсироваться, образуя дисперсную фазу, причем конденсация должна прекратиться, когда частицы достигнут коллоидных размеров. Физическая конденсация может осуществляться из паров или путем замены растворителя. Конденсация из паров. Исходное вещество находится в паре. При понижении температуры пар становится пересыщенным и частично конденсируется, образуя дисперсную фазу. Таким путем получают гидрозоли ртути и некоторых других металлов. Метод замены растворителя. Метод основан на изменении состава и свойств дисперсионной среды. Если, например, спиртовой раствор серы, фосфора или канифоли влить в воду, вследствие понижения растворимости вещества в новом растворителе раствор становится пересыщенным и часть вещества конденсируется, образуя частицы дисперсной фазы. Химическая конденсация. В этих случаях вещество, образующее дисперсную фазу, получается в результате химической реакции. Чтобы в ходе реакции образовался коллоидный раствор, а не истинный раствор или осадок, необходимо соблюдение, по крайней мере, трех условий: 1) чтобы вещество дисперсной фазы было нерастворимо в дисперсионной среде; 2) чтобы скорость образования зародышей кристаллов дисперсной фазы была гораздо больше, чем скорость роста кристаллов; это условие выполняется обычно тогда, когда концентрированный раствор одного компонента вливается в сильно разбавленный раствор другого компонента при интенсивном перемешивании; 3) чтобы одно из исходных веществ было взято в избытке, именно оно является стабилизатором. Методы химической конденсации разнообразны - практически любая химическая реакция, приводящая к образованию новой фазы, может служить способом получения коллоидного раствора. Приведем несколько примеров: 1. Реакция восстановления:
Эту реакцию проводят в присутствии стабилизатора (танин, крахмал, желатин). 2. Реакция окисления:
3. Реакция гидролиза:
4. Реакция обмена:
ПЕПТИЗАЦИЯ Особняком стоит метод пептизации, который состоит в следующем. Измельченный материал (сажа, графит, глина) или промытый осадок вещества, полученный в результате химической реакции осаждения, промывают небольшим количеством раствора пептизатора, в результате образуется высокодисперсная система. Пептизировать можно далеко не все осадки; плотные, тяжелые осадки не поддаются пептизации, наоборот, рыхлые, студенистые осадки, особенно свежеприготовленные, легко пептизируются. Формально пептизацию можно отнести к методам диспергирования, но это неправильно. Пептизируемый осадок - это уже диспергированный материал, доведенный до коллоидной степени измельчения, в котором частицы в результате слипания образовали крупные агрегаты. Пептизация - это нарушение связей между слипшимися частицами. Чем слабее эти связи, тем легче происходят пептизация. 3.1.2. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ Полученные тем или иным способом коллоидные растворы обычно очищают от низкомолекулярных примесей (молекул и ионов). Удаление этих примесей осуществляется методами диализа, электродиализа, ультрафильтрации. ДИАЛИЗ Диализ был разработан еще Грэмом в 1861 г. Коллоидный раствор, подлежащий очистке, наливают в сосуд, который отделен полупроницаемой мембраной от другого сосуда с чистой дисперсионной средой. В качестве полупроницаемой (т.е. проницаемой для молекул и ионов, но непроницаемой для частиц дисперсной фазы) мембраны применяют пергамент, целлофан, коллодий, керамические фильтры и другие тонкопористые материалы. В результате диффузии низкомолекулярные примеси переходят во внешний раствор. В настоящее время существует много усовершенствованных конструкций диализаторов, обеспечивающих более быстрый процесс очистки. Интенсификация диализа достигается: • увеличением поверхности мембран; • уменьшением слоя очищаемой жидкости; • частотой или непрерывной сменой внешней жидкости; • повышением температуры (ускорение диффузии). ЭЛЕКТРОДИАЛИЗ Электродиализ обусловлен миграцией ионов через мембрану под действием приложенной разности потенциалов порядка 40 В/см. Предложено много конструкций электродиализаторов. Схема относительно простого электродиализатора, применявшегося Паули, приведена на рис. 6.1 . Диализатор состоит из трех стеклянных камер, разделенных полупроницаемыми перегородками. В боковых камерах установлены электроды, на которые от внешнего источника постоянного тока подается разность потенциалов. В боковых камерах находится дистиллированная вода, которая непрерывно сменяется. Очищаемый золь, находящийся в средней камере, перемешивается мешалкой. УЛЬТРАФИЛЬТРАЦИЯ Ультрафильтрацией называется диализ, проводимый под давлением во внутренней камере. По существу, ультрафильтрация является не методом очистки золей, а лишь методом их концентрирования. Интересным примером сочетания диализатора и ультрафильтрации является аппарат "искусственная почка", предназначенный для временной замены функции почек при острой почечной недостаточности. Аппарат оперативным путем подключается к системе кровообращения больного. Кровь под давлением, создаваемым пульсирующим насосом ("искусственное сердце") протекает в узком зазоре между двумя мембранами, омываемыми снаружи физиологическим раствором. Благодаря большой рабочей площади мембран (~15 000 ) из крови сравнительно быстро (3-4 часа) удаляются "шлаки" - продукты обмена и распада тканей (мочевина, креатин, новы калия и т.д.). Применяя для ультрафильтров мембраны с определенной пористостью, можно в известной мере разделить по размерам коллоидные частицы и одновременно приближенно определить их размеры. Этим способом были определены размеры частиц ряда вирусов и бактериофагов. ОБРАТНЫЙ ОСМОС При фильтрации растворов под давлением через мембраны с еще более тонкими порами, например, ацетатцеллюлозные ( В цилиндре 1 под поршнем 2 находится очищаемый раствор, который с помощью полупроницаемой мембраны 3 отделен от чистой воды 4. При отсутствии внешнего давления происходил бы обычный осмос - чистая вода проникала бы через мембрану в неочищенный раствор. Если внешнее давление на поршень больше осмотического, происходит обратный осмос - переход воды из очищаемого раствора в чистую воду. Растворенные примеси концентрируются в пространстве S. ЗАКЛЮЧЕНИЕ Коллоидные системы по размерам частиц дисперсной фазы занимают промежуточное положение между истинными растворами и грубодисперсными системами, поэтому их можно получать двумя прямо противоположными путями: • дроблением крупных частиц до желаемой дисперсности; • соединением молекул, атомов, ионов в агрегаты коллоидных размеров. Диспергирование широко применяется в различных технологических процессах и постоянно происходит в природе; оно производится с применением специального оборудования и требует больших затрат энергии. Методы конденсации не требуют специальных машин и дают возможность получать дисперсные системы более высокой дисперсности. При любом способе получения коллоидные растворы оказываются загрязненными примесями истинно растворенных веществ (примеси в исходных материалах, избыток стабилизаторов, продукты химической конденсации). Примеси электролитов сильно понижают устойчивость золей. Поэтому после получения их очищают. Очистка производится методами диализа, электродиализа, ультрафильтрации. Указанные методы основаны на применении полупроницаемых мембран, легко пропускающих молекулы и ионы и задерживающих коллоидные частицы. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие дисперсные системы называются коллоидными растворами? 2. Как можно классифицировать методы получения коллоидных растворов? 3. В чем состоит сущность методов диспергирования? Какое оборудование используют для этого? В чем заключаются недостатки диспергационных методов? 4. Охарактеризовать способы получения коллоидных растворов путем конденсации. 5. Какие условия должны соблюдаться для осуществления химической конденсации? 6. Какие методы очистки дисперсных систем вы знаете? 7. В чем состоят особенности процессов диализа, электродиализа, ультрафильтрации? Закончив изучение главы 6, вы должны знать: сущность методов получения коллоидных растворов; основные методы очистки золей. Ознакомившись с методами получения и очистки лиофобных золей, переходим к рассмотрению их свойств. 3.2. ГЛАВА 7. ОПТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ При падении света на дисперсную систему могут наблюдаться следующие явления: • прохождение света через систему; • преломление света частицами дисперсной фазы (если эти частицы прозрачны); • отражение света частицами дисперсной фазы (если частицы непрозрачны); • рассеяние света; • абсорбция (поглощение) света дисперсной фазой с превращением световой энергии в тепловую. Преобладающий характер наблюдаемых явлений зависит от размеров частиц дисперсной фазы, от их соотношения с длиной волны падающего света. Белый свет (дневной, солнечный свет) полихроматичен, длина волны меняется от Прохождение света наблюдается для прозрачных систем, в которых частицы гораздо меньше длины волны падающего света. Это имеет место в случае истинных растворов (молекулярно-ионная дисперсия) и большинства индивидуальных жидких веществ. Преломление и отражение света наблюдаются для систем, в которых частицы дисперсной фазы значительно больше длины волны падающего света. Это неравенство выполняется для микрогетерогенных и грубодисперсных систем. Визуально это явление выражается в мутности этих систем. Рассеяние света наблюдается для систем, в которых частицы дисперсной фазы меньше, но соизмеримы с длиной волны падающего света. Именно такое соотношение выполняется для коллоидных растворов, оптические свойства которых рассматриваются в этой главе (напомним что размеры частиц дисперсной фазы в коллоидных растворах - Итак, наиболее типичное оптическое явление в коллоидных растворах - это светорассеяние (опалесценция). 3.2.1. РАССЕЯНИЕ СВЕТА Опалесценцию, обусловленную светорассеянием, наблюдал Фарадей (1857), а затем Тиндаль (1869), обнаруживший образование светящегося конуса при пропускании пучка света через коллоидный раствор ("конус Тиндаля"). Если таким же образом освещать истинный раствор или индивидуальную жидкость, то никакого свечения не наблюдается, так как эти системы являются оптически пустыми. В случае микрогетерогенных и грубодисперсных систем вместо равномерного свечения наблюдаются отдельные блестки, обусловленные отражением света от крупных частиц. Теорию светорассеяния создал Рэлей. При прохождении световой волны переменное во времени электромагнитное поле вызывает поляризацию частиц. Возникающие диполи с переменными электромагнитными моментами являются источниками излучения света. В однородной среде свет, излучаемый всеми диполями, вследствие интерференции распространяется только в первоначальном направлении. Если же в среде имеются неоднородности с другими показателями преломления, например, коллоидные частицы, то диполи излучают нескомпенсированное излучение во всех направлениях - рассеянный свет. Интенсивность рассеянного света в различных направлениях различна. Однако длина волны рассеянного света такая же, как и падающего. Рэлей вывел уравнение, связывающее интенсивность рассеянного света I с интенсивностью падающего света • частицы имеют сферическую форму; • частицы не проводят электрический ток (т.е. являются неметаллическими); • частицы не поглощают свет, т.е. являются бесцветными; • коллоидный раствор является разбавленным в такой степени, что расстояние между частицами больше длины волны падающего света. Уравнение Рэлея:
где V - объем одной частицы, Рассмотрим зависимость I от различных параметров системы. 1. Интенсивность рассеянного света тем больше, чем больше различаются показатели преломления частицы и среды ( 2. Интенсивность рассеянного света тем больше, чем больше частичная концентрация . Массовая концентрация с,
где Если подставить в уравнение Рэлея взамен частичной концентрации массовую с, получим:
Таким образом, интенсивность рассеянного света пропорциональна объему частицы и, следовательно кубу ее линейного размера. 3.2.2. ПОГЛОЩЕНИЕ СВЕТА И ОКРАСКА ЗОЛЕЙ Следует отметить, что эта зависимость сохраняется только в области малых размеров частиц, когда
где r - радиус частиц. Для видимой части спектра это условие соответствует значениям Итак, интенсивность рассеянного света прямо пропорциональна с. На этом основано применение измерений светорассеяния для определения концентрации золя с частицами постоянного размера. 3. Интенсивность рассеянного света обратно пропорциональна длине волны в четвертой степени. Это означает, что при прохождении через коллоидный раствор пучка белого света преимущественно рассеиваются короткие волны - синей и фиолетовой частей спектра. Поэтому бесцветный золь в рассеянном свете имеет голубоватую окраску, а в проходящем свете - красноватую. Голубой цвет неба также обусловлен рассеянием света мельчайшими капельками воды в атмосфере. Оранжевый или красный цвет неба при восходе или заходе Солнца объясняется тем, что утром или вечером наблюдается, главным образом, свет, прошедший через атмосферу. Зависимость I от Малое рассеяние инфракрасных и коротких радиоволн используется для локации, так как эти волны обладают большой проницаемостью и в то же время незначительным рассеянием. Зеленые растения поглощают именно красные лучи солнечного света, потому что они менее всего рассеиваются атмосферой Земли. 3.2.3. ПОГЛОЩЕНИЕ СВЕТА И ОКРАСКА ЗОЛЕЙ Уравнение Рэлея выведено для неокрашенных золей, т.е. не поглощающих свет. Однако многие коллоидные растворы имеют определенную окраску, т.е. поглощают свет в соответствующей области спектра - золь всегда окрашен в цвет, дополнительный к поглощенному. Так, поглощая синюю часть спектра (435-480 нм), золь оказывается желтым; при поглощении синевато-зеленой части (490-500 нм) он принимает красную окраску. Если лучи всего видимого спектра проходят через прозрачное тело или отражаются от непрозрачного, то прозрачное тело кажется бесцветным, а непрозрачное - белым. Если тело поглощает излучение всего видимого спектра, оно кажется черным. Оптические свойства коллоидных растворов, способных к поглощению света, можно характеризовать по изменению интенсивности света при прохождении через систему. Для этого используют закон Бугера-Ламберта-Бера:
где - интенсивность падающего света; Если прологарифмировать выражение (7.4), получим:
Величину Золи металлов очень сильно поглощают свет, что обусловлено генерацией в частицах дисперсной фазы электрического тока, большая часть энергии которого превращается в теплоту. При изменении размеров частиц изменяется длина волны поглощаемого света. Так, высокодисперсные золи золота (r = 20 нм), поглощающие преимущественно зеленую часть спектра, имеют интенсивно красную окраску при увеличении размеров частиц до 50 нм окраска золей становится синей. С увеличением дисперсности золей металлов изменяется также интенсивность их окраски, она максимальна при средних размерах частиц и ослабевает как при увеличении, так и при уменьшении дисперсности. Так, наибольшая интенсивность окраски гидрозоля золота имеет место при размерах частиц от 20 до 37 нм. Золи металлов обладают исключительно высокой интенсивностью окраски, например, интенсивность окраски красного золя золота во много раз больше, чем у красителя фуксина (при одинаковых концентрациях). 3.2.4. ОПТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ КОЛЛОИДНЫХ РАСТВОРОВ В настоящее время оптические методы являются наиболее распространенными методами определения размера, формы и структуры коллоидных частиц. Это объясняется не только быстротой и удобством этих методов, но и точностью получаемых результатов. Наиболее часто для исследования коллоидных растворов применяются: • ультрамикроскопия; • электронная микроскопия; • нефелометрия; • турбидиметрия. Остановимся на принципах, которые лежат в основе этих методов. УЛЬТРАМИКРОСКОПИЯ Разрешающая способность микроскопа, т.е. наименьшее расстояние, при котором две точки еще можно видеть раздельно, составляет около половины длины световой волны. Таким образом, при использовании обычного света (длина волны 400-700 нм ) даже в наилучший микроскоп видимы частицы, размеры которых не менее В 1903 г. Зидентопф и Зигмонди сконструировали прибор иного типа - ультрамикроскоп, основанный на наблюдении светорассеяния в обычном оптическом микроскопе. При этом сплошная опалесценция, видимая невооруженным глазом, разрешается в отблески отдельных частиц. Каждый отблеск - это свечение светового пучка волн, рассеянных одной частицей под разными углами, оно значительно больше, чем проекция самой частицы и доступно для микроскопической регистрации. Прямая регистрация не позволяет судить о размерах и форме частицы, так как мы наблюдаем не сами частицы, а их отблески, но эти параметры могут быть определены косвенно. Для этого выделяют определенный объем
Если частицы имеют сферическую форму, можно рассчитать средний радиус частицы:
Если предположить, что частица имеет форму куба с размером ребра l, тогда
С помощью ультрамикроскопа Зигмонди могут быть обнаружены частицы размером до Наблюдая коллоидную систему в ультрамикроскоп, можно не только определить средний размер частиц, но и получить некоторое представление об их форме. Чтобы получить удовлетворительные результаты методом ультрамикроскопии, исследователям приходилось выполнять сотни и тысячи определений. В настоящее время созданы приборы, довольно сложные по конструкции, автоматически выполняющие практически все операции. Б.В. Дерягин и Г.Я. Власенко сконструировали поточный ультрамикроскоп. Золь протекает через специальную кювету, проходя определенную зону, каждая частица золя дает вспышку, которая регистрируется счетчиком. По различной яркости вспышек частицы можно разделить на фракции и построить кривые распределения. ЭЛЕКТРОННАЯ МИКРОСКОПИЯ В последние годы для наблюдения размеров и формы коллоидных частиц чаще всего пользуются электронным микроскопом, в котором вместо световых лучей применяются пучки электронов с длиной волны всего 0,02-0,05 А. Это резко увеличивает разрешающую способность микроскопа и дает возможность непосредственно видеть или фотографировать коллоидные частицы. Разрешающее расстояние с помощью электронного микроскопа может быть доведено до 5-10 А. Применение электронного микроскопа затруднено необходимостью тщательного высушивания образцов, так как внутри электронного микроскопа поддерживается высокий вакуум, необходимый для прохождения электронного пучка; кроме того, вследствие сильного поглощения электронов изучаемые образцы должны быть весьма тонкими (1-10 мк). При выпаривании капли раствора свойства системы могут существенно измениться, в результате чего наблюдаемые параметры могут сильно отличаться от параметров частиц в коллоидном растворе. НЕФЕЛОМЕТРИЯ Нефелометрия основана на способности коллоидных систем рассеивать свет. Определяя светорассеяние данной системы, можно определять размер частиц или концентрацию дисперсной фазы, изучать различные процессы, исходящие в растворе. В основе нефелометрии лежит уравнение Рэлея (7.3), которое можно представить в виде:
Зная концентрацию золя и измерив абсолютные значения интенсивностей падающего и рассеянного света, можно вычислить средний, объем частицы. Но абсолютные значения I и определить сложно. Поэтому большое распространение получили относительные методы нефелометрии. Опалесценцию исследуемого раствора I с помощью нефелометра сравнивают с опалесценцией стандартного раствора
где Нетрудно видеть, что нефелометр можно использовать для определения концентрации дисперсной фазы в системе. Если стандартный и исследуемый растворы содержат частицы одной и той же природы и одного и того же размера, то:
где - концентрация исследуемого золя, Разумеется, определение объема частиц или концентрации коллоидного раствора должно производиться при определенной длине волны. ТУРБИДИМЕТРИЯ Турбидиметрия - метод исследования, основанный на измерении ослабления проходящего через коллоидную систему света в результате светорассеяния. Измерение производят с помощью обычных колориметров или спектрофотометров, позволяющих определить мутность. Если интенсивность пучка света уменьшается от для падающего света до I прошедшего света, то мутность определяется уравнением:
где l - расстояние, пройденное светом в оптически неоднородной среде. Между мутностью т коллоидного раствора и интенсивностью рэлеевского рассеяния света под углом
Из уравнений (7.11) и (7.12) следует, что чем больше рассеяние, тем выше мутность и тем меньше интенсивность прошедшего через раствор света. Метод турбидиметрии подробно изучается в курсе аналитической химии. ЗАКЛЮЧЕНИЕ Оптические свойства коллоидов тесно связаны с размерами, формой и структурой частиц дисперсной фазы и поэтому имеют большое значение при изучении коллоидных систем. При падении света на дисперсную систему могут наблюдаться: • прохождение света через систему; • преломление или отражение частицами дисперсной фазы; • рассеяние света; • поглощение света. Характер оптических явлений зависит от соотношения размеров частиц дисперсной фазы и длины волны падающего света. Размеры коллоидных частиц соизмеримы с длиной волны света. Поэтому одним из наиболее характерных оптических свойств золей является рассеяние света (опалесценция). Согласно уравнению Рэлея, светорассеяние пропорционально концентрации частиц, квадрату объема частицы и обратно пропорционально четвертой степени длины волны падающего света. Таким образом, рассеяние коротких волн происходит более интенсивно. Этот эффект находит широкое практическое применение и объясняет некоторые природные явления. Наряду со светорассеянием для многих коллоидных растворов характерно поглощение света определенной длины волны, чем объясняется окраска золей. Поглощение света происходит в соответствии с законом Бугера-Ламберта-Бера. Оптические методы исследования широко применятся для определения размеров, формы и структуры коллоидных частиц. К ним относятся: • ультрамикроскопия, основанная на наблюдении рассеяния света в обычном оптическом микроскопе; • электронная микроскопия, связанная с использованием вместо световых лучей пучка быстрых электронов; • нефелометрия - метод определения размеров коллоидных частиц или концентрации золя, основанный на измерении светорассеяния коллоидным раствором; • турбидиметрия, измерение светорассеяния коллоидного раствора по ослаблению интенсивности света, прошедшего через раствор. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие оптические явления наблюдаются при падении света на: а) водный раствор хлорида натрия; б) водный раствор сульфата меди (II); в) коллоидный раствор хлорида серебра; г) коллоидный раствор металлического золота (красного цвета); д) взвесь глины в воде с размерами частиц 2. В чем проявляется рэлеевское рассеяние света? 3. Перечислите факторы, от которых зависит интенсивность рассеянного света. 4. При каких условиях справедливо уравнение Рэлея? 5. Почему при проявлении фотоснимков пользуются красным светом? 6. Какие оптические методы используются для определения размеров частиц дисперсной фазы? 7. От каких факторов зависит поглощение света окрашенными растворами? Что называется оптической плотностью? 8. Сравните колориметрический и нефелометрический методы определения концентрации растворов. 9. В чем состоит отличие метода ультрамикроскопии от электронной микроскопии? Какой из методов является более чувствительным? Почему? 10. Чем объясняется мутность дисперсных систем? Какой оптический метод основан на измерении мутности коллоидных растворов? Закончив изучение главы 7, вы должны знать: • оптические явления, наблюдаемые при падении света на дисперсные системы, чем они обусловлены; • сущность рассеяния света, его закономерности, уравнение Рэлея; • закон Бугера-Ламберта-Бера, причины окраски золей; • оптические методы исследования золей, на чем каждый из них основан. 3.3. ГЛАВА 8. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ 3.3.1. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ В ГИДРОФОБНЫХ ЗОЛЯХ В 1808 году профессор Московского университета Ф.Ф. Рейсе, изучая процесс электролиза воды, попытался разделить продукты электролиза. С этой целью он заполнил среднюю часть (U-образной трубки электролизера толченым кварцем (т.е. создал капиллярно-пористую перегородку) и подал на электроды постоянное внешнее напряжение (рис. 8.1 ). Он обнаружил, что вода перемещается в сторону отрицательного электрода. При разности потенциалов на электродах, равной 100 В, разность уровней воды в коленах трубки составляла примерно 20 см. Это явление получило название электроосмоса. Поскольку в отсутствие капиллярно-пористой перегородки движения воды не наблюдалось, последовал вывод, что вода при контакте с кварцем приобретает положительный заряд. Электроосмос - это явление переноса дисперсионной среды через неподвижную капиллярно-пористую перегородку под действием внешнего электрического поля. Следовательно, электроосмос является процессом не самопроизвольным, на его осуществление затрачивается электрическая работа. Далее Рейсе поставил следующий опыт. Он погрузил во влажную глину две стеклянные трубки, заполнил их водой, в трубки ввел электроды и подал на них постоянное напряжение. Он обнаружил, что вода перемещается к отрицательному электроду (как в предыдущем опыте), и одновременно частицы глины перемещаются к положительному электроду (вода в трубке с положительным электродом мутнела, в то время как в другой трубке оставалась прозрачной). Это явление получило название электрофореза. Электрофорез - это явление переноса частиц дисперсной фазы под действием внешнего электрического поля. Роль капиллярно-пористой перегородки играла влажная глина. Схема электрофореза представлена на рис. 8.2 . Таким образом, при наличии неподвижной капиллярнопористой перегородки под действием постоянного электрического поля передвигается дисперсионная среда (электроосмос) и дисперсная фаза (электрофорез). Было естественным предположить возможность осуществления противоположных процессов, т.е. получить разность потенциалов на капиллярно-пористой перегородке при движении через нее дисперсионной среды или частиц дисперсной фазы. В 1859 году Квинке обнаружил явление, противоположное электроосмосу, названное потенциалом течения. Потенциал течения - это явление возникновения разности потенциалов на электродах, расположенных по обеим сторонам неподвижной капиллярно-пористой перегородки при продавливании через нее жидкости. Квинке наблюдал возникновение разности потенциалов при течении воды и водных растворов через разнообразные пористые материалы (глина, дерево, песок, графит и др.). Это явление характерно и для живых организмов. Например, при движении крови в артериях возникает небольшой потенциал течений (~0,001-~0,002 В), имеющий, однако, важное биологическое значение. Одна из волн, наблюдаемых на электрокардиограммах, обусловлена этим потенциалом. В 1878 г. Дорн открыл явление, обратное электрофорезу, названное потенциалом седиментации (осаждения). Потенциал седиментации - это явление возникновения потенциалов на электродах, расположенных на разной высоте в сосуде, в котором происходит оседание частиц дисперсной фазы. Таким образом, разность потенциалов возникает в результате движения частиц. Схематически возникновение потенциала течения и потенциала седиментации показано на рис. 8.3 и рис. 8.4 . Рассмотренные явления - электроосмос, электрофорез, потенциал течения и потенциал седиментации - объединяют под общим названием электрокинетические явления, поскольку они связаны с электрическим полем и полем скоростей (кинетическим полем). Эти явления находят широкое применение: электроосмос - для ускорения сушки торфа, древесины и пр., дубления кожи, очистки дисперсионной среды золей, а также воды, пропитки материалов различными композициями, в электрохимических приборах и т.д.; электрофорез - для получения чистого каолина из глинистой суспензии, нанесения покрытий на поверхности сложных конфигураций, например, грунтовки кузовов автомобилей, для обезвоживания, в медицине как метод введения лекарственных средств в организм человека и т.д. С явлениями потенциала течения и потенциала седиментации приходится считаться в производствах, в которых осуществляется транспортировка жидкостей (перекачка технологических растворов, жидкого топлива), осаждение суспензий и эмульсий при разделении фаз и т.д. На концах трубопроводов и аппаратов могут возникать высокие разности потенциалов, которые являются причиной искровых разрядов, вызывающих пожары и взрывы. Очевидно, что причина электрокинетических явлений заключена в противоположности знаков зарядов твердой частицы и жидкой дисперсионной среды. С современной точки зрения на поверхности твердой фазы существует двойной электрический слой (ДЭС). 3.3.2. ПУТИ ОБРАЗОВАНИЯ ДЭС Возможны два принципиально разных пути образования ДЭС - избирательная адсорбция поверхностью твердой частицы ионов из дисперсионной среды и ионизация поверхностных молекул твердой частицы. Рассмотрим их подробнее. 1. Избирательная адсорбция. Здесь возможны два случая. а) Избирательная адсорбция ионов, способных достраивать кристаллическую решетку частицы дисперсной фазы. В соответствии с правилом Панета-Фаянса (см. раздел 2.5.7), на поверхности твердой частицы, избирательно адсорбируются только те ионы, которые способны достроить ее кристаллическую решетку или изоморфны с ней. Предположим, что твердые частицы хлорида серебра диспергированы в водном растворе хлорида калия.
В данном случае на поверхности будут сорбироваться ионы , так как они входят в состав кристаллической решетки и будут придавать частице отрицательный заряд, одновременно прилегающая к частице жидкая среда приобретает положительный заряд, т.е. возникает ДЭС. Ионы, которые придают заряд твердой частице, называются потенциалопределяющими, противоположно заряженные - противоионами. б) Избирательная адсорбция без достройки кристаллической решетки. Этот случай имеет место, когда в растворе имеются ионы, обладающие большой адсорбционной способностью -
2. Ионизация поверхностных молекул твердой частицы. Здесь также возможны два случая. а) В случае гидрозолей металлов в раствор переходят катионы металлов, твердая поверхность заряжается отрицательно, а дисперсионная среда положительно (подобно тому, как это происходит при возникновении электродного потенциала). Например:
б) В случае некоторых оксидов, кислот, белков и т.д. с твердой поверхности в дисперсионную среду переходят ионы одного заряда, ионы с противоположным зарядом остаются на твердой частице и являются потенциалопределяющими. Пример: гидрозоль диоксида кремния . Поверхностные молекулы реагируют с водой, образуя кремниевую кислоту, которая диссоциирует, отдавая в дисперсионную среду ионы .
Твердая частица при этом заряжается отрицательно, а среда - положительно. Поэтому при соприкосновения воды с толченым кварцем среда заряжается положительно и перемещается к отрицательному электроду. Аналогичная картина наблюдается при помещении стекла в водный раствор, так как основу стекла составляют силикаты. 3.3.3. СТРОЕНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ Существовало несколько теорий строения ДЭС, отметим наиболее значительные: • теория Гельмгольца-Перрена (1879); • теория Гуи-Чэпмена (1910-1913); • теория Штерна (1924). Отличие между этими теориями сводится, в основном, к различному толкованию структуры слоя противоионов. Не останавливаясь на рассмотрении этих теорий, перечислим современные представления: 1. ДЭС образован потенциалопределяющими ионами, находящимися на поверхности твердой частицы и эквивалентным количеством противоионов, находящихся в дисперсионной среде вблизи поверхности твердой частицы. 2. Потенциалопределяющие ионы прочно связаны с твердой частицей хемосорбционными силами и равномерно распределены по ее поверхности. 3. Дисперсионная среда рассматривается как непрерывная (бесструктурная) среда, характеризуемая диэлектрической проницаемостью и вязкостью 4. ДЭС рассматривается как плоскопараллельный. Это допущение приемлемо, так как толщина ДЭС намного меньше, чем радиус кривизны поверхности твердой частицы (поэтому нам кажется плоской Земля, радиус которой около 6000 км, а расстояние, на которое видит человеческий глаз, значительно меньше). 5. Противоионы имеют конечные размеры и, следовательно, не могут подходить к твердой поверхности ближе, чем на расстояние одного ионного радиуса. 6. Слой противоионов, компенсирующих заряд твердой поверхности, имеет сложное строение и состоит из двух частей: плотного слоя (адсорбционного слоя или слоя Гельмгольца) и диффузного слоя (слоя Гун). 7. Адсорбционный слой противоионов примыкает к заряженной поверхности твердой частицы и имеет толщину порядка диаметра гидратированного противоиона d. Те противоионы, которые находятся в этом пространстве, называются адсорбционными противоионами. Они связаны с заряженной твердой частицей двумя видами сил - адсорбционными и электростатическими. Эта связь является настолько прочной, что противоионы адсорбционного слоя перемещаются вместе с твердой частицей, не отрываются от нее, образуя с ней единое кинетическое целое - коллоидную частицу. Противоионы адсорбционного слоя равномерно распределены в слое, поэтому падение потенциала происходит линейно и равно 8. Диффузный слой имеет толщину , его образуют те противоионы, которые находятся от заряженной поверхности на расстоянии, большем d, но в пределах расстояния . Эти противоионы притягиваются к частице только электростатическими силами, а следовательно, менее прочно, чем противоионы адсорбционного слоя. При движении твердой частицы они от нее отрываются. На противоионы диффузного слоя большое влияние оказывает тепловое движение, которое стремится распределить их равномерно по всему объему системы. Его действие тем сильнее, чем дальше от заряженной поверхности находятся противоионы. Это приводит к установлению динамического равновесия в диффузном слое. Так как противоионы в диффузном слое распределены неравномерно, то и падение потенциала в нем ( 9. Полное падение потенциала в ДЭС называется термодинамическим потенциалом
Таким образом, в ДЭС происходит полная компенсация суммарного заряда твердой поверхности суммарным зарядом противоионов и на границе ДЭС с дисперсионной средой потенциал равен нулю. Схема строения ДЭС представлена на рис. 8.5 . Электрически нейтральную коллоидную частицу называют мицеллой. Строение мицеллы лиофобного золя AgCl можно представить в виде формулы:
где n - число молекул, образующих дисперсную частицу; m - число потенциалопределяющих ионов; (m-х) - число противоионов адсорбционного слоя; х - число противоионов диффузного слоя. При движении частицы двойной электрический слой разрывается. Место разрыва при перемещении твердой и жидкой фаз относительно друг друга называется плоскостью скольжения или границей скольжения. На рис. 8.5 плоскость скольжения обозначена линией АВ. Плоскость скольжения лежит или на границе между диффузным слоем и адсорбционным слоем, либо в диффузном слое, но вблизи этой границы. Потенциал на плоскости скольжения называется электрокинетическим потенциалом или дзета-потенциалом Дзета-потенциал является важнейшей характеристикой ДЭС: он определяет скорость относительного перемещения дисперсной фазы дисперсионной среды, интенсивность электрокинетических явлений, устойчивость золей и т.д. Величина дзета-потенциала определяется: • величиной термодинамического потенциала и характером падения потенциала в ДЭС; • характером движения жидкости вблизи твердой поверхности (он определяет местонахождение плоскости скольжения), который зависит, главным образом, от вязкости среды. 3.3.4. ФАКТОРЫ, ОТ КОТОРЫХ ЗАВИСИТ ДЗЕТА-ПОТЕНЦИАЛ Дзета-потенциал тем больше, чем больше термодинамический потенциал . Дзета-потенциал тем больше, чем больше , т.е. чем больше противоионов находится в диффузном слое (при одном и том же . На величину дзета-потенциала влияют: • добавка индифферентного электролита; • добавка неиндифферентного электролита; • рН среды и другие факторы. ВЛИЯНИЕ ЭЛЕКТРОЛИТОВ Индифферентным электролитом называется электролит, ионы которого не способны достроить кристаллическую решетку частицы дисперсной фазы. При введении в лиофобный золь индифферентного электролита возможны два случая. 1. В лиофобный золь вводится электролит, один ион которого одинаков с противоионом ДЭС. В этом случае термодинамический потенциал практически не изменится, следовательно, не изменится общее число противоионов, необходимых для компенсации потенциал определяющих ионов, но изменится их распределение в ДЭС. Так как концентрация противоионов в коллоидном растворе увеличится, естественно, увеличится их концентрация в адсорбционном слое, значит, в диффузном слое их останется меньше. Диффузный слой сжимается - это приводит к уменьшению дзета-потенциала по абсолютной величине. Может быть достигнуто такое состояние, когда все необходимое число противоионов находится в адсорбционном слое, диффузного слоя нет, дзета-потенциал равен нулю, золь находится в изоэлектрическом состоянии. Пример. Золь хлорида серебра стабилизирован хлоридом калия. Формула мицеллы:
Падение потенциала в ДЭС этой мицеллы показывает кривая 1 на рис. 8.6 . В изоэлектрическом состоянии мицелла будет выглядеть так:
На рис. 8.6 ей соответствует кривая 2 (термодинамический потенциал не изменился, дзета-потенциал равен нулю). 2. В лиофобный золь вводится индифферентный электролит, который не имеет ионов, входящих в ДЭС. В этом случае ион, заряд которого одинаков по знаку с зарядом противоиона будет конкурировать за нахождение в ДЭС, будет происходить ионный обмен в соответствии с уравнением Никольского (5.6). Влияние иона-конкурента на строение ДЭС зависит от его способности сжимать ДЭС: она возрастает от Если адсорбционные способности противоиона и иона-конкурента близки, то будет происходить сжатие ДЭС и уменьшение дзета-потенциала вплоть до нуля. Если же адсорбционная способность иона-конкурента значительно больше, чем данного противоиона (например, больше заряд), то может произойти перезарядка коллоидной частицы, т.е. дзета-потенциал изменит свой знак, сохраняя постоянным термодинамический потенциал. В качестве примера рассмотрим тот же гидрозоль AgCl, стабилизированный хлоридом калия (линия 1 на рис. 8.7 ). Если к этому золю добавлять нитрат натрия, будет происходить ионный обмен между ионами Так как их адсорбционные способности близки, увеличение концентрации ионов Na+ будет эквивалентно увеличению концентрации К+ и будет приводить к сжатию диффузного слоя и уменьшению дзета-потенциала по абсолютной величине вплоть до нуля (линия 2 на рис. 8.7). Если к исходному золю добавить Неиндифферентным электролитом называется электролит, один из ионов которого способен достраивать кристаллическую решетку твердой фазы, т.е. специфически адсорбироваться на поверхности твердой частицы, придавая ей свой заряд. При введении в золь неиндифферентного электролита также возможны два случая. 1. В систему вводится тот же электролит, который образовал ДЭС. В этом случае в золе одновременно возрастает концентрация как потенциалопределяющих ионов, так и противоионов. Естественно, это приводит к появлению двух противоположных тенденций: с одной стороны, увеличение концентрации потенциалопределяющих ионов увеличивает , а следовательно, и электрокинетический потенциал; с другой стороны, увеличение концентрации противоионов приводит к сжатию диффузного слоя и уменьшению дзета-потенциала. При малых концентрациях неиндифферентного электролита преобладает первый фактор и дзета-потенциал по абсолютной величине возрастает, при больших концентрациях дззта-потенциал уменьшается. 2. В систему вводится неиндифферентный электролит, имеющий потенциалопределяющие ионы противоположного знака. Например, в золь хлорида серебра, стабилизированного хлоридом калия:
добавили нитрат серебра, содержащий ионы Ag+, способные достроить кристаллическую решетку AgCl. По мере поступления ионов Ag+ в золь они попадают в адсорбционный слой и образуют с потенциалопределяющими ионами Сl- малорастворимое соединение AgCl, что приводит к уменьшению по абсолютной величине как , так и
Этот случай схематически представлен на рис. 8.8 . На рисунке линия 1 соответствует исходному золю AgCl, а линия 2 - золю, полученному в результате добавления избытка . ВЛИЯНИЕ РН Введение в золь ионов и может сильно сказываться на величине дзета-потенциала, так как эти ионы обладают высокой сорбционной способностью: ионы из-за малых размеров и, следовательно, большой плотности заряда, ионы - из-за большой поляризуемости. ВЛИЯНИЕ КОНЦЕНТРАЦИИ ЗОЛЯ Здесь наблюдаются две противоположные тенденции: с разбавлением золя уменьшается концентрация противоионов, что приводит к расширению ДЭС и, следовательно, к увеличению по абсолютной величине дзета-потенциала; с разбавлением золя усиливается десорбция потенциалопределяющих ионов, что приводит к уменьшению по абсолютной величине и, следовательно, дзета-потенциала. ВЛИЯНИЕ ТЕМПЕРАТУРЫ Влияние температуры на величину дзета-потенциала аналогично влиянию концентрации золя. С ростом температуры, с одной стороны, усиливается диффузия противоионов, ДЭС расширяется, дзета-потенциал по абсолютной величине возрастает; с другой стороны - усиливается десорбция потенциалопределяющих ионов, тем самым уменьшая абсолютную величину и дзета-потенциала. ВЛИЯНИЕ ПРИРОДЫ ДИСПЕРСИОННОЙ СРЕДЫ Дисперсионная среда обычно характеризуется двумя величинами: диэлектрической проницаемостью () и вязкостью (). Дзета-потенциал золя тем больше, чем больше диэлектрическая проницаемость среды. Роль вязкости сводится, главным образом, к положению границы скольжения АВ. Чем больше вязкость, тем толще слой дисперсионной среды, который "прилипает" к частице при разрыве мицеллы и, следовательно, тем меньше численное значение дзета-потенциала. 3.3.5. МЕТОДЫ ОПРЕДЕЛЕНИЯ ДЗЕТА-ПОТЕНЦИАЛА Все электрокинетические явления зависят от величины и знака дзета-потенциала. Проводя электроосмотические или электрофоретические измерения, можно определить величину дзета-потенциала. Не останавливаясь на методике измерения, приведем конечные уравнения, связывающие дзета-потенциал со скоростью электроосмотического или электрофоретического переноса:
где - динамическая вязкость дисперсионной среды; - абсолютная диэлектрическая проницаемость среды; U - скорость электрофоретического переноса (на основании измерений); Н - градиент потенциала внешнего поля, равный Е/l (Е - разность электродных потенциалов, l - расстояние между ними). Для электроосмотического метода:
где ЗАКЛЮЧЕНИЕ Поверхность твердых частиц, находящихся в жидкой дисперсионной среде, приобретает электрический заряд в результате преимущественной адсорбции одного из ионов электролита либо диссоциации поверхностных ионогенных групп. Независимо от механизма возникновения заряда на коллоидной частице возникает двойной электрический слой (ДЭС), состоящий из ионов на поверхности (потенциалопределяющих ионов) и из компенсирующих заряд поверхности ионов (противоионов) в растворе; причем часть противоионов находится в прилегающем к поверхности и прочно связанном с ней адсорбционном слое, а другая часть - в диффузном слое, удаленном от поверхности. Частицу дисперсной фазы вместе с ДЭС называю мицеллой; мицелла является нейтральной. При движении частицы в растворе происходит разрыв мицеллы на две части: твердую частицу с противоионами адсорбционного слоя, называемую коллоидной частицей, и противоионы диффузного слоя. Границу, по которой проходит разрыв мицеллы, называют границей скольжения, плоскость скольжения, как правило, не совпадает с границе, разделяющей адсорбционный и диффузный слои, а несколько смещена от нее в сторону раствора. Электрический потенциал на плоскости скольжения называется электрокинетическим или дзета-потенциалом, который отличается от термодинамического потенциала , который определяется зарядом поверхности. Наличием на частицах дисперсной фазы ДЭС обусловлены электрокинетические явления: электроосмос, электрофорез, потенциал течения и потенциал седиментации. Интенсивность всех электрокинетических явлений определяется значением дзета-потенциала. Экспериментальное определение скорости переноса в электрическом поле дисперсионной среды (электроосмос) или дисперсной фазы (электрофорез) позволяет определить значение дзета-потенциала. Введение в золь растворов электролитов приводит к изменению строения ДЭС и, как следствие, значения дзета-потенциала. В зависимости от природы и концентрации электролита может происходить: • сжатие ДЭС и уменьшение абсолютной величины дзета-потенциала; • увеличение абсолютных величин термодинамического и дзета-потенциала; • перезарядка поверхности частицы. Значение дзета-потенциала зависит также от величины рН, температуры и природы дисперсионной среды. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие вы знаете пути образования ДЭС? 2. Каково строение двойного электрического слоя? 3. В чем состоит отличие электрокинетического потенциала от термодинамического? 4. Какие вы знаете электрокинетические явления? В чем состоит сущность каждого из них? 5. Как экспериментально определяют величину дзета-потенциала? 6. В чем состоят различия неиндифферентного и индифферентного электролитов? 7. Каково строение мицеллы лиофобного золя? 8. В каких случаях при добавлении электролитов происходит перезарядка коллоидной частицы? 9. Напишите формулы мицелл следующих золей: а) золя карбоната бария б) золя сульфида свинца PbS, стабилизированного сульфидом натрия; в) золя бромида серебра AgBr, стабилизированного нитратом серебра; г) золя гидроксида железа д) золя хлорида свинца е) золя сульфата бария 10. Как изменится строение ДЭС и величина дзета-потенциала, если к золю, указанному в пункте д), прибавить: а) нитрат натрия; б) эквивалентное количество в) избыток ; г) иодид натрия; д) избыток Закончив изучение главы 8, вы должны 1) знать: • основные положения теории строения ДЭС; • электрокинетические явления; • влияние электролитов на строение ДЭС и величину дзета-потенциала; 2) уметь: • составлять формулы мицелл лиофобных золей; • предсказывать изменения строения ДЭС и величины дзета-потенциала при действии электролитов, изменении концентрации золя и природы дисперсионной среды. 3.4. ГЛАВА 9. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ Молекулярно-кинетические свойства обусловлены непрерывным хаотическим движением молекул и атомов. Молекулярно-кинетическая теория изучает законы самопроизвольного движения молекул в жидкостях и газах. Эта теория, разработанная в начале XX в. А. Эйнштейном, имела большое значение, поскольку явилась прямым доказательством существования молекул. Молекулярно-кинетические свойства коллоидных растворов проявляются в броуновском движении, диффузии и осмосе. 3.4.1. БРОУНОВСКОЕ ДВИЖЕНИЕ Броуновское движение открыл в 1827 г. английский ботаник Р. Броун. Рассматривая под микроскопом водную суспензию цветочной пыльцы, он обнаружил, что частицы непрерывно двигаются в поле зрения. Некоторые исследователи объясняли обнаруженное Броуном движение жизнедеятельностью пыльцы, однако позднее оказалось, что броуновское движение свойственно всем суспензиям, в том числе и суспензиям неорганических веществ. Броуновское движение - это непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров, не затухающее во времени. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды. Объяснение этого явления долгое время связывали с вешними причинами - нарушением механического равновесия, температурных условий и т.д. Гуи (1888) и Экснер (1900) предположили, что броуновское движение имеет молекулярно-кинетическую природу, т.е. Является следствием теплового движения. Эта точка зрения была подтверждена теоретически Эйнштейном и Смолуховским, а затем экспериментально Перреном, Сведбергом и другими исследователями. Теперь точно установлено, что броуновское движение обусловлено столкновениями молекул среды, находящимися в непрерывном тепловом движении, с взвешенными в ней частицами микроскопических или коллоидных размеров. В результате этих столкновений частица получает огромное число ударов со всех сторон. Результат этих ударов в значительной степени зависит от размеров частицы. Если частица имеет сравнительно большие размеры, то число одновременных ударов так велико, что в соответствии с законами статистики результирующий импульс оказывается равным нулю, и частица не будет двигаться под действием молекул среды. Кроме того, частицы с большой массой обладают значительной инерционностью и мало чувствительны к ударам молекул. Если частица сравнительно мала, то число получаемых ею одновременных ударов со стороны молекул среды значительно меньше, поэтому вероятность, неравномерного распределения импульсов, получаемых с разных сторон, увеличивается. Это обусловлено как разным количеством ударов, так и различной энергией молекул среды, сталкивающихся с частицей. В результате частицы приобретают поступательное, вращательное и колебательное движение. В основе статистической теории, разработанной Эйнштейном и Смолуховским в 1905-1906 гг., лежит следующий постулат. Броуновское движение совершенно хаотично, т.е. в нем наблюдается полная равноправность всех направлений. Количественной характеристикой броуновского движения принято считать средний сдвиг частицы Средний квадратичный сдвиг частицы
где R - универсальная газовая постоянная; - число Авогадро; Т - абсолютная температура; t - время наблюдения; - коэффициент вязкости; r - радиус частицы. Следовательно,
где Статистическая теория, приводящая к этому уравнению, имеет многочисленные и неоспоримые подтверждения. Результаты, полученные для частиц различной природы и размеров, показали близкое соответствие измеренных и вычисленных величин , явились блестящим доказательством реальности существования молекул и статистического характера второго начала термодинамики. Признание молекулярно-кинетической теории послужило толчком к развитию других плодотворных теорий. В коллоидной химии теория броуновского движения оказалась фактически первой количественной теорией. 3.4.2. ДИФФУЗИЯ Диффузией называется самопроизвольный процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. Процесс диффузии является необратимым, он протекает до полного выравнивания концентраций так как хаотическое распределение частиц отвечает максимальной энтропии системы. Для количественного описания диффузии используется первый закон Фика:
где m - количество продиффундировавшего вещества; D - коэффициент диффузии; Знак минус перед правой частью уравнения (9.3) стоит потому, что производная отрицательна, так как с увеличением х концентрация уменьшается. Часто для описания диффузии используется удельный поток диффузии - количество вещества, диффундирующее за единицу времени через сечение единичной площади.
Из этого уравнения виден физический смысл коэффициента диффузии D. Коэффициент диффузии численно равен количеству вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации, равном единице. А. Эйнштейн (1908) вывел уравнение, связывающее коэффициент диффузии D с абсолютной температурой Т, вязкостью дисперсионной среды и радиусом частиц дисперсной фазы r:
Связь между средним квадратичным сдвигом частиц и коэффициентом диффузии дает уравнение Эйнштейна-Смолуховского:
Из уравнения (9.6) следует, что сдвиг частиц пропорционален не 3.4.3. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ Осмотическое давление
где Это уравнение аналогично известному уравнению Вант-Гоффа для осмотического давления истинных растворов:
где М - масса одного моля растворенного вещества; с - массовая концентрация. Молекулярно-кинетические уравнения, справедливые для истинных растворов, применимы и к коллоидным растворам с той лишь разницей, что масса 1 моля вещества заменяется массой одной частицы. При одной и той же массовой концентрации число частиц (частичная концентрация) в коллоидном растворе значительно меньше, чем в истинном. Поэтому осмотическое давление лиофобных золей значительно меньше по сравнению с истинными растворами. Весьма малое осмотическое давление лиозолей было причиной ошибки Томаса Грэма, не располагавшего чувствительными осмометрами и считавшего, что у коллоидных растворов осмотическое давление отсутствует. ЗАКЛЮЧЕНИЕ Молекулярно-кинетические свойства коллоидных растворов обусловлены хаотическим тепловым движением молекул дисперсионной среды. Средняя кинетическая энергия молекул при постоянной температуре Т постоянна и равна kT, но отдельные молекулы обладают разной кинетической энергией. Коллоидные частицы постоянно испытывают удары молекул дисперсионной среды, причем количество ударов с разных сторон неодинаково и постоянно меняется. Это и является причиной броуновского движения. Интенсивность броуновского движения тем больше, чем выше температура, меньше масса частицы и вязкость среды. Результатом броуновского движения коллоидных частиц является диффузия - перемещение вещества из области с большей концентрацией в область с меньшей концепцией, т.е. выравнивание концентрации вещества по всему объему системы. Поскольку равномерное распределение вещества в системе наиболее вероятно, в термодинамическом отношении процесс диффузии идет с увеличением энтропии и поэтому является самопроизвольным. Несмотря на хаотический характер движения всех частиц, перенос вещества происходит вследствие того, что из области с более низкой концентрацией движется больше частиц, чем в обратном направлении. Количество диффундирующего вещества увеличивается с повышением температуры, уменьшением размеров коллоидных частиц и вязкости дисперсионной среды. Если коллоидный раствор отделен от чистого растворителя (дисперсионной среды) полупроницаемой мембраной, не пропускающей коллоидные частицы, возникает односторонняя диффузия молекул растворителя в коллоидный раствор, называемая осмосом. Причиной осмоса является хаотическое движение частиц. Подобно броуновскому движению и диффузии, осмос является процессом самопроизвольным. Переход растворителя в коллоидный раствор будет происходить до тех пор, пока постоянно возрастающее гидростатическое давление раствора не воспрепятствует ему. Это давление называется осмотическим давлением. Осмотическое давление тем больше, чем больше концентрация коллоидных частиц и чем выше температура. Рассмотренные молекулярно-кинетические свойства характерны как для истинных, так и для коллоидных растворов, но у последних они выражены значительно слабее, так как при одной и той же массовой концентрации число частиц в коллоидном растворе значительно меньше, чем в истинном. С молекулярно-кинетическими свойствами мы уже встречались в связи с очисткой коллоидных растворов. Эти свойства имеют также большое значение в связи с проблемами устойчивости коллоидных растворов, к рассмотрению которых мы переходим. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие свойства коллоидных растворов относятся к молекулярно-кинетическим? 2. В чем состоит сущность броуновского движения, дифузии, осмоса? Чем они обусловлены? 3. Являются ли броуновское движение, диффузия и осмос процессами самопроизвольными? Почему? 4. От каких факторов зависит интенсивность каждого из свойств? 5. В чем состоят различия между молекулярно-кинетическими свойствами коллоидных и истинных растворов? Закончив изучение главы 9, вы должны знать: • сущность броуновского движения, диффузии, осмоса; • факторы, от которых зависит каждое из указанных свойств. 3.5. ГЛАВА 10. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ. КОАГУЛЯЦИЯ Выше (см. главу 6) отмечалось, что образование дисперсных систем сопровождается увеличением свободной энергии системы. Следовательно, дисперсная система является принципиально термодинамически неустойчивой, т.е. рано или поздно должна самопроизвольно разрушиться. Поэтому речь может идти только об относительной термодинамической устойчивости дисперсных систем. Относительная устойчивость - это способность системы в течение определенного времени сохранять неизменной свою структуру, т.е. размеры частиц и их равномерное распределение в объеме системы. Относительная устойчивость разных дисперсных систем колеблется в достаточно широких пределах. Как мы увидим дальше, эмульсия без эмульгатора разрушается в течение нескольких секунд с момента ее образования, а красный золь золота, полученный Фарадеем в середине XIX в., "живет" до сих пор. Следовательно, существуют какие-то причины длительного существования принципиально неустойчивых (термодинамически) систем. Проблема устойчивости дисперсных систем - одна из важнейших проблем коллоидной химии. В 1917 году Песков предложил разграничивать относительную устойчивость дисперсных систем как: а) седиментационную (кинетическую) устойчивость; б) агрегативную устойчивость. Эти два вида устойчивости различны по своему механизму и требуют раздельного рассмотрения. 3.5.1. СЕДИМЕНТАЦИОННАЯ УСТОЙЧИВОСТЬ ДИСПЕРСНЫХ СИСТЕМ Седиментационная устойчивость - это способность дисперсной системы сохранять неизменным во времени распределение частиц по объему системы, т.е. способность системы противостоять действию силы тяжести. Чтобы оценить седиментационную устойчивость системы, необходимо знать следующие характеристики: r - радиус частицы дисперсной фазы; - плотность частицы; По закону Архимеда, на каждую частицу в системе действует сила тяжести (подъемная сила), равная:
где g - ускорение свободного падения. Эффективная масса частицы m' равна
Если
При оседании частицы в дисперсионной среде с вязкостью возникает встречная сила - сила трения
где Таким образом, чем больше скорость оседания, тем больше сила трения, замедляющая оседание. В результате устанавливается стационарный режим седиментации, которому соответствует Итак,
Часто для характеристики процесса седиментации используют не скорость седиментации , а удельный поток седиментации Удельный поток седиментации - это число частиц, оседающих в единицу времени через сечение единичной площади, нормальное к направлению седиментации. Размерность Из определения следует:
где - концентрация частиц в дисперсной системе. Подставив в это уравнение значение из (10.5), получим
Таким образом, удельный поток седиментации прямо пропорционален Для сферической частицы радиуса r
Значит, в случае сферических частиц удельный поток седиментации прямо пропорционален квадрату радиуса и обратно пропорционален вязкости среды. Однако, рассматривая процесс седиментации, мы до сих пор не учитывали броуновского движения, в котором участвуют частицы микроскопических и коллоидных размеров. Следствием броуновского движения, как мы знаем, является диффузия, которая стремится выровнять концентрацию частиц по всему объему, в то время как седиментация приводит к увеличению концентрации в нижних слоях. Таким образом, наблюдается два противоположных потока: поток седиментации и поток диффузии
Каков же результат конкуренции этих потоков? Возможны три варианта:
Чтобы выполнилось это неравенство, значения Т и
Это условие должно выполняться, когда Т и велики, а - малы. Но и здесь решающую роль играет радиус частиц. Установлено, что это неравенство выполняется при
В системе имеет место седиментационно-диффузионное равновесие. Проинтегрируем это уравнение, разделив переменные:
где
гипсометрический закон Лапласа-Перрена. В этом случае система является седиментационно-устойчивой, но распределение частиц в ней не равномерное, а равновесное. Это распределение наблюдается, когда В качестве примера рассмотрим дисперсную систему, в которой дисперсной фазой являются сферические частицы диоксида кремния , а дисперсионной средой - вода, Таблица 10.1. Скорость седиментации SiO2 в зависимости от размера частиц r, см 10-3 10-4 10-5 10-6 10-7 Uсед см/с 3,2.10-2 3,2.10-4 3,2.10-6 3,2.10-8 3,2.10-10 Время, за которое частица осаждается на 1 см 31 c 51,7 мин 86,2 час 359 сут 100 лет Из таблицы следует, что седиментация в лиофобных золях протекает очень медленно. Итак, седиментационная устойчивость дисперсных систем определяется, главным образом, размерами частиц дисперсной фазы: лиофобные золи ( см) - седиментационно устойчивые системы, характерна диффузия, обеспечивающая равномерное распределение частиц по объему системы; микрогетерогенные системы ( грубодисперсные (более 3.5.2. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ. КОАГУЛЯЦИЯ Агрегативная устойчивость - это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность. При нарушении агрегативной устойчивости происходит коагуляция. Коагуляцией называется процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении. Коагуляция является самопроизвольным процессом, так как она приводит к уменьшению межфазной поверхности и, следовательно, к уменьшению свободной поверхностной энергии. Различают две стадии коагуляции. 1 стадия - скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости. 2 стадия - явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок. Причины коагуляции многообразны. Едва ли существует какое-либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию. К таким воздействиям относятся: изменение температуры; действие электрического и электромагнитного полей; действие видимого света; облучение элементарными частицами; механическое воздействие; добавление электролитов и др. Все эти воздействия, различные по характеру, обладают общим свойством - они уничтожают энергетический барьер (потенциальный барьер коагуляции Наибольший практический интерес вызывает коагуляция электролитами. ПРАВИЛА КОАГУЛЯЦИИ 1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию, Минимальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции Иногда вместо порога коагуляции используют величину
Значит, чем меньше порог коагуляции, тем больше коагулирующая способность электролита. 2. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает но знаку с зарядом противоиона мицеллы лиофобного золя. Этот ион называют ионом-коагулянтом. 3. Коагулирующая способность иона-коагулянта тем больше, чем больше заряд иона. Количественно эта, закономерность описывается эмпирическим правилом Шульце-Гарди.
где - постоянная для данной системы величина; Z - заряд иона-коагулянта; 4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Поэтому коагулирующая способность органических ионов больше по сравнению с неорганическими ионами. Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Этот ряд называется лиотропным. При увеличении концентрации иона-коагулянта дзета-потенциал мицеллы золя уменьшается по абсолютной величине. Коагуляция может начинаться уже тогда, когда дзета-потенциал снижается до 0,025-0,040 В (а не до нуля). 3.5.3. КИНЕТИКА КОАГУЛЯЦИИ ЭЛЕКТРОЛИТАМИ В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции. Скорость коагуляции - это изменение концентрации коллоидных частиц в единицу времени при постоянном объеме системы.
где - концентрация частиц; t - время. Знак "-" стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна. Степень коагуляции :
где Z - общее число столкновений частиц в единицу времени; Если = 0, коагуляция не происходит, коллоидный створ агрегативно устойчив. Если = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию. Если 0 << 1, наблюдается медленная коагуляция т.е. только некоторые столкновения частиц приводят к их слипанию. Чтобы частицы при столкновении слиплись, а не разлетелись как упругие шары должен быть преодолен потенциальный барьер коагуляции . Следовательно, коагуляция произойдет только в том случае, когда коллоидные частицы будут обладать кинетической энергией, достаточной для преодоления этого барьера. Для увеличения степени коагуляции необходимо снижать потенциальный барьер. Это может быть достигнуто добавлением к золю электролита-коагулянта. Зависимость скорости коагуляции от концентрации электролита представлена на рис. 10.1 . На графике видны три участка: I. II.
На этом участке происходит медленная коагуляция. III. Каждое столкновение приводит к слипанию частиц - идет быстрая коагуляция. БЫСТРАЯ КОАГУЛЯЦИЯ Теория быстрой коагуляции, разработанная М. Смолуховским в 1916 г., основана на следующих положениях. 1. Рассматриваемая система является монодисперсной, радиус частиц r. 2. 3. Рассматриваются только столкновения первичных частиц. 4. Кинетика коагуляции подобна кинетике бимолекулярной реакции:
где k - константа скорости коагуляции. Проинтегрируем это уравнение, разделив переменные:
где - концентрация частиц золя в начальный момент времени; Для характеристики быстрой коагуляции используется период коагуляции (период половинной коагуляции) . Период коагуляции () - это время, через которое концентрация коллоидных частиц уменьшается в два раза.
Согласно теории быстрой коагуляции, константа коагуляции зависит от коэффициента диффузии и может быть вычислена по уравнению
Если подставить в это уравнение величину коэффициента диффузии (уравнение 9.5), получим:
Таким образом, зная вязкость дисперсионной среды и температуру, можно вычислить константу скорости быстрой коагуляции. Теория Смолуховского неоднократно проверялась экспериментально и получила блестящее подтверждение, несмотря на сделанные автором допущения. МЕДЛЕННАЯ КОАГУЛЯЦИЯ Медленная коагуляция связана с неполной эффективностью столкновений вследствие существования энергетического барьера. Простое введение величины степени коагуляции в формулы теории Смолуховского не привело к согласию теории с опытом. Более совершенную теорию медленной коагуляции разработал Н. Фукс. Он ввел в кинетическое уравнение коагуляции множитель, учитывающий энергетический барьер коагуляции :
где Таким образом, для расчета константы скорости медленной коагуляции необходимо знать потенциальный барьер коагуляции, величина которого зависит прежде всего от дзета-потенциала. 3.5.4. ФАКТОРЫ УСТОЙЧИВОСТИ ЛИОФОБНЫХ ЗОЛЕЙ Фактор устойчивости, или коэффициент замедления W, показывает, во сколько раз константа скорости медленной коагуляции меньше константы скорости быстрой коагуляции.
Следует отметить пять факторов устойчивости, которых два первых играют главную роль. 1. Электростатический фактор устойчивости. Он обусловлен наличием ДЭС и дзета-потенциала на поверхности частиц дисперсной фазы. 2. Адсорбционно-сольватный фактор устойчивости. Он обусловлен снижением поверхностного натяжения в результате взаимодействия дисперсионной среды с частицей дисперсной фазы. Этот фактор играет заметную роль, когда в качестве стабилизаторов используются коллоидные ПАВ, с которыми мы познакомимся позднее. 3. Структурно-механический фактор устойчивости. Он обусловлен тем, что на поверхности частиц дисперсной фазы образуются пленки, обладающие упругостью и механической прочностью, разрушение которых требует времени и затраты энергии. Этот фактор устойчивости реализуется в тех случаях, когда в качестве стабилизаторов используются высокомолекулярные соединения (ВМС). 4. Энтропийный фактор устойчивости. Коагуляция приводит к уменьшению числа частиц в системе, следовательно, к уменьшению энтропии 5. Гидродинамический фактор устойчивости. Ему способствует увеличение плотности и динамической вязкости дисперсионной среды. В реальных системах действуют, как правило, несколько факторов устойчивости. Каждому фактору соответствует специфический способ его нейтрализации. Это затрудняет создание общей теории устойчивости. Пока существуют лишь частные теории. ТЕОРИЯ УСТОЙЧИВОСТИ ЛИОФОБНЫХ ЗОЛЕЙ - ТЕОРИЯ ДЛФО (ФИЗИЧЕСКАЯ ТЕОРИЯ) Современная теория устойчивости, развитая российскими учеными Б.В. Дерягиным и Л.Д. Ландау, получила всеобщее признание. Несколько позднее теоретическая разработка, которая привела практически к тем же результатам, была осуществлена голландскими учеными Фервеем и Овербеком. Поэтому современная теория устойчивости носит имя указанных ученых и известна в литературе как теория ДЛФО (DLVO). Когда коллоидные частицы подходят очень близко друг к другу, их диффузные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. Устойчивость лиофобных золей определяется, главным образом, особыми свойствами этих тонких жидких слоев. Когда две коллоидные частицы, находящиеся в дисперсионной среде, сближаются, вначале они разделены толстым слоем жидкости, который постепенно утончается и в результате становится очень тонким. После образования тонкого жидкого слоя утончение его может продолжаться, и это еще больше сближает частицы. Утончение жидкого слоя заканчивается либо разрывом его при некоторой малой толщине, либо достижением некоторой равновесной толщины, которая далее не уменьшается. В первом случае частицы слипаются, а во втором - нет. Очевидно, что свойства тонкого жидкого слоя определяют, произойдет ли коагуляция, т.е. определяют устойчивость коллоидов. Исследования показали, что утончение тонкого слоя при сближении частиц происходит путем вытекания аз него жидкости. Когда жидкий слой становится достаточно тонким (толщина его меньше 100-200 нм), свойства жидкости в нем начинают сильно отличаться от свойств жидкости в окружающем объеме. В слое появляется дополнительное давление, которое один из авторов теории ДЛФО Б.В. Дерягин назвал "расклинивающим давлением". По определению Дерягина, оно положительно, когда давление в слое понижено, это противодействует вытеканию из него жидкости, т.е. препятствует сближению коллоидных частиц. Отсюда происходит название "расклинивающее", т.е. давление, которое раздвигает, "расклинивает" частицы. Расклинивающее давление может быть и отрицательным, т.е. повышать давление в слое, ускорять вытекание из него жидкости и способствовать сближению частиц. Возникновение расклинивающего давления в тонких жидких слоях обусловлено, главным образом, двумя факторами: 1) электростатическое взаимодействие в слое - это силы отталкивания с энергией 2) ван-дер-ваальсовы силы притяжения с энергией Результирующая энергия межчастичного взаимодействия U определяется как сумма двух составляющих:
Если Рассмотрим количественную интерпретацию этих сил. ЭЛЕКТРОСТАТИЧЕСКИЕ СИЛЫ ОТТАЛКИВАНИЯ Электростатическое отталкивание между мицеллами возникает при перекрывании диффузных слоев противоионов. Энергия этого взаимодействия:
где h - расстояние между частицами; Величины и А могут быть рассчитаны на основе теории ДЭС. Расчеты показывают, что энергия отталкивания уменьшается: • при увеличении зарядов противоионов и их концентрации; • при уменьшении по абсолютной величине и дзета-потенциала. Из уравнения (10.16) следует, что ВАН-ДЕР-ВААЛЬСОВЫ СИЛЫ ПРИТЯЖЕНИЯ Энергия притяжения связана, главным образом, с дисперсионным взаимодействием между молекулами. Она может быть рассчитана по уравнению:
где Из уравнения (10.17) следует, что энергия притяжения изменяется с увеличением расстояния между частицами h обратно пропорционально квадрату расстояния. Таким образом, притяжение сравнительно медленно уменьшается с увеличением расстояния. Так, при увеличении h в 100 раз энергия притяжения уменьшается в Результирующая энергия взаимодействия между частицами, находящимися на расстоянии h, определяется уравнением:
Так как характер зависимости от h для энергии притяжения и отталкивания различный, естественно, что зависимость суммарной потенциальной энергии межчастичного взаимодействия от расстояния между частицами имеет сложный характер. Общий вид этой зависимости U = f(h) представлен на рис. 10.2 . На графике есть три участка: 1) Происходит коагуляция. 2) 3) При Таким образом, если частицы сблизятся на расстояние меньше Рассмотрим взаимодействие двух частиц. Будем одну частицу считать неподвижной, а вторую - приближающейся к ней с энергией, равной kT. Если Если Если Если Так как золь обычно рассматривают при постоянной температуре, кинетическая энергия частиц остается постоянной. Следовательно, для коагуляции должен быть уменьшен потенциальный барьер коагуляции . Обычно для понижения потенциального барьера в систему вводится электролит-коагулянт. Теория ДЛФО дает возможность вычислить порог быстрой коагуляции :
где А, В - постоянные величины, которые могут быть рассчитаны; - диэлектрическая проницаемость среды; Z - заряд иона-коагулянта; е - заряд электрона. Из этой формулы видно, что зависимость порога коагуляции от заряда иона-коагулянта, выведенная из теории ДЛФО, согласуется с эмпирическим правилом Шульце-Гарди:
3.5.5. ВИДЫ КОАГУЛЯЦИИ ЭЛЕКТРОЛИТАМИ При коагуляции золя электролитами различают концентрационную коагуляцию и нейтрализационную коагуляцию. Концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения дзета-потенциала. Рассмотрим концентрационную коагуляцию золя хлорида серебра, стабилизированного нитратом серебра, при введении в золь нитрата калия. Формула мицеллы имеет вид:
На рис. 10.3 показан график изменения потенциала в ДЭС мицеллы хлорида серебра. Кривая 1 относится к исходной мицелле, кривая 2 - после добавления
На рис. 10.4 представлены потенциальные кривые, характеризующие взаимодействие частиц в этом золе. Дзета-потенциал исходной коллоидной частицы положительный, это создает потенциальный барьер коагуляции > 0 (кривая 1). Поэтому при столкновении коллоидные частицы отталкиваются друг от друга, коагуляция не происходит. После добавления нитрата калия дзета-потенциал становится равным нулю и = 0 (кривая 2). Поэтому ничто не мешает коллоидным частицам сблизиться на такое расстояние, где преобладают силы притяжения - происходит коагуляция. Так как в данном случае причиной коагуляции является увеличение концентрации противоионов, она называется концентрационной коагуляцией. Нейтрализационная коагуляция происходит при добавлении к золю неиндифферентного электролита. Как отмечалось в разделе 3.3.4, при этом потенциалопределяющие ионы связываются в малорастворимое соединение, что приводит к уменьшению абсолютных величин термодинамического потенциала, а следовательно, и дзета-потенциала вплоть до нуля. Если взять в качестве исходного только что рассмотренный золь хлорида серебра, то для нейтрализации потенциалопределяющих ионов Ag+ в золь необходимо ввести, например, хлорид калия. После добавления определенного количества этого неиндифферентного электролита мицелла будет иметь вид:
В системе не будет ионов, способных адсорбироваться на поверхности частицы AgCl, и поверхность станет электронейтральной. При столкновении таких частиц происходит коагуляция. Так как причиной коагуляции в данном случае является нейтрализация потенциалопределяющих ионов, такую коагуляцию называют нейтрализационной коагуляцией Необходимо отметить, что для полной нейтрализационной коагуляции неиндифферентный электролит должен быть добавлен в строго эквивалентном количестве. КОАГУЛЯЦИЯ СМЕСЬЮ ЭЛЕКТРОЛИТОВ Коагуляция смесью электролитов имеет большое практическое значение, так как даже при добавлении к золю одного электролита-коагулянта, в действительности коагуляция происходит, по крайней мере, под влиянием двух электролитов, так как в системе, кроме того, содержится электролит-стабилизатор. Кроме того, в технике для коагуляции часто применяют смесь двух электролитов. Понимание закономерностей взаимного действия электролитов важно также при исследовании воздействия биологически активных ионов на органы и ткани живого организма. При коагуляции золя смесью двух электролитов возможны три случая (рис. 10.5 ). По оси абсцисс отложена концентрация первого электролита 1. Аддитивное действие электролитов (линия 1). Электролиты действуют как бы независимо один от другого, их суммарное действие складывается из воздействий каждого из электролитов. Если 2. Синергизм действия (линия 2). Электролиты как бы способствуют друг другу - для коагуляции их требуется меньше, чем нужно по правилу аддитивности
3. Антагонизм действия (линия 3). Электролиты как бы противодействуют друг другу, и для коагуляции их следует добавить больше, чем требуется по правилу аддитивности. Антагонизм наблюдается при большом различии в коагулирующем действии электролитов. Существует несколько теорий, объясняющих явление антагонизма. Одной из его причин может служить химическое взаимодействие между ионами. Например, для золя AgCl, стабилизированного хлоридом калия, коагулирующим действием обладают катионы. Например, большой коагулирующей способностью обладает четырехзарядный ион тория
и вместо четырехзарядных ионов в золе будут находиться однозарядные катионы К+, коагулирующее действие которых значительно слабее (правило Шульце-Гарди). 3.5.6. ЗАЩИТА КОЛЛОИДНЫХ ЧАСТИЦ Коллоидной защитой называется повышение агрегативной устойчивости золя путем введения в него высокомолекулярного соединения (ВМС). Для гидрофобных золей в качестве ВМС обычно используются белки, углеводы, пектины; для неводных золей - каучуки. Защитное действие ВМС связано с образованием на поверхности коллоидных частиц определенного адсорбционного слоя. В присутствии ВМС золи, которые вообще не поддаются концентрированию, можно даже выпарить досуха, а затем снова превратить в коллоидный раствор. Коагуляцию таких золей можно осуществить только веществами, осаждающими защитное вещество. Так, золи, защищенные желатином, теряют устойчивость при добавлении таннидов, образующих с желатином нерастворимое соединение. Для характеристики защитного действия различных ВМС Зигмонди предложил использовать золотое число. Золотое число - это количество миллиграммов BMС, которое надо добавить к 10 Известно, что при добавлении к красному золю золота некоторого количества NaCl начнется коагуляция золя, частички золота будут укрупняться, что приведет к изменению окраски золя - он станет синим. Таким образом, за процессом коагуляции золя золота можно наблюдать невооруженным глазом на стадии, когда еще нет осадка. Чтобы была возможность сравнивать защитное действие разных ВМС, необходимо добавлять всегда к одному и тому же золю определенной концентрации одинаковое количество коагулянта. Иногда для характеристики защитного действия ВМС вместо золя золота используются коллоидные растворы серебра (серебряное число), гидроксида железа (железное число) и др. В таблице 10.2 приведены значения этих чисел для некоторых ВМС. Таблица 10.2. Защитное действие некоторых ВМС Защитное вещество Число золотое серебряное железное Желатин 0,01 0,035 5 Гемоглобин 0,03-0,07 - - Гуммиарабик 0,5 1,25 25 Декстрин 20 100 20 Казеинат натрия 0,01 - - Крахмал картофельный 20 - - Яичный альбумин 2,5 1,5 15 3.5.7. СЕНСИБИЛИЗАЦИЯ В некоторых случаях введение в коллоидную систему очень малых количеств ВМС приводит не к защите, а к снижению устойчивости. Сенсибилизацией называется снижение порога коагуляции золя при добавлении в него ВМС. Это явление особенно характерно для линейных макромолекул, несущих полярные группы на обоих концах цепи (например, поливиниловых спиртов). Длинная молекула полимера присоединяется двумя концами к двум разным частицам дисперсной фазы, скрепляет их углеводородным мостиком. Этот вид коагуляции, называемый флокуляцией, приводит к образованию рыхлых хлопьевидных частиц - флокул. Благодаря сравнительной дешевизне флокулянтов, флокуляция широко используется для очистки природных и сточных вод. Большое практическое применение в качестве флокулянта находит полиакриламид (ПАА):
вещество, растворимое в воде. 3.5.8. ГЕТЕРОКОАГУЛЯЦИЯ И ГЕТЕРОАДАГУЛЯЦИЯ Гетерокоагуляцией называется слипание разнородных частиц. Один из типичных случаев гетерокоагуляции - так называемая взаимная коагуляция - слипание разноименно заряженных частиц, которое происходит за счет электростатических сил притяжения. Этот процесс широко используют для разрушения дисперсных систем, необходимого при очистке природных и промышленных сточных вод. Так, на водопроводных станциях перед подачей воды на песчаные фильтры к ней добавляют Однако гетерокоагуляция может происходить тогда, когда частицы золя несут заряды одного знака. Гетероадагуляцией называют прилипание части дисперсной фазы к вводимой в систему чужеродной поверхности. Термин "гетероадагуляция" - это сокращение полно названия: гетерогенная адгезионная коагуляция. По мнению С.С. Воюцкого, одной из причин потери устойчивости дисперсных систем в присутствии чужеродной поверхности является адсорбция стабилизатора на этой поверхности и уменьшение его концентрации в коллоидной системе Примером гетероадагуляции может служить отложение коллоидных частиц на волокне, используемое при дублении, крашении и т.д. ЗАКЛЮЧЕНИЕ Образование лиофобных дисперсных систем сопровождается увеличением свободной поверхностной энергии, поэтому дисперсные системы термодинамически неустойчивы. В то же время при определенных условиях они могут сохраняться в течение длительного времени. Существует два вида относительной устойчивости дисперсных систем: седиментационная и агрегативная. Седиментационная устойчивость - способность системы противостоять действию силы тяжести. Действию силы тяжести противостоит диффузия. Соотношение этих факторов, т.е. седиментационная устойчивость определяется, главным образом, размерами частиц дисперсной фазы. В лиофобных золях размеры частиц малы ( см) и диффузия обеспечивает равномерное распределение частиц в объеме системы. Лиофобные золи седиментационно устойчивы. Агрегативная устойчивость - способность системы сохранять неизменными во времени размеры частиц, т.е. противостоять их слипанию - коагуляции. Существуют пять факторов, которые могут обеспечивать агрегативную устойчивость золя: электростатический; адсорбционно-сольватный; структурно-механический; энтропийный; гидродинамический. Наиболее важным является электростатический фактор устойчивости, обусловленный наличием на поверхности коллоидных частиц ДЭС и электрокинетического потенциала. Снижение величины дзета-потенциала до 0,025-0,040 В приводит к началу коагуляции. Это достигается введением в золь любого сильного электролита. Коагулирующим действием обладает ион, заряд которого по знаку совпадает с зарядом противоиона в ДЭС. Коагулирующее действие иона тем больше, чем больше его заряд (правило Шульце-Гарди) и больше кристаллический радиус. При действии на золь электролитами может возникать концентрационная или нейтрализационная коагуляция. Концентрационная коагуляция происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения дзета-потенциала. Нейтрализационная коагуляция происходит при введении неиндифферентного электролита, который связывает потенциалопределяющие ионы, что приводит к уменьшению абсолютных величин термодинамического и электрокинетического потенциалов. При действии на золь смеси двух электролитов возможны три случая: • аддитивное действие (электролиты действуют независимо); • синергизм действия (взаимное усиление коагулирующего действия); • антагонизм действия (ослабление коагулирующего действия одного электролита другим). Теория устойчивости лиофобных золей ДЛФО рассматривает процесс коагуляции как результат одновременного Действия ван-дер-ваальсовых сил притяжения и электростических сил отталкивания между частицами. В зависимости от соотношения этих сил в тонкой прослойке жидкости между сближающимися частицами возникает либо положительное расклинивающее давление, препятствующее соединению, либо отрицательное, приводящее к утончению прослойки жидкости и коагуляции. Теория позволяет рассчитать молекулярную и электростатическую составляющие расклинивающего давления и построить вые потенциальной энергии системы в зависимости от расстояния между частицами. Потенциальный барьер и потенциальные ямы на кривых определяют агрегативную устойчивость и возможность коагуляции золей. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Являются ли коллоидные растворы термодинамически устойчивыми? 2. Чем определяется седиментационная устойчивость дисперсных систем? Являются ли коллоидные растворы седиментационно устойчивыми? 3. Какие факторы агрегативной устойчивости лиофобных золей вам известны? 4. Сформулируйте правила коагуляции золей электролитами. 5. В чем состоит различие между нейтрализационной и концентрационной коагуляцией? 6. Сформулируйте основные положения теорий быстрой и медленной коагуляции. 7. В чем состоит сущность теории ДЛФО? Что называется расклинивающим давлением? 8. Что представляют собой потенциальные кривые взаимодействия между коллоидными частицами? Как объясняются на их основе явления коагуляции? 9. Какие случаи коагуляции смесью электролитов вы знаете? 10. В чем заключаются защитное действие и сенсибилизация? Закончив изучение главы 10, вы должны 1) знать: виды устойчивости дисперсных систем, чем они обусловлены; факторы агрегативной устойчивости золей; правила коагуляции электролитами; сущность теории ДЛФО; 2) уметь: сравнивать пороги коагуляции разных электролитов; анализировать потенциальные кривые взаимодействия коллоидных частиц. 3.6. ГЛАВА. 11. СТРУКТУРИРОВАННЫЕ ДИСПЕРСНЫЕ СИСТЕМЫ В процессе коагуляции в коллоидном растворе происходит образование пространственной сетки из частиц дисперсной фазы - образуется структура. В соответствии с потенциальной кривой взаимодействия коллоидных частиц (см. рис. 10.2) коагуляция может соответствовать первичному (I) или вторичному (II) минимуму. В первом потенциальном минимуме частицы находятся в непосредственном контакте, между ними возникает химическое взаимодействие (возникают химические связи), приводящее к образованию компактного осадка. Во втором потенциальном минимуме взаимодействующие частицы разделены слоем дисперсионной среды, непосредственного контакта нет, возникают межмолекулярные силы притяжения. Таким образом, возникают различные по характеру структуры. П.А. Ребиндер предложил подразделить структурированные системы на два класса, исходя из типа взаимодействий: • коагуляционные структуры (тиксотропно-обратимые гели); • конденсационно-кристаллизационные структуры (необратимо разрушающиеся). 3.6.1. КОАГУЛЯЦИОННЫЕ СТРУКТУРЫ Структура образуется за счет сцепления частиц ван-дер-ваальсовыми силами через прослойки дисперсионной среды в рыхлые каркасы - гели. Свойства таких структур определяются не столько механическими свойствами самих частиц, сколько характером и особенностями межчастичных взаимодействий и свойствами прослоек дисперсионной среды. Для этих структур характерны следующие свойства: • тиксотропия; • синерезис; • небольшая прочность; • набухание; • ползучесть. Наличие жидкостной прослойки между частицам обусловливает небольшую прочность структуры, вместе тем придает ей пластичность, а в некоторых случаях и эластичность. Чем толще прослойка среды, тем меньше сказывается действие межмолекулярных сил, тем менее прочна структура и тем жидкообразнее система. На процесс гелеобразования влияют следующие факторы. 1. Концентрация дисперсной фазы: с повышением частичной концентрации возрастает число контактов и скорость их возникновения. 2. Размеры частиц: чем они меньше при постоянной массовой концентрации дисперсной фазы, тем больше образуется контактов. 3. Форма частиц: гелеобразование облегчается, если частицы анизодиаметричны и имеют углы, ребра и т.д. В этих местах двойные электрические слои или сольватные оболочки наименее развиты и слипание частиц облегчается. 4. Температура: при повышении температуры скорость гелеобразования увеличивается. Однако в результате повышения интенсивности броуновского движения гели могут переходить даже в неструктурированные жидкости. 5. Механическое воздействие: обычно перемешивание препятствует образованию геля. Однако в некоторых случаях скорость образования геля из агрегативно неустойчивого золя с сильно анизодиаметричными частицами (например, золь Рассмотрим некоторые свойства коагуляционных структур. ТИКСОТРОПИЯ Тиксотропией называется способность коагуляционных структур после их механического разрушения, произвольно восстанавливать во времени свою структуру. Таким образом, тиксотропия - это обратимый переход золь Тиксотропный период - время, за которое система восстанавливает структуру после снятия механического воздействия. Тиксотропный период может меняться в широких пределах. В спокойном состоянии система представляет собой пластическое твердообразное тело, которое не течет под действием силы тяжести. После встряхивания система настолько разжижается, что легко вытекает из сосуда. Через определенное время она снова становится нетекучей. СИНЕРЕЗИС Синерезисом называется явление самопроизвольного уменьшения размеров геля за счет выделения дисперсионной среды, содержавшейся в структуре геля. Синерезис обусловлен возрастанием во времени числа и прочности контактов между частицами, а в некоторых случаях - возникновением кристаллизационных мостиков между частицами. В результате синерезиса гелеобразная система может превратиться в сплошное кристаллическое тело. Самопроизвольный переход коагуляционной структуры в конденсационно-кристаллизационную с "выжиманием" жидкости - типичный пример синерезиса. Синерезису благоприятствуют все факторы, которые способствуют коагуляции: введение электролита-коагулянта; повышение температуры; введение в систему десольватирующих агентов и т.д. НАБУХАНИЕ Системы с коагуляционной структурой, из которых высушиванием удалена дисперсионная среда (ксерогели) способны в той или иной степени поглощать эту среду при контакте с ней. При этом происходит раздвижение элементов структуры геля и заполнение образовавшихся промежутков дисперсионной средой. Этот процесс называется набуханием. Очевидно, что набухание является процессом, обратным синерезису. Вследствие того, что при образовании пространственной структуры лиофобных систем места контактов закрепляются довольно прочно, лиофобные ксерогели набухают незначительно. Со свойством ползучести мы встретимся позднее. 3.6.2. КОНДЕНСАЦИОННО-КРИСТАЛЛИЗАЦИОННЫЕ СТРУКТУРЫ Как уже отмечалось выше, образование таких структур осуществляется при непосредственном химическом взаимодействии между частицами и их срастании с образованием жесткой объемной структуры. Если частицы аморфны, образующиеся структуры принято называть конденсационными, а если частицы кристаллические, структуры называются кристаллизационными. Так как такие структуры образуются в результате срастания частиц, механические свойства этих структур соответствуют свойствам самих частиц. Конденсационно-кристаллизационные структуры не могут проявлять свойства тиксотропии, синерезиса, набухания - они проявляют упруго-хрупкие свойства. И* прочность обычно значительно выше прочности коагуляционных структур. Типичной конденсационной структурой является гель кремневой кислоты. Кристаллизационное структурообразование имеет большое значение для твердения минеральных вяжущих веществ в строителей материалах на основе цементов, гипса или извести. Конденсационно-кристаллизационные структуры типичны для связнодисперсных систем с твердой дисперсионной средой. Они придают телам прочность, хрупкость и не восстанавливаются после разрушения. Материалы и изделия, используемые человеком в его практической деятельности, являются, как правило, твердыми телами, имеющими конденсационно-кристаллизационную структуру (металлы, керамика, бетон и т.д.), а сырье и промежуточные продукты чаще всего представляют собой жидкообразные или твердообразные системы с коагуляционной структурой. В процессе изготовления материалов и изделий из них, как правило, осуществляется переход от коагуляционных структур к конденсационно-кристаллизационным. Из схемы (рис. 11.1 ) видно, что переход бесструктурной системы в структурированную коагуляционную является обратимым. В то же время переход структурированной жидкообразной системы в твердообразную необратим. Следует отметить, что самопроизвольный переход бесструктурной жидкой системы в твердообразную может осуществляться очень медленно. Например, в течение геологических эпох в природе протекает процесс:
3.6.3. СТРУКТУРНО-МЕХАНИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ Возникновение структур и их характер обычно определяют, измеряя механические свойства систем: вязкость упругость, пластичность, прочность. Поскольку эти свойства связаны со структурой, их называют структурно-механическими. Структурно-механические свойства систем исследуют методами реологии. Реология - наука о деформациях и течении материальных систем. Она изучает механические свойства систем по проявлению деформации под действием внешних напряжений. Термин деформация означает относительное смещение точек системы, при котором не нарушается ее сплошность. Внешнее напряжение - есть не что иное, как давление Р. В механике сплошных сред доказывается, что в случае несжимаемых материалов, каковыми являются большинство дисперсных систем, все виды деформации (растяжение, сжатие, кручение и др.) можно свести к основной - деформации сдвига под действием напряжения сдвига Р ( Изучая структурно-механические свойства дисперсных систем, можно определить, образуется ли в системе структура и каков ее характер. СВОБОДНОДИСПЕРСНЫЕ (БЕССТРУКТУРНЫЕ) СИСТЕМЫ Агрегативно устойчивые золи (бесструктурные системы) подчиняются законам Ньютона, Пуазейля и Эйнштейна. Закон Ньютона устанавливает связь между скоростью деформации и напряжением сдвига:
где Р - напряжение сдвига, поддерживающее течение жидкости, Па; - деформация (течение) жидкости; Уравнение (11.1) представляет собой уравнение прямой, представленной на рис. 11.2 . Вязкость - величина постоянная, не зависящая от Р. Закон Пуазейля выражает зависимость объема жидкости, протекающей через трубу или капилляр, от давления:
где Q - расход жидкости в единицу времени; Р - давление в трубе; К - константа, определяемая геометрическими параметрами трубы или капилляра Закон Эйнштейна устанавливает зависимость вязкости бесструктурной жидкой дисперсной системы от концентрации дисперсной фазы:
Таким образом, относительное приращение вязкости прямо пропорционально относительному содержанию дисперсной фазы. Чем больше , тем сильнее выражено тор мозящее влияние частиц, тем больше вязкость. Расчеты проведенные Эйнштейном, показали, что для сферических частиц = 2,5, для частиц другой формы > 2,5. Жидкости, подчиняющиеся рассмотренным законам, называются ньютоновыми жидкостями. ЖИДКООБРАЗНЫЕ СТРУКТУРИРОВАННЫЕ СИСТЕМЫ При наличии структуры взаимодействием между частицами дисперсной фазы нельзя пренебречь. Прилагаемое напряжение сдвига не только заставляет жидкость течь, но и может разрушать существующую в ней структуру. Это неизбежно должно приводить к нарушению пропорциональности между прилагаемым напряжением Р и скоростью деформации , вязкость системы становится величиной, зависящей от Р. Следовательно, для таких жидкостей законы Ньютона, Пуазейля и Эйнштейна не выполняются. Такие жидкости называются неньютоновыми жидкостями. Для описания связи между скоростью деформации и прилагаемым напряжением сдвига Р обычно используют эмпирическое уравнение Оствальда-Вейля:
где k и n - постоянные, характеризующие данную жидкообразную систему. При n = 1 и k = уравнение (11.4) превратится в уравнение Ньютона. Таким образом, отклонение величины n от единицы характеризует степень отклонения свойств неньютоновых жидкостей от ньютоновых. При n < 1 ньютоновская вязкость уменьшается с увеличением напряжения и скорости сдвига. Такие жидкости называются псевдопластическими. При n > 1 ньютоновская вязкость жидкости увеличивается при увеличении напряжения и скорости сдвига. Такие жидкости называются дилатантными. На рис. 11.5 представлена кривая течения псевдопластической жидкости. На кривой имеются три характерных участка. На участке I (ОА) система ведет себя подобно ньютоновой жидкости с большой вязкостью Ползучесть - это медленное течение с постоянной вязкостью без прогрессирующего разрушения структуры. Для слабоструктурированных систем участок I обычно небольшой и его практически невозможно обнаружить. Для сильноструктурированных систем область значений Р, при которых наблюдается ползучесть, может быть весьма значительной. Напряжение РК соответствует началу разрушения структуры. На участке II (АВ) зависимость от Р теряет линейный характер, при этом вязкость уменьшается. Это уменьшение связано с разрушением структуры. В точке В структура практически полностью разрушена. Напряжение, отвечающее этой точке, называется предельным напряжением сдвига Напряжение называется пределом текучести - это минимальное напряжение сдвига, при котором ползучесть системы переходит в течение. Чем прочнее структура, тем выше предел текучести. Расход жидкости в единицу времени Q, протекающей через трубу при Р < можно рассчитать по уравнению Бингама:
где Прочность структуры оценивается не только пределом текучести, но и разностью ТВЕРДООБРАЗНЫЕ СТРУКТУРИРОВАННЫЕ СИСТЕМЫ На рис. 11.6 изображена кривая течения твердообразной структурированной системы. Сравнивая эту кривую с аналогичной кривой для жидкообразной структурированной системы (см. рис. 11.5), видим, что на первой кривой появился горизонтальный участок IV, совпадающий с осью абсцисс. Он заканчивается при достижении давления, равного PS, называемого статическим предельным напряжением сдвига. При Р < PS система не только не течет, но и не проявляет свойств ползучести, При Р > PS кривая течения твердообразной системы аналогична кривой течения жидко-образной системы, рассмотренной выше. Для твердообразных упруго-пластичных тел В упругохрупких телах течение не наблюдается, так как напряжение, при котором происходит хрупкий разрыв, достигается раньше, чем предел текучести. ЗАКЛЮЧЕНИЕ Свойства дисперсных систем зависят от концентрации частиц дисперсной фазы. В разбавленных золях расстояния между частицами сравнительно велики и взаимодействием между ними можно пренебречь. Такие системы являются свободнодисперсными (бесструктурными). При увеличении концентрации дисперсной фазы между частицами возникают контакты, образуется структура. Структурированные коллоидные системы делятся на коагуляционные и конденсационно-кристаллизационные. Коагуляционные структуры - гели, в которых частицы дисперсной фазы разделены прослойками дисперсионной среды, образуются за счет ван-дер-ваальсовых сил и обладают малой прочностью. Для этих структур характерны свойства тиксотропии и синерезиса. При определенных условиях гели могут превращаться в золи. Конденсационно-кристаллизационные структуры образуются за счет непосредственного химического взаимодействия между частицами, характерны для связнодисперсных систем с твердой дисперсионной средой и придают им твердость и хрупкость. Превращение коагуляционных структур в конденсационно-кристаллизационные является процессом необратимым. Структурированные системы обладают способностью деформироваться под влиянием механических нагрузок, а в некоторых случаях происходит их течение. Изучение таких систем с целью выявления наличия структуры и ее характера осуществляется методами реологии - науки о Деформациях и течении материальных систем. Бесструктурные системы, жидкообразные коагуляционные и твердообразные системы различаются по структурно-механическим свойствам (вязкости, упругости, прочности и пластичности). Бесструктурные коллоидные системы, подобно чистым жидкостям, подчиняются законам Ньютона, Пуазейля и Эйнштейна. Они обладают постоянной вязкостью, не зависящей от приложенных нагрузок. Они называются ньютоновыми жидкостями. Жидкообразные структурированные системы называются неньтоновыми жидкостями - их течение не подчиняется закону Ньютона, а вязкость зависит от напряжения сдвига. При некотором напряжении сдвига, называемом предельным, происходит полное разрушение структуры и система течет подобно ньютоновой жидкости, при этом вязкость системы становится минимальной. Твердообразные структурированные системы характеризуются наличием первого (статического) предельного напряжения сдвига, до достижения которого жидкость не течет и не проявляет свойства ползучести. Для многих твердообразных тел разрушение структуры происходит при напряжениях, меньших предела текучести. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие структурированные системы называются коагуляционными? За счет каких сил они образуются? 2. В чем состоят особенности конденсационно-кристаллизационных структур? 3. Какие свойства называются тиксотропией и синерезисом? 4. Какие свойства относятся к структурно-механическим? Почему они так называются? 5. Какие зависимости изучает реология? 6. Какие жидкости называются ньютоновыми? Каким законам они подчиняются? 7. Какие участки имеются на кривых течения жидкообразных систем? 8. Какое явление называется ползучестью? Для каких систем это явление наблюдается? 9. В чем состоят особенности течения твердообразных систем? 10. Что можно сказать о влиянии скорости сдвига на ньютоновскую вязкость для разных систем? Закончив изучение главы 11, вы должны знать: причины структурообразования в дисперсных системах; виды структурированных дисперсных систем, их особенности; основные структурно-механические свойства разных систем. 4. ЧАСТЬ ТРЕТЬЯ. ЛИОФИЛЬНЫЕ СИСТЕМЫ Большинство дисперсных систем являются лиофобными. Для них характерны: • гетерогенность, наличие четко выраженной межфазной границы; • высокая степень раздробленности дисперсной фазы; • процесс диспергирования является несамопроизвольным, требует затраты энергии; • наличие избытка свободной поверхностной энергии, что обусловливает стремление к коагуляции. Свойства лиофобных систем были подробно рассмотрены в предыдущих главах. Теперь мы переходим к рассмотрению лиофильных систем, свойства которых принципиально отличаются от свойств лиофобных систем, а именно: • образование этих систем происходит самопроизвольно, часто с выделением энергии; • имеет место сильное межмолекулярное взаимодействие между частицами дисперсной фазы и дисперсионной средой. Межфазовое поверхностное натяжение очень мало, а межфазовая граница размыта; • системы являются термодинамически устойчивыми, что означает постоянство во времени концентрации размеров частиц. К лиофильным системам относятся: • коллоидные поверхностно-активные вещества (ПАВ); • растворы высокомолекулярных соединений (BMС). 4.1. ГЛАВА 12. КОЛЛОИДНЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА О поверхностно-активных веществах шла речь в связи с адсорбцией молекул на поверхности жидкого раствора (глава 3). Вспомним определение ПАВ: ПАВ - это вещества, добавление которых в гетерогенную систему уменьшает поверхностное натяжение на границе раздела фаз. При этом во всем интервале концентраций вплоть до насыщенного раствора ПАВ находятся в молекулярно-дисперсном состоянии, т.е. системы являются гомогенными. При удлинении углеводородной цепи до 8-10 атомов углерода возникает новое свойство - способность молекул ПАВ объединяться в агрегаты, содержащие десятки молекул и называемые мицеллами. При малых концентрациях эти ПАВ образуют истинные растворы. При увеличении концентрации раствора до определенной величины, называемой критической концентрацией мицеллообразования (ККМ), в растворе наряду с молекулами ПАВ присутствуют мицеллы, т.е. появляется новая фаза. Такие системы характеризуются двумя свойствами: высокой дисперсностью и гетерогенностью, т.е. обладают свойствами коллоидных растворов. Коллоидные ПАВ - это вещества, которые не только снижают поверхностное натяжение на границе раздела фаз, но при определенных концентрациях способны к произвольному мицеллообразованию, т.е. к образованию новой фазы. Отличие коллоидных ПАВ от обычных заключается в длине углеводородного радикала. 4.1.1. КЛАССИФИКАЦИЯ КОЛЛОИДНЫХ ПАВ Эту классификацию можно представить следующей схемой (см. рис. 12.1 ). Анионные ПАВ - ПАВ, которые диссоциируют в воде с образованием поверхностно-активного аниона. Анионные ПАВ составляют большую часть мирового производства всех ПАВ. К ним относятся: а) карбоновые кислоты (RCOOH) и их соли (мыла) (RCOОM где М - металл); например, б) алкилсульфаты в) алкиларилсульфонаты г) вещества, содержащие другие типы поверхностно-активных анионов, например фосфаты, тиосульфаты. В качестве ПАВ широкое практическое применение получили соли синтетических жирных кислот фракции В кислых средах соли карбоновых кислот переходят в слабодиссоциированные и малорастворимые кислоты, а в присутствии некоторых катионов (кальция, магния) образуют нерастворимые соли, что резко снижает эффективность их действия как ПАВ, особенно ухудшает их моющее действие. Большими преимуществами в этом отношении обладают алкилсульфаты и алкилсульфонаты, которые являются солями сильных кислот и поэтому могут быть использованы в кислых и солевых растворах. Здесь уместно вспомнить о стиральных порошках, пригодных для стирки в жесткой и морской воде. Катионные ПАВ - это ПАВ, которые в водном растворе диссоциируют с образованием поверхностно-активного катиона. К катионным ПАВ относятся: а) соли первичных, вторичных и третичных алифатических и ароматических аминов; б) соли алкилзамещенных аммониевых оснований: в) пиридиновые соединения. Катионные ПАВ наиболее токсичны и наименее биологически разлагаемые из всех ПАВ. Их часто используют в качестве бактерицидных, фунгицидных, дезинфицирующих веществ, ингибиторов коррозии. Амфолитные ПАВ - это ПАВ, содержащие две функциональные группы, одна из которых имеет кислотный характер, а другая основной. В зависимости от среды такое соединение может диссоциировать и как кислота, и как основание. Например, аминокислоты:
Неионогенные ПАВ - ПАВ, которые в растворах не распадаются на ионы, это соединения, полученные на основе окиси этилена
В молекулах неионогенных ПАВ углеводородный радикал может содержать от 6 до 18 углеродных атомов, а n может изменяться от нескольких единиц до 100. Неионогенные ПАВ являются смесью гомологов с различной длиной полиоксиэтиленовой цепи. Полиоксиэтиленовая цепь определяет гидрофильные свойства неионогенных ПАВ. 4.1.2. СВОЙСТВА ВОДНЫХ РАСТВОРОВ ПАВ Отметим три основных свойства водных растворов ПАВ: 1. Способность значительно снижать поверхностное натяжение на границе раздела фаз. 2. Способность к самопроизвольному мицеллообразованию. 3. Солюбилизация. СПОСОБНОСТЬ ПАВ СНИЖАТЬ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ НА ГРАНИЦЕ РАЗДЕЛА ФАЗ Эта способность обусловлена высокой поверхностной активностью ПАВ: При большой длине углеводородных радикалов, когда заметно проявляется взаимодействие между молекулами ПАВ на поверхности, поверхностная активность увеличивается медленнее, чем это следует из правила Дюкло-Траубе. Поверхностную активность коллоидных ПАВ (g) можно приближенно оценить так:
где - поверхностное натяжение воды; Поверхностная активность ПАВ (g) непосредствен определяет адсорбционную способность ПАВ: чем она больше, тем больше адсорбционная способность. Адсорбируясь на частицах дисперсной фазы, молекулы ПАВ создают на их поверхности адсорбционно-сольватные защитные оболочки, которые из-за соответствующей ориентации молекул ПАВ ("хвостом" или "головкой") значительно снижают поверхностное натяжение и препятствуют слипанию или слиянию частиц (рис. 12.2 ). Моющее действие коллоидных ПАВ основано на совокупности коллоидно-химических процессов. 1. В присутствии ПАВ вследствие уменьшения поверхностного натяжения улучшается смачивание твердой поверхности, жидкость лучше проникает в тонкие капилляры ткани. 2. Молекулы мыла, адсорбируясь на поверхности волокна и частицах твердых или жидких загрязнений, создают адсорбционный слой, что обусловливает возникновение расклинивающего давления. Это способствует отрыву частиц и переходу в моющую жидкость. 3. Адсорбционные пленки на поверхности частиц загрязнений придают этим частицам высокую агрегативную устойчивость и предупреждают их прилипание к поверхности волокна в другом месте. 4. В присутствии коллоидных ПАВ в растворе образуется пена, которая способствует механическому уносу частиц загрязнений от поверхности. 5. Масляные загрязнения удерживаются в водной среде вследствие солюбилизации, о которой речь пойдет дальше. Важной количественной характеристикой ПАВ являются гидрофильно-липофильный баланс (ГЛБ). Числа ГЛБ характеризуют соотношение между гидрофильными свойствами: чем выше число ГЛБ, тем больше баланс сдвинут в сторону гидрофильных (полярных) свойств ПАВ. Числа ГЛБ определяются экспериментально. Работами Дэвиса установлена количественная зависимость ГЛБ от состава и структуры ПАВ. Каждая структурная единица вносит свой вклад в число ГЛБ. Числа ГЛБ по Гриффину составляют: для гидрофильных групп: -СООК - 21,1; -СООNa - 19,1; -СООН - 2,4; -ОН - 1,9; =О - 1,3; для гидрофобных =СН-; На основании этих данных числа ГЛБ можно рассчитывать по уравнению:
где Физический смысл эмпирических чисел ГЛБ состоит в том, что они определяют отношение работы адсорбции молекул ПАВ на границе раздела фазы "масло" к работе адсорбции на той же границе с фазой "вода". В зависимости от числа ГЛБ ПАВ используются для той или иной цели. Так, если ПАВ имеют числа ГЛБ от 7 до 9, их используют в качестве смачивателей, от 13 до 15 - в качестве моющих средств, от 15 до 16 - в качестве солюбилизаторов в водных растворах. СПОСОБНОСТЬ К САМОПРОИЗВОЛЬНОМУ МИЦЕЛЛООБРАЗОВАНИЮ Критическая концентрация мицеллообразования ККМ лежит обычно в пределах
Мицелла лиофильного золя - это ассоциат дифильных молекул, лиофильные группы которых обращены к растворителю, а лиофобные группы соединяются друг с другом, образуя ядро. На рис. 12.3 схематически изображена мицелла Гартли. Такая ориентация дифильных молекул в мицелле обеспечивает минимальное поверхностное натяжение границе "мицелла - дисперсионная среда". Возникает вопрос - почему образование мицелл происходит самопроизвольно, ведь известно, что образование новой фазы всегда требует затраты энергии. Поскольку поверхностное натяжение на границе с дисперсионной средой минимально, энергия, затрачиваемая на образование мицеллы, невелика. Эта энергия с избытком компенсируется выигрышем энергии за счет выведения углеводородных хвостов молекул ПАВ в ядро мицеллы, которое, по сути дела, представляет собой жидкий углеводород, образовавшийся в результате плотной упаковки углеводородных цепей. Этот выигрыш составляет 1,08 kT (k - постоянная Больцмана, Т - температура), т.е. при Т = 298 К величину, равную 2,6 кДж на каждую . Таким образом, мицеллообразование сопровождается уменьшением свободной энергии системы. Диаметр мицеллы Гартли равен удвоенной длине молекулы ПАВ. Число молекул ПАВ, составляющих мицеллу, называется числом ассоциации n. Это число быстро растет в узком интервале концентраций ПАВ обычно от 20 до 100 (иногда и более). Для ионогенных ПАВ n увеличивается при понижении температуры и добавлении электролитов. Для неионогенных ПАВ повышение температуры приводит к увеличению n, а введение электролитов на число ассоциации не влияет. Сумма молекулярных масс всех молекул в мицелле называется мицеллярной массой. При достижении определенной концентрации сферические мицеллы начинают взаимодействовать между собой, что приводит к их деформации. Мицеллы стремятся принять цилиндрическую, дискообразную, палочкообразную, пластинчатую формы. Такие мицеллы называются мицеллами Мак-Бена. При концентрациях в 10-50 раз больших ККМ, мицеллы принимают цепочечную ориентацию и вместе с молекулами растворителя образуют жидкокристаллическую структуру. При дальнейшем увеличении концентрации ПАВ жидкокристаллическая структура переходит в гелеобразную, а затем в твердокристаллическую. В растворах ПАВ количество вещества в мицеллярной форме может во много раз превышать его количество в молекулярном состоянии. Эти формы находятся в равновесии, состояние которого зависит от концентрации:
СОЛЮБИЛИЗАЦИЯ Солюбилизацией называется явление растворения веществ в мицеллах ПАВ. Солюбилизация - самопроизвольный и обратимый процесс. В водных мицеллярных системах солюбилизируются вещества, не растворимые в воде, например, бензол, органические красители, жиры. Это обусловлено тем, что ядро мицеллы проявляет свойства неполярной жидкости. Солюбилизат - вещество, солюбилизированное раствором ПАВ. Солюбилизатор - ПАВ, которое солюбилизирует неполярную жидкость. Мольная солюбилизация (Sm) - количество солюбилизатора, отнесенное к 1 молю мицеллярного ПАВ. Способ включения молекул солюбилизата в мицеллы в водных растворах зависит от природы вещества. Неполярные углеводороды внедряются в мицеллы, располагаясь в углеводородных ядрах мицелл. Полярные органические вещества (спирты, амины, кислоты) встраиваются в мицеллу между молекулами ПАВ так, чтобы их полярные группы были обращены к воде, а липофильные части молекул ориентированы параллельно углеводородным радикалам ПАВ. Для неионогенных ПАВ характерен и третий способ включения солюбилизата в мицеллы: молекулы солюбилизата, например, фенола, не проникают внутрь мицеллы, а закрепляются на их поверхности, располагать между беспорядочно изогнутыми полиоксиэтиленовыми цепями. При солюбилизации неполярных углеводородов в ядрах мицелл углеводородные цепи раздвигаются, в результате размер мицелл увеличивается. Способность коллоидных ПАВ солюбилизировать углеводороды возрастает с ростом концентрации ПАВ. Солюбилизация в водных растворах ПАВ обычно увеличивается с повышением гидрофобности ПАВ и гидрофильности солюбилизата. Явление солюбилизации находит широкое применение в различных процессах, связанных с использованием ПАВ, отметим некоторые из них: • эмульсионная коагуляция; • изготовление эмульсионных смазочных жидкостей; • изготовление фармацевтических препаратов; • изготовление пищевых продуктов. Солюбилизация является важнейшим фактором моющего действия ПАВ. Она также входит, как одно из звеньев процесса обмена веществ, в жизнедеятельность живых организмов. 4.1.3. КРИТИЧЕСКАЯ КОНЦЕНТРАЦИЯ МИЦЕЛЛООБРАЗОВАНИЯ (ККМ) И ЕЕ ОПРЕДЕЛЕНИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ ККМ На величину ККМ влияют: • строение и длина углеводородной цепи; • характер полярной группы; • наличие в растворе индифферентных электролитов и неэлектролитов; • температура. Влияние двух первых факторов отражает формула
где а - постоянная, характеризующая энергию растворения полярной группы; b - постоянная, характеризующая энергию растворения, приходящуюся на одну группу ; n - число групп . Из уравнения (12.1) следует, что чем больше энергия растворения гидрофобной группы и чем больше число, тем меньше ККМ, т.е. тем легче образуется мицелла. Напротив, чем больше энергия растворения поляп группы, роль которой состоит в том, чтобы удерживать образующиеся ассоциаты в воде, тем больше ККМ. Величина ККМ ионогенных ПАВ значительно больше, чем неионогенных при одинаковой гидрофобности молекул. Введение электролитов в водные растворы неново генных ПАВ мало влияет на величину ККМ и размеры мицеллы. Введение электролитов в водные растворы ионогенных ПАВ оказывает весьма значительное влияние, которое можно оценить уравнением:
где а' и b' - постоянные, имеющие тот же физический смысл, что и а и b в уравнении 12.1; k - константа; с - концентрация индифферентного электролита. Из уравнения 12.2 следует, что увеличение концентрации индифферентного электролита (с) уменьшает ККМ. Введение неэлектролитов (органических растворителей) в водные растворы ПАВ тоже приводит к изменению ККМ. При наличии солюбилизации устойчивость мицелл повышается, т.е. уменьшается ККМ. Если солюбилизация не наблюдается (т.е. молекулы неэлектролита не входят внутрь мицеллы), то они, как правило, увеличивают ККМ. ВЛИЯНИЕ ТЕМПЕРАТУРЫ Влияние температуры на ККМ ионогенных ПАВ и неионогенных ПАВ различно. Повышение температуры приводит к увеличению ККМ ионогенного ПАВ из-за дезагрегирующего действия теплового движения. Повышение температуры приводит к уменьшению ККМ неионогенного ПАВ за счет дегидратации оксиэтиленовых цепочек (мы помним, что неионогенные ПАВ всегда образованы полиоксиэтиленовыми цепочками углеводородными "хвостами"). МЕТОДЫ ОПРЕДЕЛЕНИЯ КРИТИЧЕСКОЙ КОНЦЕНТРАЦИИ МИЦЕЛЛООБРАЗОВАНИЯ Методы определения ККМ основаны на регистрации резкого изменения физико-химических свойств растворов ПАВ при изменении концентрации. Это связано с тем, что образование мицеллы ПАВ в растворе означает появление в нем новой фазы, а это приводит к резкому изменению любого физико-химического свойства системы. На кривых зависимостей "свойство раствора ПАВ - концентрация ПАВ" появляется излом. При этом левая часть кривых (при более низких концентрациях) описывает соответствующее свойство раствора ПАВ в молекулярном (ионном) состоянии, а правая - в коллоидном. Абсциссу точки излома условно считают соответствующей переходу молекул (ионов) ПАВ в мицеллы - т.е. критической концентрацией мицеллообразования (ККМ). Рассмотрим некоторые из этих методов. КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ККМ Кондуктометрический метод основан на измерении электрической проводимости растворов ПАВ. Понятно, что его можно использовать только для ионогенных ПАВ. В области концентраций до ККМ зависимости удельной и эквивалентной электрической проводимости от концентрации ПАВ соответствуют аналогичным зависимостям для растворов средних по силе электролитов. При концентрации, соответствующей ККМ, на графиках зависимостей наблюдается излом, обусловленный образованием сферических мицелл. Подвижность ионных мицелл меньше подвижности ионов и, кроме того, значительная часть противоионов находится в плотном слое коллоидной частицы мицеллы и следовательно, существенно снижает электропроводность растворов ПАВ. Поэтому при увеличении концентрации ПАВ больше ККМ возрастание удельной электропроводности значительно ослабляется (рис. 12.4 ), а молярная электропроводность уменьшается резче (рис. 12.5 ). ОПРЕДЕЛЕНИЕ ККМ НА ОСНОВЕ ИЗМЕРЕНИЙ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ РАСТВОРОВ Поверхностное натяжение водных растворов ПАВ уменьшается с ростом концентрации вплоть до ККМ. Изотерма Измерение поверхностного натяжения позволяет определить ККМ как ионогенных, так и неионогенных ПАВ. Исследуемые ПАВ необходимо тщательно очищать от примесей, поскольку их присутствие может явиться причиной по явления минимума на изотерме при концентрациях, близких к ККМ. СПЕКТРОФОТОМЕТРИЧЕСКИЙ, ИЛИ ФОТОНЕФЕЛОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ККМ Солюбилизация красителей и углеводородов в мицеллах ПАВ позволяет определять ККМ ионогенных и неионогенных ПАВ как в водных, так и в неводных растворах. При достижении в растворе ПАВ концентрации, соответствующей ККМ, растворимость водонерастворимых красителей и углеводородов резко увеличивается. Наиболее удобно применять жирорастворимые красители, интенсивно окрашивающие растворы ПАВ при концентрациях выше ККМ. Солюбилизацию измеряют методом, основанным на светорассеянии, или спектрофотометрически. 4.1.4. ПРИМЕНЕНИЕ КОЛЛОИДНЫХ ПАВ ПАВ находят широкое применение в различных отраслях промышленности и в быту. Отметим лишь некоторые области их применения. 1. ПАВ являются основой синтетических моющих средств - детергентов. 2. ПАВ входят в состав различных смазочных жидкостей. 3. ПАВ являются стабилизаторами микрогетерогенных систем: суспензий, эмульсий, пен, порошков. 4. Явление солюбилизации используется для проведения полимеризации непредельных углеводородов в эмульсиях. 5. Мицеллярный катализ, т.е. проведение различных реакций, в растворе ПАВ выше ККМ. Правильный выбор ПАВ позволяет увеличить скорости реакций от пяти- до тысячекратного по сравнению со скоростью реакции без мицелл. 6. Высококонцентрированные растворы некоторых ПАВ формируют упорядоченные структуры - жидкие кристаллы, широко используемые в современной технике (дисплеи, электронные часы и т.д.). 7. ПАВ применяются в пищевой промышленности для интенсификации технологических процессов и улучшения качества продукции. ЗАКЛЮЧЕНИЕ Характерной особенностью строения ПАВ являете их дифильность - наличие у молекул полярной (гидрофильной) и неполярной (гидрофобной) частей. Именно дифильностью молекул обусловлена их склонность собираться на границе раздела фаз, погружая гидрофильную часть в воду и изолируя от воды гидрофобную, чем а обусловлена их поверхностная активность. Низкомолекулярные ПАВ - спирты, кислоты, другие органические соединения, молекулы которых имеют незначительную длину углеводородного радикала, в растворах находятся только в молекулярно-дисперсном состоянии. С увеличением длины гидрофобных цепей, когда число атомов углерода достигает 10-20, появляется новое свойство - способность молекул к ассоциации. При малых концентрациях эти ПАВ образуют истинные растворы. При увеличении концентрации до определенной величины образуется новая фаза - мицеллы Гартли, система становится гетерогенной. Самопроизвольное соединение молекул ПАВ с образованием сферических мицелл, содержащих несколько десятков молекул и имеющих мицеллярную массу 10000-20000 а. е. м, происходит благодаря силам межмолекулярного притяжения между углеводородными цепями. В системе устанавливается равновесие между истинным раствором и мицеллами - образуется лиофильный коллоидный раствор. Концентрация, при которой начинается образование мицелл, называется критической концентрацией мицеллообразования (ККМ). В результате мицеллообразования неполярные цепи образуют как бы углеводородную каплю, экранированную обращенными в воду полярными группами. Такое состояние соответствует минимуму свободной энергии. Размеры мицелл ограничиваются силами электростатического отталкивания между ионогенными группами. Диаметр мицеллы приблизительно равен удвоенной длине молекулы. При дальнейшем увеличении концентрации происходит взаимодействие между сферическими мицеллами образованием дискообразных, цилиндрических, пластинчатых мицелл и, наконец, жидких кристаллов. Критическая концентрация мицеллообразования зависит от строения и длины углеводородного радикала, природы полярной группы, наличия в растворе электролитов и температуры. Величины ККМ определяют экспериментально, изучая зависимость физико-химических свойств растворов (электрической проводимости, поверхностного натяжения, светорассеяния или светопоглощения) от концентрации ПАВ. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Что общего и в чем состоит различие между низкомолекулярными и коллоидными ПАВ? 2. Какова структура мицеллы Гартли? 3. Что называется критической концентрацией мицеллообразования? 4. Что характеризует величина ГЛБ? 5. Чем объяснить, что процесс мицеллообразования является самопроизвольным? 6. Какое явление называется солюбилизацией? 7. На чем основано моющее действие коллоидных ПАВ? 8. Каково практическое значение коллоидных ПАВ? 9. Какие процессы происходят в растворах коллоидных ПАВ по мере увеличения концентрации? Закончив изучение главы 6, вы должны знать: • классификацию коллоидных ПАВ; • влияние различных факторов на величину ККМ; • сущность физико-химических методов определения ККМ. 4.2. ГЛАВА 13. РАСТВОРЫ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ (ВМС) Высокомолекулярными соединениями называются вещества, имеющие молекулярную массу от 10000 до нескольких миллионов а. е. м. Размеры молекул ВМС в вытянутом состоянии могут достигать 1000 нм, т.е. соизмеримы с размерами частиц в коллоидных растворах и микрогетерогенных системах. Температура кипения ВМС значительно выше температуры разложения, поэтому они существуют, как правило, только в жидком или твердом состоянии. 4.2.1. КЛАССИФИКАЦИЯ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ ВМС классифицируют по различным признакам: 1. По происхождению ВМС делятся на натуральные (природные) и синтетические. Натуральные ВМС - белки (казеин, желатин, яичный альбумин), шерсть, шелк, полисахариды (целлюлоза, крахмал). Полисахариды - это полимерные углеводы
Синтетические ВМС - ВМС, получаемые в результате химического синтеза. В качестве исходных веществ для получения полимеров используют низкомолекулярные ненасыщенные или полифункциональные соединения - мономеры. Методы синтеза основаны на следующих типах реакций: • полимеризация - соединение молекул мономера с образованием макромолекул, по элементному составу не отличающихся от исходного мономера, например: • поликонденсация - соединение молекул мономера, сопровождающееся выделением низкомолекулярных веществ:
• сополимеризация - соединение двух или нескольких мономеров разного состава. Степенью полимеризации n называется число повторяющихся звеньев в макромолекуле. Любой реальный синтетический полимер состоит из макромолекул разной степени полимеризации и характеризуется полидисперсностью. 2. По строению полимерной цепи высокомолекулярные соединения бывают: линейными, разветвленными и пространственными. Линейные полимеры, образуются в тех случаях, когда молекулы мономера бифункциональны, причем при росте полимерной цепи функциональность не меняется, например Пространственные полимеры образуются, когда Функциональность мономера больше двух и в процессе роста цепи функциональность макромолекулы увеличивается. Пространственные полимеры менее эластичны, обладают большей твердостью, менее растворимы, но способны набухать. Примером могут служить фенолформальдегидные смолы. Разветвленные полимеры, подобно пространственным, получаются из мономеров с функциональностью больше двух. При определенных условиях в ходе синтеза образуются боковые ответвления от основной цепи. Разветвленные полимеры имеют свойства, промежуточные между линейными и пространственными полимерами. Примером может служить крахмал. 3. По способности к электролитической диссоциации ВМС делятся на неэлектролиты и полиэлектролиты. В свою очередь полиэлектролиты подразделяют на поликислоты, полиоснования и полиамфолиты. 4.2.2. ОСНОВНЫЕ ОСОБЕННОСТИ СТРОЕНИЯ ПОЛИМЕРОВ Отметим две особенности. 1. Существование двух типов связи: химические связи, соединяющие атомы в полимерной цепи (энергия связи порядка десятков и сотен кДж/моль); межмолекулярные силы Ван-дер-Ваальса, связывающие между собой макромолекулярные цепи и звенья, водородные связи (энергия связи порядка единиц и десятков кДж/моль). 2. Гибкость цепей, обусловленная внутренним вращением звеньев. Благодаря этому макромолекула может принимать различные конформации. Конфортациями называют пространственные энергетически неравноценные формы макромолекул, возникающие в результате вращения звеньев вокруг химических связей (без их разрыва). В результате конформационных изменений макромолекулы могут принимать различную форму: линейную, клубка, глобул. Глобула - это частица, образованная из скрученной макромолекулы, в которой осуществляется связь между сходными звеньями. Конформации и различны состояния макромолекул объясняются стремлением самопроизвольному уменьшению энергии Гиббса, которое происходит при условии: Таким образом, конформация представляет собой пространственную форму макромолекул, соответствующую максимуму энтропии. 4.2.3. ВЗАИМОДЕЙСТВИЕ ВМС С РАСТВОРИТЕЛЕМ При взаимодействии ВМС с растворителем происходит их набухание. Набуханием называется увеличение объема и массы полимера во времени при контакте с растворителем. При набухании объем и масса полимера могут увеличиться в 10-15 раз. Количественной мерой набухания является степень набухания:
где Набухание может быть ограниченным и неограниченным. В случае ограниченного набухания m и а достигают постоянных при данной температуре и концентрации предельных значений Причина набухания состоит в различии свойств ВМС и растворителя. Молекулы ВМС отличаются от молекул НМС на несколько порядков по размерам и по подвижности. Поэтому переход макромолекул в фазу растворителя происходит очень медленно, в то время как молекулы растворителя быстро проникают в сетку полимера, раздвигая цепи и увеличивая его объем. Гибкость цепей облегчает проникновение малых молекул НМС в сетку полимера. Итак, процесс набухания представляет собой одностороннее смешение, обусловленное большим различием в размерах молекул. Следует подчеркнуть, что набухание - это не просто механическое вхождение молекул НМС в пустоты полимера, а межмолекулярное взаимодействие, обусловленное, главным образом, сольватацией макромолекул. Поэтому процесс набухания всегда специфичен: полимер набухает не в любом, а лишь в "хорошем" растворителе с которым он взаимодействует. Так, полярные полимеры набухают в полярных жидкостях, например, белки в воде, а неполярные - в неполярных (каучук в бензоле). Ограниченность процесса набухания и возможность самопроизвольного растворения определяются соотношением между энергией решетки полимера и энергией сольватации с учетом энтропийного эффекта. Так, линейные полимеры обычно неограниченно набухают в "хороших" растворителях, особенно при повышенных температурах, так как работа раздвижения макромолекул в них меньше энергии сольватации. Пространственные полимеры набухают ограниченно, так как растворение их потребовало бы разрыва химических связей, образующих пространственную структуру, а на такой разрыв энергии сольватации недостаточно. Полимеры, сшитые короткими мостичными связями, как правило, вообще не набухают. Так, натуральный каучук (линейный полимер) неограниченно набухает в бензоле, вулканизированный каучук (пространственная структура) ограниченно набухает в бензоле, а эбонит (сшитый вулканизированный каучук) совсем не набухает. Введение в полимер полярных групп уменьшает степень набухания в неполярных растворителях и увеличивает - в полярных. Процесс набухания идет самопроизвольно, т.е. при Р и Т = const
Следует выделить две стадии набухания: 1. Происходит сольватация макромолекул, при это выделяется теплота, т.е.
Итак, первая стадия обусловлена энтальпийным фактором. 2. Теплота сольватации не выделяется
Таким образом, вторая стадия набухания обусловлена энтропийным фактором. Набухание может закончиться растворением полимера, в этом случае говорят о неограниченном набухании. Ограниченно набухший полимер называется студнем (см. следующую главу). 4.2.4. СВОЙСТВА РАСТВОРОВ ВМС Растворение ВМС является самопроизвольным процессом и приводит к уменьшению свободной энергии системы; если растворение происходит при постоянных давлении и температуре, Так как растворение ВМС сопровождается уменьшением свободной энергии, растворы ВМС являются термодинамически устойчивыми и не требуют присутствия стабилизаторов. Более того, растворы ВМС сами часто используются как стабилизаторы. Растворы ВМС представляют собой истинные растворы, состоящие из отдельных очень больших молекул, по размерам часто превосходящих коллоидные частицы. Указанные свойства отличают растворы ВМС от коллоидных растворов. Вместе с тем, следует отметить, что в "плохих" растворителях молекулы ВМС свертываются в компактные клубки, при этом возникает межфазная поверхность, т.е. система становится гетерогенной. Также в концентрированных растворах вследствие межмолекулярного взаимодействия возникают ассоциаты молекул, которые можно рассматривать как зародыши второй фазы. Растворы ВМС, подобно коллоидным растворам, способны рассеивать падающий свет и также избирательно поглощать световые лучи. 4.2.5. ПОЛИЭЛЕКТРОЛИТЫ Полиэлектролитами называются ВМС, способные в растворе диссоциировать с образованием высокомолекулярного иона. В зависимости от природы содержащихся в полимере групп полиэлектролиты можно разделить на три вида: 1) полиэлектролиты, содержащие кислотную группу, например, 2) полиэлектролиты, содержащие основную группу, например 3) полиэлектролиты, содержащие одновременно как кислотную, так и основную группы (полиамфолиты). Сюда относятся белки, содержащие группы Все высокомолекулярные электролиты растворяются в полярных растворителях. Важнейшими представителями полиэлектролитов являются белки. Молекулы белков построены на основе аминокислот и содержат основные группы
где R - достаточно длинный углеводородный радикал. Следует отметить, что ионогенные группы могут располагаться не только на концах макромолекулы, но и в виде коротких боковых цепей, распределенных по всей длине макромолекулы. В кислой среде (НСl) подавлена ионизация карбоксильных групп, белок ведет себя как слабое основание:
Молекула приобретает положительный заряд. Так как между одноименно заряженными группами, разбросанными по всей длине молекулы, действуют силы отталкивания, цепная молекула белка в кислой среде будет стремиться развернуться. Однако при большом избытке HCl из-за наличия большого количества хлорид-ионов степень ионизации соединения В щелочной среде (NaOH) из-за большого количества гидроксид-ионов, ионизация групп - подавлена и белок ведет себя как слабая кислота:
приобретая отрицательный заряд. И в этом случае цепная молекула стремится развернуться вследствие электростатического отталкивания групп При большом избытке щелочи из-за большого количества ионов Таким образом, как в кислой, так и в щелочной среде молекулы белка обладают нескомпенсированным зарядом разного знака. Регулируя рН белкового раствора, можно добиться перевода белка в изоэлектрическое состояние. Изоэлектрическим состоянием белка называется состояние белковой молекулы, при котором ее положительные и отрицательные заряды взаимно скомпенсированы. Молекулу белка в изоэлектрическом состоянии можно считать нейтральной, хотя в ней имеются ионизированные группы. Условно молекулу белка в изоэлектрическом состоянии можно изобразить так: Изоэлектрическая точка белка (ИТБ) - это значение рН, при котором белок переходит в изоэлектрическое состояние. Так как белок обычно является более сильной кислотой, чем основанием, его ИТБ лежит при рН < 7. Иначе говоря, для достижения изоэлектрического состояния в растворе должен находиться некоторый избыток кислоты, для подавления ионизации кислотных групп. Так как в ИТБ число ионизированных основных и кислотных групп одинаково, гибкая макромолекула сворачивается в клубок. На форму макромолекул влияет не только рН среды, но и введение в раствор индифферентного электролита. Небольшое количество электролита подавляет ионизацию ионогенных групп и приводит к тому, что форма макц10 молекул приближается к наиболее статистически вероятным конформациям. При больших концентрациях электролитов происходит высаливание вследствие уменьшения растворимости полимера - макромолекулы образуют плотные клубки. Действие ионов на полиэлектролиты изменяется в том порядке, в котором они стоят в лиотропном ряду. ЗАКЛЮЧЕНИЕ Макромолекулы ВМС представляют собой гигантские образования, состоящие из сотен и тысяч атомов, химически связанных между собой. Все ВМС по происхождению можно разделить на природные, образующиеся при биохимическом синтезе, и синтетические, получаемые искусственно путем полимеризации или поликонденсации. В зависимости от строения полимерной цепи ВМС делятся на линейные, разветвленные и пространственные. Подобно истинным растворам низкомолекулярных веществ растворы ВМС образуются самопроизвольно и являются термодинамически устойчивыми. В этом состоит их отличие от лиофобных коллоидных систем. Термодинамическая устойчивость обусловлена благоприятным соотношением энтальпийного и энтропийного факторов. ВМС обладают рядом свойств, характерных для дисперсных систем: они способны образовывать ассоциаты, размер которых соизмерим с размерами частиц золей (1-100 нм), рассеивают свет, способствуют образованию эмульсий, суспензий и пен, для них характерны диффузия и броуновское движение. В то же время, в отличие от лиофобных золей в растворах ВМС отсутствует гетерогенность, т.е. нет большой межфазной поверхности. Специфическим свойством, присущим только BMU является набухание при взаимодействии с растворителем. Набухание может быть ограниченным и неограниченным. Последнее приводит к растворению полимера. Существует большое количество ВМС, которые в Р створе диссоциируют с образованием высокомолекулярных ионов, они называются полиэлектролитами. В зависимости от природы полимерных групп полиэлектролиты могут быть катионными, анионными и амфотерными. Последние содержат в своем составе одновременно кислотные и основные группы. В зависимости от рН среды они диссоциируют как кислоты или как основания. Состояние, при котором положительные и отрицательные заряды в молекуле белка скомпенсированы, называется изоэлектрическим, а значение рН, при котором молекула переходит в изоэлектрическое состояние, называется изоэлектрической точкой белка (ИТБ). ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие соединения называются высокомолекулярными? 2. Как их можно классифицировать по происхождению, по строению молекул? 3. В чем состоят сходство и различия между растворами низкомолекулярных и высокомолекулярных соединений? 4. Почему растворы ВМС являются термодинамически устойчивыми? 5. В чем состоят сходство и различия между растворами ВМС и коллоидными растворами? 6. Какой процесс называется набуханием, и какой величиной оно характеризуется? 7. В чем состоят особенности ограниченного и неограниченного набухания? 8. Как изменяются энтальпия, энтропия и свободная энергия Гиббса при набухании? 9. Какие ВМС называются полиэлектролитами? 10. На какие группы делятся полиэлектролиты? 11. Каково строение молекулы белка? 12. Как диссоциирует молекула белка в кислой и щелочной среде? 13. Что называется изоэлектрической точкой белка? Закончив изучение главы 13, вы должны знать: особенности растворов ВМС, их сходство и различия с растворами низкомолекулярных веществ и золей; характер диссоциации разных типов полиэлектролитов в водных растворах. 4.3. ГЛАВА 14. СТУДНИ. СТУДНЕОБРАЗОВАНИЕ В главе 11 мы рассматривали явление структурообразования в агрегативно неустойчивых системах - золях. Образующиеся при этом структурированные системы называются гелями. Структурообразование происходит также и в системах, содержащих высокомолекулярные соединения. При этом образуются структурированные системы, называемые студнями. Процесс образования студней - студнеобразование - есть не что иное, как процесс появления и постепенного упрочнения в застудневающей системе пространственной сетки. Свойства студней во многом сходны со свойствами гелей. Однако имеются и принципиальные различия. 1. Причина застудневания состоит в возникновении связей между отдельными макромолекулами ВМС. Поэтому студни следует рассматривать как гомогенные системы. Гели же образуются в результате взаимодействия коллоидных частиц, поэтому являются системами гетерогенными. 2. В гелях пространственная сетка образуется за счет ван-дер-ваальсовых сил, в студнях - за счет гораздо более прочных химических и водородных связей. 3. Связи в студнях возникают не только на концах макромолекул, но и между любыми их участками, где имеются группы, способные взаимодействовать между собой. Это, конечно, приводит к различным структурно-механическим свойствам. 4.3.1. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОЦЕСС СТУДНЕОБРАЗОВАНИЯ Выше отмечалось, что студни образуются при ограниченном набухании твердых ВМС. Примером может служить набухание желатина в воде. Вместе с тем, студнеобразование может происходить в истинных растворах ВМС. На этот процесс влияют следующие факторы: концентрация ВМС в растворе; форма и размер молекул ВМС; температура; время; присутствие индифферентных электролитов; рН среды. ВЛИЯНИЕ КОНЦЕНТРАЦИИ ВМС Застудневанию растворов ВМС всегда способствует повышение концентрации раствора, так как при этом возрастает частота столкновений между макромолекулами или их участками и увеличивается количество связей, образующихся в единице объема. ВЛИЯНИЕ ФОРМЫ И РАЗМЕРА МАКРОМОЛЕКУЛ Макромолекулы не только имеют большие размеры, но, и это очень важно, обладают гибкостью полимерных цепей, которая обеспечивает способность принимать большое число конформаций: от абсолютно растянутого состояния до тугого клубка. Естественно, число связей, которые образует данная макромолекула с другими, зависит от формы молекулы: чем более она распрямлена, тем легче доступ к тем ее частям, которые могут вступать во взаимодействие. Следовательно, для студнеобразования необходимы условия, при которых макромолекула не свертывается в клубок. Макромолекулы, имеющие вытянутую форму, образуют студни даже в очень разбавленных растворах. Так, агар-агар образует студень при содержании 0,1%, а желатин - 0,5% сухого вещества. В морских медузах, представляющих собой "живой" студень, количество воды доходит до 99%. ВЛИЯНИЕ ТЕМПЕРАТУРЫ Повышение температуры, если только при этом в теме не происходит необратимых химических изменений, обычно препятствует застудневанию из-за возрастания интенсивности теплового движения сегментов и уменьшения вследствие этого числа и длительности существования связей между макромолекулами. При изменении температуры может происходить самопроизвольное застудневание истинного раствора ВМС. Так 30%-й водный раствор желатина застудневает при температуре 30С более разбавленный 10% -й раствор требует для застудневания более низкой температуры - 22С. Следует заметить, что переход раствора ВМС в студень при изменении температуры происходит непрерывно, т.е. в этом случае нет постоянной температуры перехода, как это имеет место, например, при кристаллизации или плавлении. ВЛИЯНИЕ ВРЕМЕНИ Так как процесс застудневания есть не что иное, как процесс появления и постепенного упрочнения пространственной сетки время, безусловно, играет положительную роль. Однако не следует думать, что процесс застудневания будет происходить в любом растворе и при любых условиях, если его проводить в течение длительного времени - необходимо выполнение и других условий. Однако если студень получают в результате ограниченного набухания сухого ВМС, то в зависимости от природы полимера и растворителя требуется совершенно определенное время. Так, для набухания желатина в холодной воде требуется 35-40 мин. ВЛИЯНИЕ ИНДИФФЕРЕНТНЫХ ЭЛЕКТРОЛИТОВ Действие электролитов на застудневание растворов белков противоположно действию этих электролитов на набухание. Ионы, увеличивающие набухание, замедляю застудневание или делают его невозможным. Наоборот, ионы, уменьшающие объем набухшего студня, способствуют застудневанию. Как и на набухание, на застудневание в основном влияют анионы. ВЛИЯНИЕ рН Влияние рН особенно заметно, если ВМС является амфотерным, например белок. Застудневание идет лучше всего при значении рН, отвечающем изоэлектрической точке, так как при этом по всей длине молекулярной цепи расположено одинаковое число противоположно заряженных ионизированных групп, что способствует возникновению связей между отдельными макромолекулами. С изменением рН (в обоих направлениях от изоэлектрической точки) макромолекулы приобретают одноименные заряды, что препятствует образованию связей. При добавлении больших количеств кислоты или основания степень ионизации уменьшается и тенденция к застудневанию снова увеличивается. 4.3.2. СВОЙСТВА СТУДНЕЙ Студни и гели обладают свойствами как твердых тел, так и жидкостей. Как твердым телам, им присуще такие механические свойства, как упругость, прочность, эластичность, способность сохранять определенную форму. В отличие от гелей большинство студней не тиксотропны. Это связано с тем, что в студнях пространственная сетка образована прочными химическими или водородными связями. Если эти связи окажутся разорванными в результате механического воздействия, то они не восстановятся, так как в местах разрыва изменится состав вследствие взаимодействия с растворителем. В некоторой степени тиксотропия может наблюдаться только у тех студней, для которых характерна малая прочность связей между макромолекулами. В студнях содержится большое количество воды, потому они проявляют некоторые свойства жидкостей, в частности, низкомолекулярные вещества, высокодисперсные золи, а также растворы ВМС с небольшими молекулами способны диффундировать в студни. Для студней характерен синерезис - постепенное сжатие пространственной сетки с выделением жидкости. Жидкость, заполняющую сетку студня, часто называют интермицеллярной, ее можно разделить на свободную, которая механически включена в каркас студня и не входит в сольватную оболочку, и связанную. Количество связанной воды в студне зависит от степени гидрофильности макромолекулы: чем больше количество гидрофильных групп, тем больше связанной воды в студне. Связанная вода обладает особыми свойствами: большой плотностью, пониженной температурой замерзания и т.д. Связанная вода студней играет большую роль - ее присутствие в почве, растениях, во всех живых организмах обеспечивает морозоустойчивость, поддерживает "водные запасы", определяет морфологические структуры клеток и тканей. В человеческом организме доля связанной воды у младенцев составляет примерно 70%, а у пожилых людей - до 40%, что обусловливает появление морщин, дряблость кожи и т.д. Синерезис, таким образом, в человеческом организме идет достаточно медленно и его скорость индивидуальна. Следует отметить, что при синерезисе вначале выделяется свободная вода, а затем, частично, связанная. Электрическая проводимость студней близка к проводимости растворов, из которых они получены. Студни, подобно золям и растворам ВМС, рассеивают падающий свет. Студни обладают таким удивительным свойством, как "память". Если высушить при низкой температуре до одного и того же содержания влаги два студня, один из которых был получен из разбавленного, а другой из концентрированного раствора желатина, а затем дать им снова набухнуть в воде, то первый студень набухнет гораздо больше, чем второй. Причина этого явления состоит в том, что при высушивании до известной степени в студнях сохраняется внутренняя структура, возникшая при их образовании. Изучив главу 14, вы должны знать: факторы, от которых зависит процесс застудневания; свойства студней. 5. ЧАСТЬ ЧЕТВЕРТАЯ. МИКРОГЕТЕРОГЕННЫЕ СИСТЕМЫ 5.1. ГЛАВА 15. СУСПЕНЗИИ Суспензии - это дисперсные системы, в которых дисперсной фазой являются частицы твердого вещества размером более Условно суспензии обозначают в виде дроби: Т/Ж, в числителе которой указывается агрегатное состояние фазы, а в знаменателе - агрегатное состояние среды. Можно дать суспензиям и другое определение: суспензии - это взвеси порошков в жидкостях. Данное определение, являясь менее формальным, чем первое, ближе к реальной жизни уже потому, что сам термин "суспензия" (suspensio) в переводе с позднелатинского означает "подвешивание". Формально суспензии от лиозолей (коллоидных растворов) отличаются только размерами частиц дисперсной фазы. Размеры твердых частиц в суспензиях (более см) могут быть на несколько порядков больше, чем в лиозолях ( см). Это количественное различие обусловливает чрезвычайно важную особенность суспензий: в большинстве суспензий частички твердой фазы не участвуют в броуновском движении. Поэтому свойства суспензий существенно отличаются от свойств коллоидных растворов; их рассматривают как самостоятельный вид дисперсных систем. Рассматривая в дальнейшем конкретные свойства суспензий, полезно сопоставлять их с аналогичными свойствами коллоидных растворов, которые изучались в предыдущих разделах коллоидной химии. 5.1.1. КЛАССИФИКАЦИЯ СУСПЕНЗИЙ Суспензии разделяются по нескольким признакам. 1. По природе дисперсионной среды: органосуспензии (дисперсионная среда - органическая жидкость) и водные суспензии. 2. По размерам частиц дисперсной фазы: грубые суспензии 3. По концентрации частиц дисперсной фазы: разбавные суспензии (взвеси) и концентрированные суспензии (пасты). В разбавленных суспензиях частицы свободно перемещаются в жидкости, сцепление между частицами отсутствует и каждая частица кинетически независима. Разбавленные суспензии - это свободнодисперсные бесструктурные системы. В концентрированных суспензиях (пастах) между частицами действуют силы, приводящие к образованию определенной структуры (пространственной сетки). Таким образом, концентрированные суспензии - это связнодисперсные структурированные системы. Конкретные значения концентрационного интервала, в котором начинается структурообразование, индивидуальны и зависят, в первую очередь, от природы фаз, формы частиц дисперсной фазы, температуры, механических воздействий. Более подробно этот вопрос будет рассмотрен в разделе, посвященном свойствам концентрированных суспензий. Здесь же мы только отметим, что механические свойства разбавленных суспензий определяются, главным образом, свойствами дисперсионной среды, а механические свойства связнодисперсных систем определяются, кроме того, свойствами дисперсной фазы и числом контактов между частицами. 5.1.2. МЕТОДЫ ПОЛУЧЕНИЯ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ Суспензии, так же как и любую другую дисперсную систему, можно получить двумя группами методов: со стороны грубодисперсных систем - диспергационными методами, со стороны истинных растворов - конденсационными методами. Рассматривая конкретные методы получения суспензий, полезно вспомнить, что суспензии - это взвеси порошков в жидкости. Следовательно, наиболее простым и широко распространенным как в промышленности так и в быту методом получения разбавленных суспензий является взбалтывание соответствующего порошка в подходящей жидкости с использованием различных перемешивающих устройств (мешалок, миксеров и т.д.). Для получения концентрированных суспензий (паст) соответствующие порошки растирают с небольшим количеством жидкости. Так как суспензии отличаются от лиозолей только тем, что частицы в них на несколько порядков больше все методы, которые используются для получения лиозолей, можно применять и для получения суспензий. При этом необходимо, чтобы степень измельчения диспергационными методами была меньше, чем при получении лиозолей. При конденсационных методах конденсацию необходимо проводить так, чтобы образовывались частицы, имеющие размеры При этом должны соблюдаться условия, ограничивающие возможности значительного разрастания и сцепления частиц дисперсной фазы. Дисперсность образующихся суспензий можно регулировать также введением ПАВ. Суспензии очищают от примесей растворенных веществ диализом, электродиализом, фильтрованием, центрифугированием. Суспензии образуются также в результате коагуляции лиозолей. Следовательно, способы осуществления коагуляции - это одновременно и методы получения суспензий. Все вышесказанное касалось промышленных и бытовых суспензий. Природные суспензии (а ими являются практически все водоемы Земли) образуются вследствие попадания в воду твердых частиц в результате разрушения аэрозолей, а также при диспергировании почв, грунтов и скальных пород под воздействием сил прибоя, приливно-отливных явлений, при движении ледников. 5.1.3. СВОЙСТВА РАЗБАВЛЕННЫХ СУСПЕНЗИЙ Отсутствие структуры в разбавленных суспензиях и наличие ее в концентрированных обусловливает резкое различие в свойствах этих систем. Остановимся на рассмотрении свойств разбавленных суспензий. Мы уже отмечали, что количественно разбавленные суспензии отличаются от лиозолей размерами частиц дисперсной фазы:
К каким же качественным изменениям в свойствах это приводит? Попытаемся в этом разобраться. ОПТИЧЕСКИЕ СВОЙСТВА РАЗБАВЛЕННЫХ СУСПЕНЗИЙ Длины волн видимой части спектра лежат в пределах от см (фиолетовый свет) до см (красный свет). Световая волна, проходя через суспензию, может поглощаться (тогда суспензия окрашена), отражаться от поверхности частиц дисперсной фазы по законам геометрической оптики (тогда суспензия выглядит как мутная) и только в высокодисперсных суспензиях - мутях ( В оптический микроскоп видны частицы, размер которых не менее см, что соответствует большинству разбавленных суспензий. ЭЛЕКТРОКИНЕТИЧЕСКИЕ СВОЙСТВА ВОДНЫХ СУСПЕНЗИЙ Электрокинетические свойства суспензий подобны аналогичным свойствам гидрозолей и обусловлены образованием на поверхности частиц дисперсной фазы двойного электрического слоя и возникновением электрокинетического потенциала. Величина дзета-потенциала в суспензиях такого же порядка, что и в золях: суспензия кварца - -44 мВ, суспензия глины - -49 мВ, суспензия плавленого корунда Измерить величину дзета-потенциала в суспензиях можно электроосмотическим способом, наблюдая за объемной скоростью передвижения жидкой дисперсионной среды через неподвижную диафрагму, приготовленную из порошка, получившегося в результате седиментации данной суспензии (обычно такую диафрагму получают центрифугированием суспензии). Использование для определения дзета-потенциала частиц в суспензии электрофореза, как принято в случае аэрозолей, затруднено тем, что крупные частицы суспензий будут не столько передвигаться к электроду, сколько оседать под действием силы тяжести. Однако в суспензиях проявляются все четыре вида электрокинетических явлений, наблюдаемых в лиофобных золях: электрофорез, электроосмос, потенциал течения, потенциал седиментации. Более того, явление электрофореза было впервые описано профессором Московского университета в 1809 году Рейссом именно на примере суспензии глины, а явление электроосмоса - на примере суспензии кварца, которой являлась диафрагма из кварцевого песка. Одна из важнейших областей применения электрокинетических явлений - нанесение покрытий на различные поверхности электрофоретическим методом. Данный метод, обеспечивающий высокую кроющую способность, позволяет получать равномерные покрытия на деталях сложной конфигурации. При электрофоретическом методе нанесения покрытий одним из электродов служит деталь, на которой формируется покрытие, другим - емкость с суспензией, дисперсная фаза которой наносится на поверхность детали. После того как на электроде сформируется покрытие, как правило, возникает электроосмос, в результате которого жидкость выходит из слоя покрытия и оно становится более плотным. В нашей стране успешно эксплуатируются автоматические линии грунтовки кузовов автомобилей электрофоретическим методом. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА РАЗБАВЛЕННЫХ СУСПЕНЗИЙ Размеры частиц в суспензиях охватывают довольно большой интервал: Для суспензий, размеры частиц в которых
где На этих суспензиях сильно сказываются конвекционные тепловые потоки, которые препятствуют оседанию и установлению равновесия. В суспензиях, размеры частиц которых лежат в пределах от
где - вязкость среды. Если измерить , то можно определить радиус частицы (r):
Этот подход лежит в основе седиментационного анализа суспензий и порошков. Подробное описание седиментационного анализа дано ниже. 5.1.4. СЕДИМЕНТАЦИОННАЯ УСТОЙЧИВОСТЬ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ Седиментационная устойчивость суспензии - это способность ее сохранять неизменным во времени распределение частиц по объему системы, т.е. способность системы противостоять действию силы тяжести. Так как большинство суспензий оказываются полидисперсными системами, содержащими и относительно крупные частицы, которые не могут участвовать в броуновском движении, суспензии являются седиментационно (кинетически) неустойчивыми системами. Если плотность частиц меньше плотности дисперсионной среды, то они всплывают, а если больше - оседают. Изучение седиментации суспензий связано, в первую очередь, с получением кривых накопления осадка (кривых седиментации) m = f(t). Кривые накопления могут быть двух видов: с перегибом или без перегиба. Установлено, что вид кривых седиментации зависит от того, является ли седиментирующая суспензия агрегативно устойчивой или нет. Если седиментация сопровождается укрупнением частиц, а следовательно, увеличением скорости их оседания, то на кривых седиментации появляется точка перегиба. Если же суспензия агрегативно устойчива (нет коагуляции), то на кривой седиментации перегиб отсутствует. Характер осадков, полученных в том другом случаях, также различен. В агрегативно устойчивых суспензиях оседание частиц происходит медленно и формируется очень плотный осадок. Объясняется это тем, что поверхностные слои препятствуют агрегированию частиц; скользя друг по другу, частицы могут перейти в положение с минимальной потенциальной энергией, т.е. с образованием упаковки, близкой к плотнейшей. В этом случае расстояние между близкими и координационное число (число соседних частиц) в осадке такой седиментирующей, но предельно стабилизированной суспензии, определяется соотношением между: силой тяжести; межмолекулярным притяжением частиц; силами отталкивания между частицами, обеспечивающими агрегативную устойчивость суспензии. В агрегативно неустойчивых суспензиях оседание частиц происходит значительно быстрее вследствие образования агрегатов. Однако выделяющийся осадок занимает гораздо больший объем, так как частицы сохраняют то случайное взаимное расположение, в котором они оказались при первом же контакте, силы сцепления между ними соизмеримы с их силой тяжести или больше ее. Наблюдается анизометрия (т.е. преобладание одного из размеров частицы над двумя другими) образующихся агрегатов или флокул. Исследования показывают, что наиболее вероятны цепочечные и спиральные первоначальные агрегаты, из которых затем получаются осадки большого седиментационного объема. Различие седиментационных объемов агрегативно устойчивых и неустойчивых систем наиболее четко проявляется, если частицы имеют средние размеры. Если частицы крупные, то, несмотря на то, что суспензия агрегатизно неустойчивая, осадок получается более плотным из-за значительной силы тяжести, зачастую преобладающей над силами сцепления между частицами. Если же частицы очень мелкие, то и в агрегативно устойчивой системе из-за малой силы тяжести образуется чрезвычайно подвижный осадок. 5.1.5. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ Агрегативная устойчивость суспензии - это способен сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность. Агрегативная устойчивость разбавленных суспензий весьма сходна с агрегативной устойчивостью лиофобных золей. Но суспензии являются более агрегативно устойчивыми системами, так как содержат более крупные частицы и, следовательно, имеют меньшую свободную поверхностную энергию. При нарушении агрегативной устойчивости суспензии происходит коагуляция - слипание частиц дисперсной фазы. Коагуляция - это самопроизвольный процесс, так как сопровождается уменьшением свободной энергии системы за счет уменьшения межфазной поверхности Этот процесс аналогичен тому, который происходит в лиозолях, более того, коагуляция лиозолей приводит к образованию суспензий и далее может продолжаться в них, приводя к образованию осадка. Этот осадок часто является концентрированной суспензией (пастой), т.е. структурированной системой, свойства которой будут рассматриваться в отдельном разделе. Для достижения агрегативной устойчивости суспензии необходимо выполнение по крайней мере одного из двух условий: • смачиваемость поверхности частиц дисперсной фазы дисперсионной средой; • наличие стабилизатора. Первое условие. Если частицы суспензии хорошо смачиваются дисперсионной средой, то на их поверхности образуется сольватная оболочка, обладающая упругими свойствами и препятствующая соединению частиц в крупные агрегаты. Хорошая смачиваемость частиц наблюдается в суспензиях полярных частиц в полярных жидкостях и неполярных частиц в неполярных жидкостях. Примером агрегативно устойчивых суспензий без стабилизатора с сольватационным механизмом устойчивости являются суспензии кварца в воде и сажи в бензоле. Так как кварц хорошо смачивается водой, а сажа - бензолом, эти суспензии агрегативно устойчивы без третьего компонента - стабилизатора. Если заменить дисперсионную среду, исключая тем самым смачивание (например, размешать порошок сажи в воде), то получается агрегативно неустойчивая система - частицы сажи водой не смачиваются, гидратная оболочка не образуется и незащищенные частички легко соединяются друг с другом. Второе условие. Если частицы суспензии не смачиваются или плохо смачиваются дисперсионной средой, то используют стабилизатор. Стабилизатор - это вещество, добавление которого в дисперсную систему повышает ее агрегативную устойчивость, т.е. препятствует слипанию частиц. В качестве стабилизаторов суспензий применяют: низкомолекулярные электролиты; коллоидные ПАВ; ВМС. Механизм их стабилизирующего действия различен, в зависимости от природы стабилизатора реализуется один, чаще несколько факторов устойчивости, аналогично TOMV, как это происходит в лиофобных золях. Отметим возможные факторы устойчивости: адсорбционно-сольватный, электростатический, структурно-механический, энтропийный, гидродинамический. Если стабилизатор является ионогенным веществом (распадается в растворе на ионы), то обязательно действует электростатический фактор устойчивости: на поверхности частиц образуется двойной электрический слой, возникает электрокинетический потенциал и соответствующие электростатические силы отталкивания, препятствующие слипанию частиц. Электростатическое отталкивание частиц описано теорией ДЛФО (см. раздел 3.5.4). Если это ионогенное вещество - низкомолекулярный неорганический электролит, то его стабилизирующее действие ограничивается только этим фактором. Если же ионогенное вещество - коллоидное ПАВ или полиэлектролит, то реализуются и другие факторы устойчивости, рассмотрим их подробнее. СТАБИЛИЗИРУЮЩЕЕ ДЕЙСТВИЕ КОЛЛОИДНЫХ ПАВ Стабилизирующее действие коллоидных ПАВ определятся их способностью адсорбироваться на межфазной поверхности, образуя адсорбционные пленки. Вследствие высокой поверхностной активности концентрация ПАВ в поверхностном слое в десятки тысяч раз превышает объемную концентрацию, поэтому в адсорбционных пленках; так же как и в мицеллах ПАВ, происходит ассоциация неполярных групп. Строение адсорбционного слоя зависит от: • природы ПАВ; • природы межфазной поверхности (границы: "твердая частица - жидкая среда"); • степени заполнения поверхности; • наличия в дисперсионной среде различных добавок. Изменение строения адсорбционного слоя отражается на его защитных свойствах. Коллоидное ПАВ, имея дифильное строение, способно адсорбироваться как на полярных, так и на неполярных поверхностях, лиофилизируя их. В соответствии с правилом уравнивания полярностей Ребиндера стабилизирующее действие ПАВ проявляется тем заметнее, чем больше первоначальная разница в полярностях твердой частицы и жидкой дисперсионной среды. Таким образом, при использовании в качестве стабилизатора коллоидного ПАВ реализуется адсорбционно-сольватный фактор устойчивости. Например, чтобы получить суспензию сажи в воде (рис 15.1 ), используют олеат натрия, который неполярным углеводородным радикалом адсорбируется на частицах сажи, а полярная группа, направленная в сторону воды, ею гидратируется и тем самым поверхность частицы становится смачиваемой водой (гидрофилизируется), суспензия стабилизируется. Аналогичный процесс мы проводим, когда моем руки, загрязненные сажей, или моем посуду после жирной пищи. Олеат натрия можно использовать и для стабилизации суспензии силикагеля () в бензоле (неполярная жидкость) (рис. 15.2 ). В этом случае олеат натрия будет адсорбироваться на поверхности твердой частицы своей полярной группой, направляя углеводородный радикал в сторону бензола. Тем самым поверхность силикагеля становится гидрофобной, бензол ее смачивает, и суспензия стабилизируется. Но лучший стабилизирующий эффект достигается при более специфическом выборе ПАВ. Подбор ПАВ для стабилизации суспензий различного типа сходен с подбором ПАВ для стабилизации прямых и обратных эмульсий. Если необходимо стабилизировать суспензию полярных частиц в неполярной жидкости, то используется коллоидное ПАВ с низкими значениями чисел ГЛБ, обычно 3-6, т.е. малорастворимые в воде, известны случаи стабилизации ПАВ с 30 атомами углерода в цепи. В пищевой промышленности для этих целей используются липоиды (лецитин), ланолин и т.д. Если необходимо стабилизировать суспензию неполярных частиц в полярной жидкости, то применяются коллоидные ПАВ с высокими значениями чисел ГЛБ, обычно 8-13, т.е. достаточно хорошо растворимые в воде, такие соединения содержат 10-18 атомов углерода в цепи. Максимум стабилизирующих свойств наблюдается у ПАВ с 14-16 атомами углерода (так называемый максимум Донана). В пищевой промышленности для этих целей часто используют пропиловый спирт, соли высших карбоновых кислот и т.д. СТАБИЛИЗИРУЮЩЕЕ ДЕЙСТВИЕ ВМС И ПОЛИЭЛЕКТРОЛИТОВ Строго говоря, в качестве стабилизаторов дисперсных систем, в том числе и суспензий, можно использовать только такие ВМС, которые являются поверхностно-активными веществами и их надо было бы называть поверхностно-активными высокомолекулярными веществами (ПАВМС или ВМПАВ). Чтобы оказать защитное действие, молекулам полимера необходимо адсорбироваться на поверхности частицы, а это может произойти только в том случае, если при этом уменьшится поверхностное натяжение на границе раздела фаз. Эти вещества отличаются от коллоидных ПАВ тем, что для них характерно возникновение структурно-механического фактора устойчивости. Таким образом, если в качестве стабилизатора применяются ВМС, то механизм их действия аналогичен механизму коллоидной защиты лиофобных золей: адсорбция молекул полимера на твердых частицах приводит к возникновению защитной оболочки, обладающей механической прочностью и упругостью, причем отмечено, что адсорбция ВМС является необратимой. Для этого вокруг частицы должен существовать избыток макромолекул, необходимый для образования насыщенного монослоя и даже полислоя. Электронномикроскопические снимки непосредственно доказали наличие таких защитных оболочек. Например, адсорбционные слои метилцеллюлозы на частицах полистирола имеют толщину 70-100 Если в качестве ВМС используются полиэлектролиты, то к этим двум факторам добавляется и третий - электростатический фактор устойчивости. Полиэлектролиты-стабилизаторы применяются для водных суспензий, т.е. для стабилизации гидрофобных частиц в полярных жидкостях. Наиболее распространенные водорастворимые полиэлектролиты - это белковые вещества, альгинаты, карбоксиметилцеллюлоза, алкилполиамин и т.д. СЕНСИБИЛИЗАЦИЯ При использовании ВМС в качестве стабилизаторов суспензий надо помнить о таком явлении как сенсибилизация. Сенсибилизация - явление уменьшения агрегативной устойчивости системы при добавлении высокомолекулярных соединений. Ранее это явление рассматривалось в отношении лиофобных золей, но оно характерно и для суспензии. Сенсибилизация, как правило, обнаруживается при малом держании макромолекул в дисперсионной среде и объясняется образованием между отдельными частицами мостиков стабилизатора. В суспензиях каолина и полистирола возникновение мостиков доказано электронномикроскопическими исследованиями: концентрациям метилцеллюлозы до 1-2% от веса твердой фазы обычно отвечает неустойчивое, а выше 4% - устойчивое состояние суспензии. Таким образом, решающее влияние на защитное действие макромолекул оказывает соотношение между количеством полимера и удельной поверхностью частиц. Для стабилизации суспензии полистирола необходима поверхностная концентрация метилцеллюлозы В заключение можно сказать, что агрегативная устойчивость суспензий в сильной степени зависит от специфического взаимодействия макромолекул с поверхностью частиц дисперсной фазы. Следовательно, выбор БМС для стабилизации суспензии носит, во многом, эмпирический характер. 5.1.6. МЕТОДЫ РАЗРУШЕНИЯ РАЗБАВЛЕННЫХ СУСПЕНЗИЙ Задача разрушения суспензий является весьма насущной, так как сточные воды промышленных и сельскохозяйственных предприятий, а также бытовые стоки - это, в той или иной степени, разбавленные суспензии. Следовательно, очистка сточных вод от твердых частиц - это разрушение суспензий. Существует множество методов разрушения суспензий. МЕХАНИЧЕСКИЕ МЕТОДЫ РАЗРУШЕНИЯ СУСПЕНЗИЙ Они основаны на отделении вещества дисперсной фазы от дисперсионной среды, возможном благодаря седиментационной неустойчивости суспензии. Для этого используют различные устройства: отстойники, фильтры, центрифуги. Механические методы разрушения используются, как правило, на завершающем этапе, когда агрегативная устойчивость суспензий уже отсутствует или значительно снижена. ТЕРМИЧЕСКИЕ МЕТОДЫ РАЗРУШЕНИЯ СУСПЕНЗИЙ Они основаны на изменении температуры суспензии. Их можно свести к двум типам: 1) замораживание суспензий с последующим их отталкиванием; 2) высушивание суспензий (по сути, их концентрирование). Эти методы требуют больших энергетических затрат и как правило, не используются в промышленных масштабах, когда требуется разрушить большие объемы суспензий. ХИМИЧЕСКИЕ МЕТОДЫ РАЗРУШЕНИЯ СУСПЕНЗИЙ Эти методы основаны на использовании химических реагентов, поэтому их часто называют реагентными методами разрушения суспензий. Химическое действие реагентов может быть различным, но цель добавления химических реагентов одна - понизить агрегативную устойчивость суспензии, т.е. уничтожить потенциальный барьер коагуляции. В зависимости от факторов устойчивости, которые реализовывались в данной суспензии, и стабилизаторов, которые в ней присутствовали, подбирают необходимые химические реагенты. Для эффективного разрушения суспензии надо предварительно выяснить ее фактор устойчивости. Если главный фактор устойчивости суспензии - электростатический, т.е. обусловлен наличием на поверхности твердой частицы ДЭС и дзета-потенциала (суспензия стабилизирована низкомолекулярным неорганическим электролитом), то необходимо использовать химические реагенты, уменьшающие абсолютное значение дзета-потенциала частицы вплоть до нуля. В качестве таких химических реагентов используются индифферентные электролиты. Кстати сказать, плодородные дельты больших рек - Тигра, Евфрата, Нила, Волги и т.д. - возникли в результате того, что частички плодородных почв и ила, присутствовашие в речной воде в виде суспензии, при встрече с соленой водой морей и океанов (содержавшей ионы Если в суспензии в качестве стабилизатора использовалось коллоидное ПАВ, т.е. реализовывался адсорбционно-сольватный фактор устойчивости, то химический реагент должен его снизить. Действовать можно в двух направлениях: 1) изменить химическую природу стабилизатора; например, из растворимого в воде олеата натрия получить нерастворимый олеат кальция:
2) не изменяя химической природы стабилизатора, изменить строение адсорбционного слоя. Например, уменьшить смачиваемость частицы дисперсионной средой, образуя на ней второй слой молекул ПАВ, противоположно ориентированных. Если суспензия стабилизирована амфолитным полиэлектролитом, то эффективным является приближение рН-среды к его изоэлектрической точке. Для разрушения суспензий, частицы которых имеют заряд, широко используется гетерокоагуляция - слипание разнородных частиц. Если в исходной суспензии частицы были положительно заряжены, то в нее полезно добавить многозарядные анионы (в виде хорошо растворимых солей). В том случае, когда в исходной суспензии присутствуют только отрицательно заряженные частицы дисперсной фазы, эффективным является добавление солей алюминия или железа, например, сульфата алюминия или хлорида железа. В результате гидролиза этих солей образуются положительно заряженные золи гидроксидов алюминия или железа, которые вызывают взаимную коагуляцию взвешенных отрицательных частиц суспензии. Весьма эффективно применение коагулянтов с повышенной основностью, например, гидроксосульфатов и гидроксохлоридов железа и алюминия. Они проявляются в виде полимерных гидроксокомплексов, которые дают прочные крупные хлопья. Наиболее оптимальными являются смеси этих солей. В процессе гидролиза коагулянта образуются положительно заряженные полиядерные аквагидроксокомплексы металла, которые слипаются с отрицательно заряженными частицами суспензии. Из хлорсодержащих соединений алюминия наиб шее распространение получили хлорид алюминия и гидроксохлориды алюминия. Гидроксохлориды алюминия соединения переменного состава, которые выражаются общей формулой В настоящее время преимущественно используется пентагидроксохлорид алюминия Эффективным методом понижения агрегативной устойчивости суспензий является сенсибилизация. Для этого обычно используются флокулянты - линейные полимеры с длиной цепочки до 1 мк, несущие полярные группы на обоих концах цепи. Длинная молекула полимера присоединяется двумя концами к двум разным частицам дисперсной фазы, скрепляя их углеводородным мостиком. Образуются флокулы - рыхлый хлопьевидный осадок. Частицы различного происхождения имеют различное распределение зарядов, гидрофильных и гидрофобных областей на поверхности. Вследствие этого не представляется возможным применение некоего универсального полимерного флокулянта, необходим набор флокулянтов. Полиакриламид, ПВС, ПДМДА являются наиболее широко применяемыми флокулянтами, выпускаемыми отечественной промышленностью. Из зарубежных флокулянтов, имеющих доступ на российский рынок, высокими флокулирующими свойствами обладают японские санфлоки: N-520p, АН-70р, AS-310p, Al-310р, Аl-110р, СН-799. Необходимая концентрация флокулянта в суспензии зависит от концентрации в ней взвешенных частиц. Количество флокулянта должно составлять 0,01-2% от массы твердой фазы. В противном случае может быть достигнут обратный эффект - произойдет коллоидная защита взвешенных частиц. Способ внесения полимера существенно сказывается на результатах коагуляции суспензии. Установлено, что лучше всего флокулянт добавлять дробно в виде двойной добавки, т.е. вся доза флокулянта первоначально добавляется к половине объема суспензии, а через некоторое время этот раствор сливается со второй половиной исходной суспензии. ЭЛЕКТРИЧЕСКИЕ МЕТОДЫ РАЗРУШЕНИЯ СУСПЕНЗИИ Эти методы используются в тех случаях, когда частицы в суспензиях имеют заряд, т.е. стабилизированы ионогенными веществами. В разрушаемой суспензии создается разность потенциалов, приводящая к направленному движению заряженных частиц и осаждению их на соответствующем электроде. Эти методы требуют больших энергетических затрат и специального оборудования и обычно не используются для разрушения больших объемов суспензий. 5.1.7. ПАСТЫ Пасты - это высококонцентрированные суспензии, обладающие структурой. Структура - это пространственная сетка, образованная частицами дисперсной фазы, в петлях которой находится дисперсионная среда. Можно сказать, что пасты занимают промежуточное положение между порошками и разбавленными суспензиями. Их и получают, соответственно: растирая порошок в жидкости, обладающей достаточно большой вязкостью; например, некоторые сорта зубной пасты готовят путем смешивания мела с вязкой жидкостью, полученной путем варки крахмала в глицериновом водном растворе с добавлением небольшого количества ПАВ; в результате седиментации разбавленной суспензии. СТРУКТУРООБРАЗОВАНИЕ В ВЫСОКОКОНЦЕНТРИРОВАННЫХ СУСПЕНЗИЯХ Определяющей характеристикой пасты, независимо от метода получения, является наличие в ней структурно-пространственного каркаса, образованного сцеплением между собой частиц дисперсной фазы. Минимальную концентрацию, при которой возникает такая структура, называют критической концентрацией структуробразования. Возможность образования структуры определяется соотношением между относительной силой тяжести частицы На структурообразование влияют следующие основные факторы: • агрегативная устойчивость разбавленной суспензии, из которой получают пасту (величина • концентрация частиц дисперсной фазы; • размеры частиц дисперсной фазы (ее дисперсность); • форма частиц дисперсной фазы. РОЛЬ АГРЕГАТИВНОЙ УСТОЙЧИВОСТИ СУСПЕНЗИИ В ОБРАЗОВАНИИ СТРУКТУРЫ Как было установлено выше, разбавленные суспензии являются седиментационно неустойчивыми системами, в них самопроизвольно образуется осадок, объем которого определяется не только количеством частиц, но и тем, в какой суспензии происходит седиментация - в агрегативно устойчивой или агрегативно неустойчивой. В агрегативно устойчивых суспензиях в результате седиментации образуется компактный осадок с упаковкой частиц дисперсной фазы, близкой к плотнейшей. Структура в таких осадках или не образуется вовсе или очень непрочная, так как (сила сцепления в контакте частиц) близка к нулю, поскольку межчастичные связи в агрегативно устойчивых суспензиях практически отсутствуют. По мере снижения агрегативной устойчивости межчастичные взаимодействия нарастают, увеличивается, что способствует возникновению и упрочнению структуры. Обычно структуру в системе количественно оцени ют с помощью реологических кривых - зависимости рости деформации () от напряжения сдвига (Р). Подробнее см. раздел 3.6.3. РОЛЬ КОНЦЕНТРАЦИИ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫ СУСПЕНЗИИ В ОБРАЗОВАНИИ СТРУКТУРЫ Зависимость структурообразования от концентрации суспензии имеет сложный характер. Весь концентрационный интервал делится на три части, разграничивающие качественно различные состояния системы, В области малых концентраций (1-я часть) суспензия является бесструктурной. В области средних концентраций, но меньших, чем критическая концентрация структурообразования (2-я часть), появляются отдельные структурные элементы (агрегаты), не связанные между собой. Такую систему можно назвать структурированной жидкообразной системой ( ВЛИЯНИЕ РАЗМЕРОВ ЧАСТИЦ (СТЕПЕНИ ДИСПЕРСНОСТИ) НА СТРУКТУРООБРАЗОВАНИЕ В СУСПЕНЗИЯХ Увеличение дисперсности суспензии способствует структурообразованию. Этот процесс резко интенсифицируется с уменьшением размера частиц. И лишь при переходе в область размеров частиц коллоидной дисперсности по мере возрастания степени их участия в броуновском движении процессу структурирования начинает сопутствовать альтернативный - самопроизвольное диспергирование (дезагрегирование). Наибольший размер частиц, при котором возможно образование структуры, называется критическим ( ВЛИЯНИЕ ФОРМЫ ЧАСТИЦ НА СТРУКТУРООБРАЗОВАНИЕ В СУСПЕНЗИЯХ Если частицы анизометричны и имеют форму нитей (палочек), пластинок или цепочек, длина которых существенно превышает ширину и толщину, но абсолютное значение длины частиц весьма мало, сцепление части будет происходить по углам, ребрам и другим неровностям, на участках наибольшей концентрации свободных молекулярных сил, где происходит разрыв адсорбционно сольватных оболочек дисперсионной среды, необходимый для возникновения межчастичных связей. В основе образования этих структур лежит обычный коагуляционный механизм, но только места сосредоточения молекулярных сил должны быть распределены преимущественно по углам и ребрам частиц твердой фазы. Чем сильнее анизометрия частиц и агрегатов, тем при меньшей концентрации частиц появляется предел текучести (т.е. возникает структура), например, у суспензии кизельгура (мягкая пористая горная порода), частицы которого имеют вид пленкоподобных неправильных пластинок, предел текучести наблюдается уже при концентрации около 3,0% (об). Нитевидные молекулы органических полимеров, особенно с полярными группами, придающими жесткость макромолекулам, образуют твердообразные структуры в водной среде при очень малых концентрациях полимера (агар Таким образом, мы рассмотрели влияние на структурообразование каждого из четырех факторов по отдельности. Совместное их действие можно оценить по величине предельного напряжения сдвига (), рассчитанного по следующей приближенной зависимости:
где - коэффициент, учитывающий геометрию упаковки частиц, Из уравнения видно, что предельное напряжение сдвига () также как и вязкость системы, резко возрастает с уменьшением среднего характерного размера. Величина СВОЙСТВА ПАСТ Так как пасты - структурированные системы, определяющими являются их структурно-механические свойства, которые характеризуются такими параметрами, как вязкость, упругость, пластичность. Пасты обладают упруго-вязко-пластическими свойствами. Пасты имеют коагуляционную структуру, поэтому их механические свойства определяются, главным образом, механическими свойствами межчастичных жидких прослоек. Через эти прослойки действуют силы притяжения между частицами, зависящие от расстояния между ними (толщины прослоек) и обусловленные ван-дер-ваальсовыми и водородными связями. Прочность коагуляционного контакта составляет величину порядка Таким образом, механические свойства паст обусловливаются совокупностью двух различных основных причин: 1) молекулярным сцеплением частиц дисперсной фазы друг с другом в местах контакта, там где толщина прослоек дисперсионной среды между ними минимальна. В предельном случае возможен полный фазовый контакт. Коагуляционное взаимодействие частиц вызывает образование структур с выраженными обратимыми упругими свойствами; 2) наличием тончайшей пленки в местах контакта между частицами. Коагуляционные структуры отличаются резко выраженной зависимостью структурно-механических свойств от и интенсивности механических воздействий. Примером исключительной чувствительности структурно-механических свойств коагуляционных структур к механическим воздействиям является зависимость равновесной эффективной вязкости (р) от скорости деформации у или напряжения сдвига Р. Уровень (p) отвечает вполне определенной степе ни разрушения трехмерного структурного каркаса в уcловиях деформации системы. Диапазон изменений (р) = f(P) может достигать 9-11 десятичных порядков. Для паст, так же как и для любой коагуляционной структуры, характерны следующие свойства: невысокая механическая прочность (обусловлена малой прочностью коагуляционного контакта - порядка Н и ниже), тиксотропия, синерезис, ползучесть, пластичность, набухание (см. раздел 3.6.1). Рассмотрим наиболее типичные из этих свойств применительно к пастам. ТИКСОТРОПИЯ Восстановление структуры обычно контролируется по увеличению вязкости системы, поэтому явление тиксотропии можно определить как уменьшение вязкости системы во времени при наложении нагрузки и постепенный рост вязкости после снятия нагрузки. Чем медленнее восстанавливается структура (вязкость) после снятия нагрузки или чем медленнее она разрушается (уменьшается вязкость) при данном напряжении сдвига, тем сильнее выражено явление тиксотропии. Тиксотропия пасты имеет большое практическое значение. В подтверждение этого рассмотрим некоторые примеры. Тиксотропные свойства бентонитовых глин обусловливают применение глинистых суспензий как основного компонента буровых промывочных растворов в нефтедобывающей промышленности. При работе бура такие растворы ведут себя как типичные жидкости; поток бурого раствора, нагнетаемого в скважину, выносит на поверхность грубодисперсные частицы выбуренной породы. При остановке бура (например, в случае необходимости удаления труб) возникает опасность быстрого оседания - седиментации выбуренной породы и в результате - заклинивания бура, т.е. серьезной аварии. Тиксотропные свойства высокодисперсной глинистой суспензии обеспечивают возникновение коагуляционной структуры, удерживающей в своей сетке частицы породы и тем самым препятствующей их оседанию. При возобновлении работы бура коагуляционная структура глинистых частиц легко разрушается, и система вновь приобретает жидкообразные свойства. Вместе с тем учет тиксотропных свойств грунтов, особенно оводненных глинистых, чрезвычайно важен при разработке технических условий и осуществлении строительства зданий, мостов, при прокладке дорог. Катастрофические провалы на некоторых песчаных грунтах, пропитанных подпочвенной водой (зыбучие пески), также объясняются тиксотропией суспензий: они остаются неподвижными до нарушения их покоя и приобретают текучесть при механическом воздействии на них. По этой же причине строительные растворы доставляют на стройку в специальных машинах, снабженных перемешивающим устройством, предупреждающим преждевременное схватывание раствора, при перевозках на необорудованных машинах необходимо создавать условия постоянного движения в системе. Тиксотропные свойства структуры пигментов в масляных красках обусловливают технические свойства этого широко используемого материала: перемешивание обеспечивает разрушение коагуляционной структуры пигмента, легкоподвижность материала и тем самым возможность нанесения его требуемым тонким слоем, тогда как быстрое восстановление структуры препятствует отеканию краски с вертикальной поверхности. Тиксотропия способствует эффективному проведению ряда технологических операций. Например, тиксотропия позволяет проводить вибрационную обработку материалов, при которой происходит разрушение структуры, что облегчает процессы перемешивания, обеспечивает плотную упаковку, снятие внутренних напряжений и т.д. Несмотря на огромное практическое значение, строгой количественной теории тиксотропии до настоящего времени не существует. СИНЕРЕЗИС Синерезис обусловлен нарастанием числа и прочность контактов между частицами во времени, а в некоторых случаях - появлением кристаллизационных мостиков соединяющих частицы. Такой процесс срастания частиц может, в предельных случаях, привести к образованию монолитных сплошных тел. Другими словами, в результате синерезиса коагуляционная структура пасты может самопроизвольно перейти в конденсационно-кристаллизационную с "выжиманием" жидкости. Синерезису благоприятствуют все факторы, способствующие коагуляции, а именно: увеличение концентрации индифферентного электролита, повышение температуры, введение в систему десольватирующих агентов и т.д. На практике превращение пасты (коагуляционная структура) в монолитное твердое тело (конденсационно-кристаллизационная структура) провоцируется и ускоряется путем высушивания, прессовки и спекания пасты. Например, обжиг гончарных изделий. Но синерезис играет и отрицательную роль, когда при хранении уплотняется структура, что приводит к ухудшению качества продукта или даже к его полной непригодности. Так, при длительном хранении зубной пасты в результате синерезиса образуются комки с выделением жидкости, что делает зубную пасту непригодной к употреблению. Аналогичный процесс происходит при хранении крем-пудры. Каждый из нас мог бы привести еще множество примеров отрицательной роли синерезиса, но важно сделать вывод, что замедляют его все те факторы, которые замедляют коагуляцию. НАБУХАНИЕ Если в пастах частицы связаны довольно прочно, то пасты набухают сравнительно незначительно. Если связи слабые, то в такой пасте структура разрушается и система переходит в разбавленную суспензию (уже бесструктурную систему). Если паста имеет очень прочную структуру (т.е. связи между частицами очень прочные), то поглощение дисперсионной среды приводит к пластификации, т.е. к резкому понижению прочности, сопровождающемуся, однако, возрастанием пластических свойств пасты. СЕДИМЕНТАЦИОННАЯ УСТОЙЧИВОСТЬ ПАСТ Пасты, в отличие от разбавленных суспензий, являются седиментационно устойчивыми системами, т.е. они охраняют неизменным во времени распределение частиц по объему системы, способны противостоять силе тяжести. Главным фактором, ее обеспечивающим, является фиксация положения частиц дисперсной фазы в сплошной пространственной структурной сетке в результате возникновения коагуляционных или атомных контактов между частицами. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ ПАСТ Понятие "агрегативная устойчивость" применительно к пастам существенно отличается от этого понятия применительно к разбавленным суспензиям. Во-первых, для разбавленных суспензий (бесструктурные системы) существует только два четко выраженных состояния (без каких-либо промежуточных): агрегативной устойчивости и агрегативной неустойчивости, а в пастах возможно множество промежуточных состояний, связанных с ослаблением или усилением связей в структурной сетке. Крайними будут, с одной стороны, состояние, соответствующее образованию и максимальному упрочнению пространственной структурной сетки (уровень вязкости практически неразрушенной структуры и ее прочности Во-вторых, пасты зачастую получают концентрированней разбавленных суспензий, потерявших свою агрегативную устойчивость, т.е. образование и упрочнение структуры паст - это результат отсутствия агрегативной устойчивости в разбавленных суспензиях. Таким образом, в пастах, в классическом смысле слова, агрегативная устойчивость изначально отсутствует. Однако этот термин для паст используют, чтобы оценить способность последних сохранять неизменной во времени свою пространственную структуру (в первую очередь - толщину прослоек жидкости и прочность контакта в структурной сетке). В коагуляционных структурах оболочки жидкой дисперсионной среды при сближении частиц полностью не вытесняются, а принимают минимальную толщину, близкую к бимолекулярному слою. Структурирование в самих пленках дисперсионной среды препятствует дальнейшему уменьшению толщины прослоек. Оно усиливается при использовании стабилизаторов. В качестве стабилизаторов паст применяют: 1) анионные коллоидные ПАВ; 2) неионогенные коллоидные ПАВ; 3) поверхностно-активные полимеры. При использовании таких стабилизаторов реализуются, в первую очередь, адсорбционно-сольватный и структурно-механический факторы устойчивости. Являясь ПАВ, они адсорбируются на поверхности твердой частицы и снижают свободную поверхностную энергию, тем самым делая систему более устойчивой. Но с другой стороны, обладая длинноцепочечным углеводородным радикалом, эти вещества способны образовывать определенную структуру в адсорбционном слое, придающую механическую прочность и упругость защитной оболочке. Смесь анионоактивного и неионогенного ПАВ обладает синергетическим эффектом стабилизирующего действия. Механизм этого эффекта обусловлен образованием смешанного адсорбционного слоя, в результате чего увеличивается вклад адсорбционной и структурной составляющих факторов устойчивости структурно-механического барьера. Если стабилизатор является ионогенным веществом, то в дополнение к выше отмеченным реализуется электростатический фактор устойчивости, связанный с образованием ДЭС на поверхности частицы и возникновением электростатических сил отталкивания. РАЗРУШЕНИЕ ПАСТ Никакие массообменные процессы в структурированных системах нельзя успешно осуществить, не разрушив предварительно в них структуру. Разрушение пространственных структур в пастах - достаточно сложный процесс, характеризуемый тем, что по мере увеличения степени разрушения существен изменяется и сам механизм распада структуры. Можно выделить три основных этапа разрушения структуры: 1) разрушение сплошной структурной сетки, сопровождающееся распадом структуры на отдельные, достаточно крупные агрегаты; 2) разрушение агрегатов, сопровождающееся уменьшением их размера и увеличением их числа, высвобождением из агрегатов и увеличением числа отдельных частиц, образованием новых агрегатов; 3) предельное разрушение структуры при полном отсутствии агрегатов из частиц. Четкая граница между этими этапами размыта, т.е. переход из одного состояния структуры в другое по мере постепенного увеличения интенсивности внешних воздействий, разрушающих структуру, происходит постепенно. Однако каждый из этих этапов специфичен. Условия разрушения сплошной структурной сетки кардинальным образом отличаются от условий разрушения агрегатов, "плавающих" в дисперсионной среде, а значит, и параметры внешних воздействий, необходимых для разрушения сплошной структурной сетки и отдельных агрегатов их частиц, не могут не быть существенно различными. Количественно изменение состояния структуры пасты оценивается совокупностью реологических характеристик, прежде всего вязкостью , напряжением сдвига Р, упругостью Е и периодом релаксации . Наиболее резкое, на много десятичных порядков, изменение с разрушением структуры претерпевают вязкость и период релаксации. Для разрушения структуры используются следующие воздействия: • механическое помешивание; • вибрация, более эффективной является поличастотная вибрация с частотой от 10 Гц до 10 кГц; • ультразвук; • нагревание; • электрические и магнитные поля; • изменение природы поверхности твердых частиц (главным образом, путем добавления коллоидных ПАВ). Часто сочетают механические вибрационные воздействия с ультразвуковыми, тепловыми воздействиями. Такое сочетание не только существенно изменяет энергию активации процесса разрушения структуры, но в значительной степени сказывается на свойствах конечного продукта. Совместное действие на пасту вибрации и, например ультразвука приводит к гораздо большему разрушению структуры и вместе с тем к достижению существенно более высокой ее однородности, чем под влиянием каждого из этих видов воздействий с той же интенсивностью в отдельности. Важным является сочетание механических воздействий с физико-химическим управлением прочностью сцепления в контактах между частицами путем изменения природы поверхности частиц. Модифицирование твердых фаз добавками ПАВ различного строения является универсальным методом регулирования силы и энергии взаимодействия в контактах между частицами. Этот эффект - следствие сочетания двух факторов: • раздвижения частиц на двойную толщину адсорбционного слоя; • снижения поверхностного натяжения на поверхности частиц. В последние годы все шире стали применяться методы модифицирования поверхности частиц не индивидуальными ПАВ, а смесями ПАВ различных видов, например, ионогенных и неионогенных. При правильном подборе нескольких видов ПАВ обнаруживается синергизм, т.е. взаимное усиление их действия. Исключительная эффективность совместного действия вибрации и ПАВ объясняется характером разрушения структуры при вибрации и особенностями действия ПАВ. ПАВ, адсорбируясь в первую очередь на наиболее энергетически активных участках микромозаичной поверхности частиц, ослабляют преимущественно наиболее прочные коагуляционные контакты. Введение в систему ПАВ из расчета образования монослоя на поверхности частиц позволяет почти в 500 раз понизить интенсивность вибрации, необходимую для достижения предельного разрушения структуры. Не менее эффективно для ряда систем сочетание вибрации, добавок ПАВ и температурных воздействий. В тех случаях, когда вязкость структурированных систем весьма чувствительна к изменению температуры, такое комплексное воздействие наиболее целесообразно. Многие пищевые, в особенности кондитерские массы (шоколадные, пралиновые и т.п.), относятся именно к такого рода системам. 5.1.8. ДИСПЕРСИОННЫЙ АНАЛИЗ Свойства суспензий, а также рассматриваемых в главе 5 порошков в значительной степени определяются размерами частиц дисперсной фазы. Дисперсионный анализ - это совокупность методов измерения размеров частиц. При дисперсионном анализе определяют также дисперсность D и удельную поверхность . Методы дисперсионного анализа можно разделить на три группы. 1) Методы измерения параметров отдельных частиц (размеров, массы и т.д.) с последующей статистической обработкой результатов большого числа измерений: • методы, в которых линейные размеры частиц измеряют с помощью оптического микроскопа, который обеспечивает предел измерений от 1 мкм до нескольких миллиметров, и электронного микроскопа, позволяющего измерять размеры частиц от 1 нм до нескольких микрон; • методы, основанные на измерении электрического сопротивления при пропускании суспензии порошка через тонкий канал с помощью счетчиков Культера, позволяющие измерять размеры частиц от 0,1 до 100 мкм; методы, в которых измеряют изменения светового потока при пропускании суспензии через тонкий канал, вызванные попаданием в этот канал частиц дисперсной фазы. Позволяют измерять размеры частиц от 5 до 500 мкм; • методы, в которых измеряют интенсивность света, рассеянного единичной частицей, с помощью ультрамикроскопа или поточного ультрамикроскопа Дерягина-Власенко (размеры частиц от 2 до 500 нм). 2) Методы, основанные на механическом разделении дисперсной системы на несколько классов по крупности частиц: • ситовый анализ (размеры частиц от 0,05 до 10 мм); • разделение частиц в потоке газа или жидкости (раз меры частиц от 0,1 до нескольких миллиметров). 3) Методы, основанные на изучении свойств ансамбля частиц: • методы седиментационного анализа, основанные на регистрации кинетики накопления осадка. Седиментометр Фигуровского позволяет определить размеры частиц от 1 до 500 мкм. Применение центрифуг позволяет снизить предел измерения до 0,1 мкм, а ультрацентрифуг - до 1-100 нм (в этом случае можно измерять даже размеры крупных молекул); • методы рассеяния света малыми частицами (нефелометрия и турбодиметрия), методы неупругого рассеяния, а также рассеяния рентгеновских лучей, нейтронов; • адсорбционные методы, используемые для определения удельной поверхности частиц. Измеряют количество адсорбированного вещества в мономолекулярном слое. Наиболее распространен метод низкотемпературной газовой адсорбции с использованием азота (аргона, криптона) в качестве адсорбата. Удельную поверхность высокодисперсной твердой фазы часто определяют методом адсорбции из раствора. Адсорбатом при этом служат красители, ПАВ или другие вещества, малые изменения концентрации которых легко определяются с достаточно высокой точностью. Удельную поверхность частиц можно находить также по теплоте адсорбции (или смачивания). Поточные микрокалориметры позволяют проводить измерения как в газовой, так и в жидкой среде. Разнообразные адсорбционные методы дисперсионного анализа позволяют определять удельные поверхности • методы, основанные на исследовании газопроницаемости слоя анализируемого вещества при фильтровании через него воздуха при атмосферном давлении или в вакууме. Эти методы позволяют определять удельную поверхность; • в ряде случаев дисперсность порошков измеряют по скорости растворения, теплофизическим, магнитным и другим характеристикам системы, связанным с размером частиц дисперсной фазы или межфазной поверхности. Во всех упомянутых методах дисперсионного анализа получают, как правило, интегральную характеристику, позволяющую судить о некоторых средних параметрах системы. В некоторых случаях удается определить также дифференциальную функцию распределения числа частиц (их объема, массы) по размерам. Рассмотрим подробнее такие широко распространенные методы дисперсионного анализа, как ситовый и седиментационный. СИТОВЫЙ АНАЛИЗ Ситовый анализ - это определение гранулометрического и фракционного состава измельченных сыпучих материалов. Он применим для материалов с размерами частиц 0,05-10 мм. Ситовый анализ осуществляют просеиванием проб материла через набор стандартных сит с квадратными, реже с прямоугольными отверстиями, размер которых последовательно уменьшается сверху вниз. В результате материал распределяется на фракции, в каждой из которых частицы незначительно различаются размерами. Число фракций, получаемых при просеивании через набор из n сит, составляет n + 1 и не должно быть менее 5 и более 20. Сита изготавливают из плетеных или тканевых сеток (стальная, медная, латунная проволока, шелковая, капроновая, нейлоновая нить) либо штампуют из металлических листов (решетка). Для анализа очень тонких порошков с размерами частиц 0,005-0,1 мм применяют микросита, представляющие собой никелевую фольгу с расширяющимися книзу (для предотвращения забивания) квадратными отверстиями. Суммарная площадь отверстия составляет 0,36% от общей площади поверхности сита (эта величина постоянна для всего набора сит). Сита обозначаются номерами, соответствующими мерам сторон отверстий, выраженным в мм (например с № 5 имеет отверстие с длиной стороны 5 мм). Ситовый анализ можно проводить вручную или механически, в зависимости от крупности, свойств материала и необходимой точности анализ проводят сухим или мокрым способом. СУХОЙ СПОСОБ СИТОВОГО АНАЛИЗА При сухом способе проба материала предварительно перемешивается и высушивается при 105-110С. Минимальная масса пробы определяется размерами наиболее крупных частиц, например, для частиц размерами 0,1; 0,3; 0,5; 1,0; 3,0; 5-10 мм минимальная масса составляет соответственно 0,015; 0,05; 0,1; 0,2; 0,3; 2,25-18 кг. Пробу высыпают на верхнее сито и весь комплект сит встряхивают 10-30 минут. При просеивании тонкодисперсных материалов, склонных к агрегированию, в нижнее сито помещают резиновые шайбы либо пробки для растирания образовавшихся комков. После просеивания взвешивают на технических весах с точностью до 0,1 г остаток в каждом сите и вычисляют содержание (в % по массе) фракции в исходной пробе. МОКРЫЙ СПОСОБ СИТОВОГО АНАЛИЗА Этот способ используют в случаях необходимости очень точного определения гранулометрического состава порошков, растрескивающихся при температурах ниже 105С, а также слипающихся или содержащих большое количество мелкой фракции. Мельчайшие частицы отмывают слабой струей воды до тех пор, пока слив не станет прозрачным. Остаток на сите высушивают, взвешивают и по разности масс находят количество отмытого шлама. Фракции частиц обозначают номерами сит. Например, если фракция получена последовательным просеиванием материала на ситах № 2 и № 1, фракцию обозначают следующим образом: 2-1 мм. Результаты ситового анализа представляют графически в виде так называемых кривых распределения. Последние подразделяют на дифференциальные (показывающие процентное содержание отдельных фракций) и интегральные (отражающие суммарное процентное содержание всех фракций меньше или больше данного размера). Зная распределение частиц по их размерам, можно ответить на основные вопросы дисперсионного анализа: • каковы размеры самой малой и самой большой частицы; • частиц какого размера больше всего; • каков фракционный состав системы, т.е. каково процентное содержание данной фракции в системе. Под фракцией понимается та часть порошка, размер частиц в которой отвечает выбранному интервалу размеров. Пример. В данном порошке самая маленькая частица имеет Примем, что частицы радиусы которых не отличаются больше, чем на 0,3 • 1-я фракция - все частицы с радиусом (2,0-2,3); • 2-я фракция - все частицы с радиусом (2,3-2,6); • 3-я фракция - все частицы с радиусом (2,6-2,9); • 4-я фракция - все частицы с радиусом (2,9-3,2); • 5-я фракция - все частицы с радиусом (3,2-3,5). СЕДИМЕНТАЦИОННЫЙ АНАЛИЗ Седиментационный анализ состоит в экспериментальном получении кривой седиментации, т.е. зависимости массы осадка m дисперсной фазы от времени осаждения t. С процессом седиментации частиц дисперсной фазы мы уже сталкивались (см. раздел 3.5.1). Вспомним основные закономерности этого процесса. Если сферическую частицу, радиус которой r и плотность , поместить в жидкость, плотность которой равна , а вязкость , на нее будет действовать сила тяжести (седиментация).
где V - объем частицы, равный Как только частица станет оседать, возникнет противодействующая сила - сила трения ()
где В - коэффициент трения, a U - скорость оседания. В начале частица движется ускоренно, так малых скоростях сила тяжести превышает силу По мере увеличения скорости движения сила возрастает и в некоторый момент достигается Исходя из приведенных выше уравнений
В соответствии с законом Стокса,
Таким образом, скорость седиментации прямо пропорциональна квадрату радиуса частицы. Следовательно, частицы разных размеров оседают с разными скоростями: чем больше частица, тем больше скорость ее оседания. Если экспериментально определить скорость оседания, можно легко рассчитать радиус частицы:
Так как величины
Это уравнение справедливо только для условий, при которых выполняется закон Стокса, а именно: • частицы имеют сферическую форму; • движутся ламинарно, независимо друг от друга и постоянной скоростью; • трение является внутренним для дисперсионной среды. Эти условия выполняются только для систем, в которых размеры частиц лежат в пределах см. Если размеры частиц больше Если размеры частиц меньше см, то такие частицы участвуют в броуновском движении, следствием которого является диффузия, направленная противоположно седиментации, кроме того, на движение таких частиц сильно влияют конвекционные тепловые потоки. На седиментацию отдельной частицы не должны влиять соседние частицы. Чтобы избежать взаимного влияния частиц, необходимо проводить седиментацию в достаточно разбавленных суспензиях (с концентрацией не выше 1%). Конечно, если взять еще более разбавленную суспензию, межчастичные взаимодействия будут проявляться еще в меньшей степени. Но чем более разбавлена суспензия, тем меньше масса осадка и тем больше ошибка измерения. Таким образом, в седиментационном анализе используют суспензии, размеры частиц в которых лежат в пределах от до см, а концентрация составляет 0,5-0,6%. Важным условием применимости седиментационного анализа является полная смачиваемость частиц жидкостью, в которой они оседают. В этом случае на поверхности твердых частиц образуется слой из молекул жидкости, перемещающийся вместе с частицей. При движении частиц происходит скольжение между двумя слоями жидкости (а не между твердой поверхностью и жидкостью) и в уравнении Стокса величина действительно представляет собой коэффициент вязкости жидкости. Кроме того, следует иметь в виду, что на несмачивающихся частицах обычно образуются воздушные пузырьки, искажающие Результаты определения. Наконец, если частицы, плохо смачиваются средой, то происходит агрегация частиц, а также искажает результаты анализа. Если исследуемое вещество не смачивается данной жидкостью, необходимо добавить смачиватель (обычно вводят какое-либо поверхностно-активное вещество). СЕДИМЕНТАЦИОННЫЙ АНАЛИЗ МОНОДИСПЕРСНЫХ ПОРОШКОВ Кинетика седиментации частиц монодисперсной темы описывается уравнением:
где Q - общая масса дисперсной фазы; Н - первоначальная высота столба суспензии; m - масса частиц, осевших ко времени t. График седиментации m = f(t) представляет собой прямую линию выходящую из начала координат (рис. 15.3 ). Тангенс угла наклона характеризует скорость накопления осадка
При достижении времени
где h - высота, на которую опустилась граница за время t. Тогда радиус частиц можно рассчитать по формуле
СЕДИМЕНТАЦИОННЫЙ АНАЛИЗ ПОЛИДИСПЕРСНЫХ ПОРОШКОВ Все реальные порошки полидисперсны и поэтому оседают с различными скоростями. Четкой границы осветления суспензии не наблюдается - крупные частиц осаждаются быстрее, мелкие - медленнее. Поэтому кривая седиментации полидисперсной системы m = f(t) имеет вид, представленный на рис. 15.4 . Тангенсы углов наклона касательных к кривой седиментации определяют скорости седиментации соответствующих фракций частиц. Зная скорости оседания частиц отдельных фракций, можно рассчитать их радиусы. Так как большинство реальных порошков имеют частицы неправильной формы, по уравнению Построением интегральной, а затем дифференциальной кривой распределения частиц полидисперсной системы по их радиусам заканчивается седиментационный анализ. Построение кривой седиментации. Для построения кривой седиментации обычно используются торзионные весы. С их помощью определяют массу частиц, оседающих на чашечку весов, помещенную в стеклянный цилиндр с исследуемой суспензией на расстояние h от поверхности жидкости. Отмечают показания весов с интервалами времени 30 с, а затем их увеличивают до 1 мин, 3 мин, 5 мин по мере того как изменение массы замедляется. В идеальном случае эксперимент заканчивается, когда масса осадка достигает количества порошка, взятого для приготовления суспензии. Но допустимо заканчивать измерения, когда изменение массы за 10 мин составляет не более 2-3 мг, или когда на чашечку весов выпадет не менее 75% исходного количества порошка. В таблице 15.1 приведены экспериментальные данные седиментации талька в воде. Таблица 15.1. Экспериментальные данные седиментации талька в водеt, мин 0,5 1 2 4 6 8 12 16 18 mi, мг* 8 11 15 2-1 26 29 34 38 40 Qi, % 20,0 27,5 37,5 52,5 65,0 72,5 85,0 95,0 100,0
Условия опыта: h = 0,09 м; Очевидно, что абсолютные массы осадка в разные моменты времени будут зависеть от исходной массы, поэтому рассчитывают относительные массы в процентах от исходной массы. Из данных таблицы 15.1 видно, что начиная с 18-й минуты масса осадка на чашечках весов не изменяется, следовательно, к этому моменту времен выпал весь осадок, его массу принимают за максимальную: В нижней строке таблицы указаны относительные массы выпавшего осадка ( Из графика видно, что чем дольше идет осаждение, тем меньше прирост массы осадка. В начальный момент времени частицы разных размеров равномерно распределены в жидкости (перед началом эксперимента суспензия тщательно перемешивается). Чем крупнее частица, тем быстрее она оседает, но мелкие частицы, находящиеся вблизи чашечки весов, осядут скорее, чем крупные, находящиеся у поверхности жидкости, т.е. на расстоянии h от чашечки весов. В результате на чашечке весов будут собираться частицы всех размеров. Поэтому кривая седиментации всегда начинается с прямолинейной зависимости и выходит из начала координат. Однако через некоторое время
Рассчитаем значение постоянной К, подставив в уравнение данные из условий опыта:
По графику (рис. 15.5) находим = 0,2 мин. Тогда
В дальнейшем скорость накопления осадка будет уменьшаться, график будет оставаться криволинейным вплоть до установления постоянной массы осадка. В нашем примере это произойдет через Теперь мы можем рассчитать радиус самой мелкой частицы:
Таким образом, мы установили минимальный и максимальный радиусы частиц. Теперь важно установить, в каком соотношении присутствуют частицы разных размеров, т.е. установить фракционный состав порошка. Для этого на основе седиментационной кривой надо построить интегральную и дифференциальную кривые распределения частиц. Построение интегральной кривой распределения
Рассчитаем радиус частиц, прошедших за время всю высоту суспензии до чашечки весов:
Следовательно, - это масса частиц, имеющих радиусы Обычно касательные проводят к наиболее выпуклым точкам кривой седиментации. Однако часто их проводят к точкам, отвечающим моментам времени, когда измерялась масса осадка. Все необходимые данные для построения кривых распределения приведены в таблице 15.2. На рис. 15.6 представлена интегральная кривая распределения. Каждая ордината указывает процентное содержание частиц, обладающих радиусом, равным или больше указанного на оси абсцисс. Интегральная кривая распределения позволяет определить процентное содержание фракций. Например, для фракции, содержащей частицы с радиусами от
Таблица 15.2. Результаты обработки данных седиментации талька в воде ti, мин Qi, % Q0,i, % 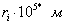 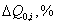 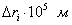 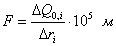 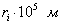 0,5 20,0 9,0 2,83 9,0 1,64 5 3,65 1 27,5 14,5 2,00 5,5 0,83 6,63 2,42 2 37,5 19,5 1,41 5,0 0,59 8,5 1,71 4 52,5 25,5 1,00 6,0 0,41 14,6 1,21 6 65,0 37,0 0,82 11,5 0,18 63,9 0,91 8 72,5 42,5 0,71 5,5 0,11 50,0 0,77 12 85,0 51,6 0,58 9,1 0,13 70,0 0,65 16 95,0 57,8 0,50 6,2 0,08 77,5 0,54 18 100 100 0,47 42,2 0,03 1406 0,49 *Указаны значения самого маленького радиуса среди частиц, полностью выпавших в осадок к данному моменту. Наглядное представление o распределении частиц по размерам дает дифференциальная кривая распределения. Построение дифференциальной кривой распределения F% = f(r). Дифференциальная кривая распределения частиц представляет собой зависимость массовой функции распределения Для построения графика функции F% = f(r) можно использовать интегральную кривую, определяя приращение Дифференциальную кривую можно построить и непосредственно из кривой седиментации, определяя Воспользуемся таблицей 15.2. Столбец 5 в ней - разница масс фракций, полностью осевших к определенным моментам времени. Столбец 6 - разница радиусов наименьших частиц в этих фракциях. Столбец 7 - значение функции. Столбец 8 - средний радиус данной фракции, именно к нему относят F.
Дифференциальная кривая представлена на рис. 15.7 . Площадь под всей кривой равна массе всех частиц в системе (100%). Радиус, отвечающий максимуму на кривой, показывает, какого радиуса частицу наиболее распространены в данной системе. Чем более четко выражен максимум на кривой, тем более неравномерно распределены частицы по размерам. Для того чтобы определить процентное содержание фракций частиц с заданными радиусами, надо провести вертикаль до пересечения с кривой. Площади под кривой, ограниченные этими линиями, характеризуют процентное содержание соответствующих фракций. В результате седиментационного анализа данной системы мы установили, что 1) минимальный радиус частиц составляет 2) максимальный радиус равен 3) процентное содержание отдельных фракций с радиусом частиц:
5.1.9. ОБЛАСТИ ПРИМЕНЕНИЯ СУСПЕНЗИЙ Области распространения суспензий - это вся наша планета Земля, и это ни в коей мере не преувеличение, так как суспензиями являются почвы и грунты при достаточном содержании влаги; вода природных и искусственных водоемов (рек, озер, морей, океанов, прудов, водохранилищ). Всю твердообразную пищу животные, в том числе и человек, усваивают в виде суспензий, которые они начинают готовить уже в момент пережевывания. Любая отрасль промышленности и сельского хозяйства в той или иной степени использует суспензии. Oтметим некоторые из них. ПИЩЕВАЯ ПРОМЫШЛЕННОСТЬ В первую очередь отметим, что многие пищевые продукты представляют собой суспензии: плодово-ягодные соки, разнообразные пасты (томатная, шоколадная, шоколадно-ореховая и т.д.), соусы и кетчупы, готовая горчица и другие. Но еще более важным является то, что практически любое пищевое производство на той или иной стадии связано с образованием, переработкой или разрушением суспензий. Сахарная промышленность - получение и очистка диффузного сока сахарной свеклы, который является суспензией. Масложировая промышленность - адсорбционное рафинирование растительного масла, основанное на использовании в качестве адсорбента суспензии бентонитовых глин. Крахмально-паточная промышленность - производство как картофельного, так и кукурузного крахмала связано с получением суспензий на начальных стадиях (крахмальное молоко, мельничное молоко), их очисткой и разрушением с выделением готового продукта на завершающем этапе. Молочная промышленность - суспензии образуются в производстве казеина, получении и переработки творога, ассортимент изделий из которого весьма велик. Мясная промышленность - производство мясных фаршей, различных колбас, паштетов связано с приготовлением и переработкой высококонцентрированных суспензий (паст). Хлебопекарная и макаронная промышленность основана на замесе и обработке теста, которое в отношении твердых компонентов является пастой. Кондитерская промышленность - шоколадная масса при температуре несколько выше 35 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ Суспензии являются объектами производственных процессов при получении удобрений, катализаторов, красителей и т.д. В современной химической технологии получает распространение суспензионная полимеризация. Она заключается в том, что полимеризация происходит в каплях мономера, диспергированного в воде, в результате образуется суспензия полимера с размером твердь частиц от нескольких микрон до нескольких миллиметров. Этим методом получают полимеры из плохо растворимых в воде мономеров, например, эфиров акриловой и метакриловой кислот, стирола, дивинилбензола, винилацетата и др. Нельзя не упомянуть о том, что многие лекарственные и косметические средства используются нами в виде суспензий. Каждый день мы начинаем и заканчиваем с зубной пастой в руках. А зубная паста - это высококонцентрированная суспензия частиц карбоната кальция (полный состав зубной пасты указан на упаковке). Безусловно, это далеко не полный перечень областей распространения и применения суспензий, и каждый читатель сможет его дополнить, исходя из круга своих индивидуальных интересов. ЗАКЛЮЧЕНИЕ Суспензии - это микрогетерогенные системы с твердой дисперсной фазой и жидкой дисперсионной средой (Т/Ж). В зависимости от частичной концентрации дисперсной фазы суспензии делятся на разбавленные и концентрированные, называемые пастами. Разбавленные суспензии являются свободнодисперсными системами и имеют много общего с лиофобными золями. Подобно лиофобным золям их получают диспергационными и конденсационными методами. Как правило, на поверхности частиц суспензий возникает ДЭС, который обеспечивает их агрегативную устойчивость. Величина дзета-потенциала имеет тот же порядок, что и у типичных лиозолей. При добавлении электролитов суспензии, подобно лиозолям, коагулируют, образуя крупные агрегаты. При наложении внешнего электрического поля происходят, правда в меньшей степени, чем у золей, электрокинетические явления. Вместе с тем частицы дисперсной фазы в суспензиях имеют значительно большие размеры (более см), чем частицы золей ( см). Этим обусловлены их существенные различия: • суспензии кинетически неустойчивы и быстро седиментируют; • молекулярно-кинетические свойства - броуновское движение, диффузия, осмос проявляются слабо или не проявляются совсем; • суспензии практически не рассеивают свет, преимущественно отражая или поглощая его, частицы дисперсной фазы видны в обычный микроскоп; • вследствие малой удельной поверхности частиц дисперсной фазы суспензий слабо выражены поверхностные явления. Концентрированные суспензии - пасты представляют собой связнодисперсные системы, в которых частицы дисперсной фазы взаимодействуют, образуя пространственные структуры. Для этих систем определяющими являются структурно-механические свойства, которые характеризуются такими параметрами, как вязкость, упругость, пластичность и др. Для паст характерны невысокая механическая прочность, тиксотропия, синерезис, набухание. Для определения размеров частиц дисперсной фазы в суспензиях широко применяются методы дисперсионного анализа. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие системы называются суспензиями? В чем состоит их принципиальное отличие от лиофобных золей? 2. По каким признакам классифицируются суспензии? 3. Какие классы веществ используются в качестве стабилизаторов суспензий? Какие факторы устойчивости при этом реализуются? 4. Что называется сенсибилизацией? 5. Перечислите методы разрушения разбавленных суспензий. 6. Чем определяется возможность образования структуры в суспензии? Какие факторы влияют на структурообразование? 7. Какими характерными свойствами обладают пасты? Механические свойства паст. 8. Что называется тиксотропией? Чем она количественно характеризуется? 9. Характерно ли для паст явление синерезиса? 10. Какой график называется интегральной кривой распределения частиц? Какие данные можно получить из этой кривой? 11. Как строится дифференциальная кривая распределения? Какую информацию получают при анализе этой кривой? Изучив содержание главы 15, вы должны знать: • сходство и различия между разбавленными суспензиями и лиофобными золями; • методы получения и разрушения суспензий; • свойства паст; • сущность и методы дисперсионного анализа. 5.2. ГЛАВА 16. ЭМУЛЬСИИ Эмульсией называется микрогетерогенная система, состоящая из взаимнонерастворимых жидкостей, распределенных одна в другой в виде капелек. Жидкость, взвешенная в виде капелек, называется дисперсной фазой. Жидкость, в которой распределена дисперсная фаза, называется дисперсионной средой. Условно эмульсии обозначают в виде дроби 5.2.1. КЛАССИФИКАЦИЯ ЭМУЛЬСИЙ Эмульсии обычно классифицируют по двум признакам: 1) по концентрации дисперсной фазы (Cd): разбавленные ( 2) по полярности дисперсной фазы и дисперсионной среды: эмульсии I рода (прямые) - М/В; эмульсии II рода (обратные) - В/М. Любую полярную жидкость принято обозначать буквой "В" - "вода", а неполярную буквой "М" - "масло". В эмульсиях I рода капельки неполярной жидкости (масла) распределены в полярной (воде). В эмульсиях I рода дисперсионная среда неполярна. 5.2.2. МЕТОДЫ ПОЛУЧЕНИЯ ЭМУЛЬСИЙ Система из двух несмешивающихся жидкостей 6v находиться в термодинамически устойчивом состоянии ее она будет состоять из двух сплошных слоев: верхнего (более легкая жидкость) и нижнего (более тяжелая жидкости). Как только мы начнем один из сплошных слоев дробить в капельки, чтобы получить эмульсию, будет возрастать меж фазная поверхность, а следовательно, свободная поверхностная энергия и система станет термодинамически неустойчивой. Чем больше энергии будет затрачено на образование эмульсии, тем более неустойчивой она будет. Чтобы придать эмульсии относительную устойчивость, используют специальные вещества - стабилизаторы, называемые эмульгаторами. Практически все эмульсии (за исключением некоторых, образующихся самопроизвольно) получают только в присутствии эмульгаторов. Природа и механизм действия эмульгаторов будут рассмотрены в специальном разделе, а пока отметим, что эмульсии - это, как минимум, трехкомпонентные системы, состоящие из полярной жидкости, неполярной жидкости и эмульгатора. При этом одна из жидкостей находится в виде капель. Капли требуемых размеров могут быть получены двумя различными путями: конденсационным методом, выращивая их из малых центров каплеобразования, и диспергационным, дробя крупные капли. Наиболее распространенными как в лабораторной, так и в производственной практике являются диспергационные методы. КОНДЕНСАЦИОННЫЕ МЕТОДЫ Конденсация из паров. Пар одной жидкости (дисперсная фаза) инжектируется под поверхность другой жидкости (дисперсионная среда). В таких условиях пар становится пересыщенным и конденсируется в виде капель размером порядка 1 мкм. Эти капли стабилизируются в жидкости, содержащей соответствующий эмульгатор. На размер образующихся капель существенным образом влияют давление инжектируемого пара, диаметр впускного сопла, эмульгатор. Этим методом легко получают капли с размерами до 20 мкм. Эмульсии можно также получить, используя монодисперсный аэрозоль, полученный конденсационным методом. Для этого в слегка пересыщенный пар вводят мелкие (с размерами Замена растворителя. Вещество, которое в будущей эмульсии должно находиться в виде капель, растворяют в "хорошем" растворителе с образованием истинного раствора. Если затем в полученный раствор ввести другой растворитель, который существенно "портит" первый, то растворенное вещество будет объединяться в капли, образуя эмульсию. Например, для бензола этанол является "хорошим" растворителем, в котором бензол находится в виде молекул. При добавлении к этому раствору воды происходит образование капелек бензола в водно-спиртовой дисперсионной среде - возникает эмульсия I рода. Этот процесс легко наблюдается визуально - система из прозрачной становится мутной, так как капельки бензола, в отличие от молекул бензола, рассеивают и отражают свет. ДИСПЕРГАЦИОННЫЕ МЕТОДЫ Эти методы основаны на дроблении грубодисперсной системы, которая представляет собой два несмешивающихся жидких слоя. В зависимости от вида работы, которая совершается над грубодисперсной системой, диспергационные методы можно подразделить на три группы. Механическое диспергирование. Механическая работа, затрачиваемая для диспергирования, сводится к встряхиванию, смешению, гомогенизации, выдавливанию сплошных жидкостей, одна из которых содержит эмульгатор. 1. Метод прерывистого встряхивания (d капель - 50-100 мкм) Образование эмульсии легко продемонстрировать, если пробирку, в которую налиты две жидкости, энергично встряхивать. Бригс (1920) установил, что прерывистое встряхивание с постоянными интервалами между толчками гораздо более эффективно, чем непрерывное. Например, для приготовления эмульсии 60% бензола в 1%-м растворе олеата натрия необходимо непрерывное встряхивание в течение 7 мин (за это время механическое устройство совершает 3000 толчков). Такая же эмульсия может быть приготовлена путем пяти встряхиваний вручную в течение 2 мин, если интервалы между двумя толчками составляют 20-30 с. При каждом толчке сплошная поверхность между двумя жидкостями становится волнистой и деформируется. Эта волнистость вначале приобретает вид пальцевидных отростков, которые затем разрушаются на мелкие капли. Этот процесс совершается в течение примерно 5 с. Если увеличивать интервалы между встряхиваниями, можно ускорить этот процесс. При ручном встряхивании капли будут иметь шаровую форму и размер 50-100 мкм. 2. Применение смесителей Промышленность выпускает смесители разнообразных конструкций: с мешалками пропеллерного и турбинного типов, коллоидные мельницы, гомогенизаторы. Гомогенизаторы - это устройства, в которых диспергирование жидкости достигается пропусканием ее через малые отверстия под высоким давлением. Эти устройства широко применяются для гомогенизации молока, в ходе которой средний диаметр капель молока понижается до 0,2 мкм, и такое молоко не отстаивается. Эмульгирование ультразвуком. Образование эмульсий при интенсивном ультразвуковом воздействии впервые наблюдали Вуд и Лукис (1927), которые работали с кварцевым генератором большой мощности и частотой 200 кГц. По мере развития ультразвуковой техники появился целый поток исследований в этой области. Ультразвуковая область частот лежит выше предела слышимости человека (более 15 кГц) и распространяется вплоть до Следует отметить, что эмульгирование ультразвуком весьма перспективно, хотя пока не находит широкого применения в промышленности. Эмульгирование электрическими методами. Метод электрического "дробления" известен давно, хотя стал привлекать внимание к себе лишь в последние годы. В 1958 г. Наваб и Мазон получили практически монодисперсную эмульсию в результате электрического диспергирования. Идея их метода состояла в следующем. Жидкость, которая должна быть диспергирована, помещалась в сосуд, заканчивающийся капиллярной воронкой. Последняя соединялась с положительным полюсом источника высокого напряжения. Сосуд был вставлен в большую круглодонную колбу, на дно которой был уложен заземленный металлический электрод. В колбу была налита жидкость, которая служила бы в эмульсии дисперсионной средой. Образующиеся при истечении из капилляра мелкие капли, попадая в жидкость, образовали эмульсии. Изменяя величину приложенного напряжения и регулируя зазор между капилляром и жидкостью, получали эмульсии с определенными размерами частиц, обычно в интервале 1-10 мкм. Для улучшения свойств эмульсий жидкость в колбе можно перемешивать и вводить эмульгатор. Таким путем получали устойчивые эмульсии типов М/В и В/M с концентрацией до 30%. Электрические методы диспергирования в настоящее время находятся в стадии развития и совершенствования. Они имеют ряд очевидных преимуществ, из которых главное - высокая монодисперсность получаемых эмульсий. Эти методы позволяют получать эмульсии обоих типов с меньшей концентрацией эмульгатора, чем с помощью других методов. Однако электрические методы имеют и недостатки. Так, если жидкости обладают заметной вязкостью, то эмульгирование затруднено или вообще невозможно. САМОПРОИЗВОЛЬНОЕ ЭМУЛЬГИРОВАНИЕ Самопроизвольным называется эмульгирование, которое происходит без затрат энергии извне. Оно обнаруживается, например, в двухкомпонентной (без эмульгатора) гетерогенной системе при температуре, близкой к критической температуре взаиморастворения этих жидкостей. При этой температуре поверхностное натяжение становится крайне малым, менее В этой возможности самопроизвольного образования термодинамически устойчивых равновесных систем при условии очень низких значений поверхностного натяжения заключается одна из характерных особенностей эмульсий, отсутствующая у всех других дисперсных систем. По Ребиндеру, критическое значение
где k - постоянная Больцмана. При Жидкий жир при поглощении организмом эмульгируется в кишечнике солями желчных кислот до состояния высокодисперсной жировой эмульсии и затем всасывается через стенки кишечника. Интересно, что система таурохолат (желчная соль) - моноглицеридолеиновая кислота при 6,0 < рН < 8,5 действительно обладает очень низким поверхностным натяжением (ниже 1 ), при котором может происходить самопроизвольное эмульгирование. Эмульсии, которые образуются самопроизвольно и, следовательно, являются термодинамически устойчивыми, иногда называют лиофильными эмульсиями. Следует отметить, что после открытия Гэдом в 1878 г. самопроизвольного эмульгирования, были найдены многочисленные системы жидкостей, которым свойственно это явление. Однако его механизм до сих пор остается дискуссионным. 5.2.3. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЭМУЛЬСИЙ Для оценки свойств эмульсий существует несколько характеристик, основными из которых являются: • дисперсность эмульсии; • устойчивость во времени; • концентрация дисперсной фазы. ДИСПЕРСНОСТЬ ЭМУЛЬСИИ Определяется размерами частиц дисперсной фазы. Если эмульсия полидисперсна, то для ее характеристики необходимо указать распределение частиц по размерам, чаще всего в виде гистограммы. УСТОЙЧИВОСТЬ ВО ВРЕМЕНИ Обычно устойчивость характеризуется одной из двух величин - скоростью расслоения эмульсии и временем жизни отдельных капель в контакте с другими. Скорость расслоения эмульсии определяют, измеряя высоту (объем) отслоившейся фазы через определенные промежутки времени после получения эмульсии. Время жизни отдельных капель определяют путем микроскопических наблюдений за каплей, помещенной на межфазную границу. Например, капля масла подводится к границе раздела со стороны воды и измеряется время, через которое она сольется с фазой масла. Чаще используется первая характеристика эмульсии. КОНЦЕНТРАЦИЯ ДИСПЕРСНОЙ ФАЗЫ Свойства разбавленных эмульсий (Сd < 0,1% об). Такие эмульсии, как правило, тонкодисперсны и близки по свойствам к лиофобным золям. В таких эмульсиях из-за малых размеров капель наблюдаются броуновское движение, диффузия, рассеяние света и т.д., они являются седиментационно устойчивыми. Их агрегативная устойчивость так же, как в лиофобных золях, определяется наличием диффузных электрических слоев. Коагуляция под действием электролитов подчиняется правилу Шульце- Гарди. К разбавленным эмульсиям приложима теория устойчивости лиофобных золей. Широко известный пример разбавленной эмульсии - конденсат отработанного пара в паровой машине, в ней диспергированы мельчайшие капельки машинного масла. Другой пример - сырая нефть, в которой капельки воды образуют эмульсию II рода. Свойства выcококонцентрированных эмульсий. Для таких систем вопросы, связанные с движением частиц (диффузия, седиментация), отпадают, и эмульсии по своим свойствам сходны со структурированными коллоидными системами - гелями. Когда концентрация капель приближается к 100%, дисперсионная среда принимает вид очень тонких прослоек жидкости - эмульсионных пленок. Такие эмульсии по своей структуре аналогичны пенам (см. главу 17), их свойства определяются, в первую очередь, свойствами эмульсионных пленок, стабилизированных эмульгаторами. Свойства концентрированных эмульсий. В таких эмульсиях капли достаточно крупные и видны в оптический микроскоп. Концентрированные эмульсии седиментационно неустойчивы. Вследствие высокой концентрации капли находятся в постоянном контакте и легко наступает коалесценция. Устойчивость таких эмульсий полностью зависит от эмульгатора. 5.2.4. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ ЭМУЛЬСИЙ Агрегативная устойчивость эмульсий - это способность сохранять во времени неизменными размеры капель дисперсной фазы, т.е. противостоять коалесценции. Существует несколько факторов агрегативной устойчивости. ЭЛЕКТРОСТАТИЧЕСКИЙ ФАКТОР УСТОЙЧИВОСТИ Вокруг капелек эмульсии образуются ДЭС и вследствие этого возникает энергетический барьер, препятствующий сближению частиц до расстояний, на которых силы молекулярного притяжения преобладают над силами электростатического отталкивания. Этот фактор устойчивости является весьма существенным для эмульсий, стабилизированных коллоидными ПАВ и полиэлектролитами. АДСОРБЦИОННО-СОЛЬВАТНЫЙ ФАКТОР УСТОЙЧИВОСТИ Эмульгаторы, адсорбируясь на поверхности капли, уменьшают поверхностное натяжение на границе "капля-среда" и делают систему более устойчивой. Но если в качестве эмульгаторов используются коллоидные ПАВ и ВМС, то создается адсорбционно-сольватная оболочка, являющаяся структурированной. СТРУКТУРНО-МЕХАНИЧЕСКИЙ ФАКТОР УСТОЙЧИВОСТИ На поверхности капель образуется слой молекул эмульгатора, обладающий повышенной вязкостью и упругостью и препятствующий слиянию капель. Этот фактор играет главную роль, если эмульгатором являются ВМС и неионогенные ПАВ. 5.2.5. ТИПЫ ЭМУЛЬГАТОРОВ НЕОРГАНИЧЕСКИЕ ЭЛЕКТРОЛИТЫ Неорганические электролиты являются наименее эффективными эмульгаторами. Так, при добавлении тиоцианата калия KNCS к смеси "вода-масло" в небольшой концентрации можно получить временную разбавленную эмульсию I рода. Ее относительная устойчивость может быть объяснена возникновением ДЭС на водной стороне межфазной поверхности, который образуется вследствие избирательной адсорбции SCN~. Эти ионы создают малый отрицательный потенциал на межфазной поверхности и плотность поверхностного заряда мала. Поэтому силы отталкивания между ДЭС капель также невелики. Этот тип стабилизации слишком слаб для получения эмульсии нужной концентрации и с достаточным временем жизни. КОЛЛОИДНЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА Вспомним, что коллоидные поверхностно-активные вещества - дифильные молекулы, содержащие в своем углеводороднрм радикале не менее 8-10 атомов углерода. Соотношение между гидрофильными свойствами полярной группы и липофильными ("липос" - жир) свойствами неполярной группы (углеводородного радикала) определяется гидрофильно-липофильным балансом - числом ГЛБ. Стабилизация эмульсий ионогенными коллоидными ПАВ связана с адсорбцией и определенной ориентацией молекул ПАВ на поверхности капель. В соответствии с правилом уравнивания полярностей Ребиндера полярные группы ПАВ обращены к полярной фазе, а неполярные радикалы - к неполярной фазе. Чтобы ПАВ могло защитить каплю от слияния с другой, оно должно создавать защитную оболочку снаружи капли. Поэтому оно должно лучше (но не полностью!) растворяться в жидкости, которая является дисперсионной средой, чем в жидкости, из которой состоит капля. Растворимость ПАВ характеризуется числом ГЛБ. Чем оно больше, тем сильнее баланс сдвинут в сторону гидрофильных свойств, тем лучше данное вещество растворяется в воде. ПАВ с числом ГЛБ от 8 до 13, лучше растворимы в воде, чем в масле, они образуют эмульсии I рода. ПАВ с числом ГЛБ от 3 до 6, образуют эмульсии II рода. Наиболее эффективными эмульгаторами для получения эмульсий I рода являются натриевые соли жирных кислот (мыла) с числом углеродных атомов 8-10 и выше, а также алкилсульфаты, алкилсульфонаты и др. В ряду жирных кислот лучшими эмульгаторами являются лауриновая ( Ионогенные ПАВ образуют двойной электрический слой. Существенно, что для предотвращения прямого контакта и коалесценции капель нет необходимости в образовании сплошного защитного слоя, достаточно, если этот слой занимает 40-60% поверхности капли. Углеводородные радикалы ПАВ в эмульсиях I рода уходят в глубь капель, причем для хорошей вертикальной ориентации они должны состоять не менее, чем из 8-10 атомов углерода. Вертикальная ориентация неионогенных ПАВ на поверхности раздела приводит к образованию слоя полярных групп, являющихся центрами гидратации - создается защитный гидратный слой. Стабилизация обратных эмульсий (В/M) с помощью ПАВ не ограничивается факторами, обусловливающими уменьшение поверхностного натяжения. ПАВ, особенно с длинными радикалами, на поверхности капелек воды могут образовывать пленки значительной вязкости (реализуется структурно-механический фактор устойчивости), а также обеспечивать энтропийное отталкивание благодаря участию радикалов в тепловом движении. В кулинарии обычно используют в качестве эмульгаторов естественные природные продукты, содержащие ПАВ: молотый перец, горчицу, желтки яиц и др. В пищевой промышленности чаще для этих целей используются синтетические ПАВ: олеаты, пропиловый спирт, моноглицериды жирных кислот, сахароглицериды. ВЫСОКОМОЛЕКУЛЯРНЫЕ ВЕЩЕСТВА Еще большая стабильность эмульсий может быть достигнута при использовании ВМС: протеинов, каучука, смолы, резины, крахмала и других полисахаридов (например, декстрина, метилцеллюлозы), а также синтетических полимеров (например, поливинилового спирта). В отличие от мыл, длинные цепные молекулы этих веществ с равномерным распределением полярных групп располагаются горизонтально в плоскости раздела "капля-среда", где они могут легко переплетаться между собой с образованием двухмерных структур. Адсорбция высокомолекулярных соединений обычно является медленной и практически необратимой. Некоторые протеины, адсорбируясь, становятся нерастворимыми в воде. Если такие слои сжимать, происходит их разрушение с образованием микроскопических осадков, которые остаются на межфазной поверхности в виде прочной эластичной оболочки. Понятно, что капля, находясь в такой "капсуле", неограниченно устойчива против коалесценции, однако количественные закономерности этого явления неизвестны. Можно считать эффективным высокомолекулярный эмульгатор, образующий эластичный гель: он разбухает в непрерывной фазе, а попыткам к сжатию этого геля препятствуют большие осмотические силы (давление набухания). Таким образом, при использовании в качестве эмульгаторов ВМС в первую очередь реализуется структурно-механический фактор устойчивости - на поверхности капли создается структурированная прочная пленка. В случае высококонцентрированных эмульсий, в которых капли имеют форму многогранников, а среда находится в виде тонких прослоек между ними, эти прослойки одновременно являются структурированными защитными оболочками, они придают всей системе ярко выраженные твердообразные свойства. Многие ВМС содержат ионогенные группы и в растворах распадаются с образованием полиионов. Группу -СООН, например, содержат альгинаты, растворимый крахмал, группу В пищевой промышленности получили большое распространение белки молочной сыворотки, соевый белковый изолят, казеинат натрия, белки плазмы крови, бычий сывороточный альбумин, отходы переработки пищевого сырья (кровь со скотобоен, подсырная сыворотка, картофельный крахмал), из которых получают белки, используемые в качестве эмульгаторов. В кулинарной практике часто используется желатин - полидисперсный белок, представляющий собой смесь полимергомологов различной молекулярной массы от 12 000 до 70 000 а. е. м. ТОНКОИЗМЕЛЬЧЕННЫЕ НЕРАСТВОРИМЫЕ ПОРОШКИ Этот тип стабилизаторов характерен только для эмульсий. Давно известно, что некоторые высокодисперсные порошки эффективно стабилизируют эмульсии против коалесценции. Химическая природа этих частиц менее важна, чем их поверхностные свойства. Основные требования к порошкам: • размер частиц должен быть очень маленьким по сравнению с размером капель; • частицы должны иметь определенный угол смачивания в системе "масло - вода - твердое вещество". Действие порошка преимущественно заключается в предотвращении утончения жидкой прослойки между каплями. Гладкие сферические частицы порошка непригодны; хорошие результаты получаются с пластинчатыми по форме частиц порошками, такими как бентонитовая глина. Твердые порошкообразные вещества (гипс, графит и др.) способны скапливаться на границе раздела капель и среды, благодаря избирательной смачиваемости твердых тел. Например, частицы гипса в эмульсии М/В благодаря своей гидрофильности почти полностью входят в воду и лишь частично в каплю масла, вследствие чего они окружают каплю масла сплошным слоем и препятствуют ее слипанию с другими каплями. Однако избирательное смачивание не должно быть полным, так как в этом случае частицы стабилизатора оказались бы целиком в водной фазе и капли масла оказались бы незащищенными. При неполном избирательном смачивании гидрофильных частиц (графит, ZnS, CuS и др.) они могут быть стабилизаторами эмульсий В/M. Таким образом, механизм действия порошков аналогичен механизму действия ПАВ. 5.2.6. ОПРЕДЕЛЕНИЕ ТИПА ЭМУЛЬСИИ В процессе получения эмульсии, особенно диспергационными методами, неизбежно образуются капли как одной, так и другой жидкости. Однако во времени капли одной жидкости сохраняются и постепенно накапливаются, капли другой практически мгновенно коалесцируют. Если накапливаются капли масла, образуется прямая эмульсия (М/В), если воды - образуется обратная эмульсия (В/M). Тип образующейся эмульсии зависит от целого ряда факторов, но во многом определяется природой эмульгатора. Следуя правилу Банкрофта, можно сказать, что та жидкость, которая лучше растворяет эмульгатор или лучше его смачивает (если это порошок), является дисперсионной средой. Таким образом, зная природу эмульгатора, можно предсказать тип образующейся эмульсии. Однако такая оценка весьма приблизительна, особенно если эмульсия многокомпонентна. Существует несколько экспериментальных методов определения типа эмульсий. МЕТОД РАЗБАВЛЕНИЯ В пробирку с водой вводят каплю эмульсии, которая при осторожном встряхивании равномерно распределяется в объеме воды в том случае, если это эмульсия типа М/В. Если же эмульсия обратная (В/M), то капля не диспергируется. Эта проба дает лучшие результаты в случае разбавленных эмульсий. МЕТОД СМАЧИВАНИЯ ГИДРОФОБНОЙ ПОВЕРХНОСТИ При нанесении капли эмульсии на парафиновую пластинку капля растекается, если дисперсионной средой является масло (эмульсия В/М). ОПРЕДЕЛЕНИЕ НЕПРЕРЫВНОЙ ФАЗЫ Каплю эмульсии помещают на предметное стекло микроскопа рядом с несколькими кристаллами растворенного в воде красителя. Пластинку наклоняют так, чтобы капля и краситель соприкасались. Если окажется, что непрерывная среда (вода) окрашивается, то это эмульсия типа М/В. В противном случае опыт повторяют с жирорастворимым красителем, доказывая, что эмульсия - типа В/M. Водорастворимыми красителями являются, например, метилоранж и брильянтовый синий, а маслорастворимым - судан III и фуксин. Эту пробу можно провести, если в пробирку налить некоторое количество эмульсии и добавить несколько кристаллов водорастворимого красителя. Равномерное окрашивание жидкости будет свидетельствовать, что это эмульсия типа М/В. Троннер и Бассюс (1960) развили этот метод. На кружки фильтровальной бумаги, смоченные 20%-м раствором хлорида кобальта и затем высушенные, они помещали каплю эмульсии. Эмульсия типа М/В вызывает быстрое появление розового окрашивания, с эмульсией В/M никаких цветовых изменений не наблюдалось. Если имеется смесь эмульсий М/В и В/M - медленно появляется слабо-розовое окрашивание. ИЗМЕРЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ В эмульсию помещают два электрода, соединенные с источником переменного тока и неоновой лампой. Если эмульсия типа М/В - неоновая лампа загорается, так как водная непрерывная среда обладает намного большей электропроводностью, чем масляная. 5.2.7. ОБРАЩЕНИЕ ФАЗ ЭМУЛЬСИИ Специфическим свойством большинства эмульсий является обращение фаз - изменение типа эмульсии. На обращение фаз влияют: • объемная концентрация компонента; • природа эмульгатора; • концентрация эмульгатора; • температура; • динамика процесса эмульгирования. Если к эмульсии М/В, стабилизированной мылом, добавлять водный раствор хлорида кальция, то эмульгатор переходит в кальциевую форму, и эмульсия обращается, т.е. масляная фаза становится дисперсионной средой, а водная - дисперсной фазой. Это объясняется тем, что кальциевое мыло значительно лучше растворяется в масле, чем в воде:
В процессе обращения фаз вначале образуются оба типа эмульсии, но затем становится преобладающей одна, более устойчивая система. При этом часто возникают сложные, множественные эмульсии: капелька масла, входящая в эмульсию М/В, может содержать в себе эмульсию В/M и т.д. Для обращения фаз известное значение имеет также соотношение объемов фаз. Обращение фаз эмульсий в определенных условиях может быть вызвано и длительным механическим воздействием. Так, сбивание сливок (М/В) ведет к получению сливочного масла, являющегося обычно эмульсией смешанного типа. 5.2.8. СПОСОБЫ РАЗРУШЕНИЯ ЭМУЛЬСИЙ Проблема дезмульгирования не менее важна, чем проблема получения эмульсий. Деэмульгирование лежит в основе многих технологических процессов, например, производства масла и сливок из молока, каучуков из латексов и т.д. На деэмульгировании основано обезвоживание сырой нефти, содержание воды в которой необходимо снизить с 10-60% до 1%, очистка сточных вод и многие другие важные процессы. Разрушение эмульсий может быть достигнуто двумя путями: седиментацией и коалесценцией. СЕДИМЕНТАЦИЯ Седиментация наблюдается, например, при отделении сливок от молока. При этом не происходит полного разрушения эмульсии, а образуются две эмульсии, одна из которых богаче дисперсной фазой. Так, в обычном молоке содержится 8-10% жира, а в сливках - 30-35%. Известно, что капля радиусом r и плотностью будет всплывать в более тяжелой жидкости с плотностью и вязкостью со скоростью , которая определяется уравнением Стокса
Если , то капля будет опускаться на дно под действием силы тяжести. Таким образом, осаждение капель в эмульсии - седиментация - есть следствие образования больших капель и большого различия в плотностях жидкостей. Для типичных эмульсий КОАЛЕСЦЕНЦИЯ Коалесценция - полное разрушение эмульсии, когда выделяются в чистом виде отдельные компоненты. При разрушении эмульсии имеют место две стадии: флокуляция и собственно коалесценция. На первой стадии капли дисперсной фазы образуют агрегаты, которые легко распадаются при слабом перемешивании. На второй стадии капли в агрегате сливаются в одну большую каплю. Этот процесс необратим в том смысле, что для разрушения больших капель на малые и воссоздания эмульсии требуется очень сильное перемешивание. Разделение фаз при коалесценции видно невооруженным глазом. ТЕХНИКА РАЗРУШЕНИЯ ЭМУЛЬСИЙ В промышленных масштабах эмульсии разрушают: • химическими методами; • термическими методами; • осаждением под действием силы тяжести или центробежных сил; • электрическими методами. Часто используют несколько методов одновременно. Химические методы разрушения. Действие этих методов заключается в удалении барьеров, препятствующих коалесценции. Химические вещества - деэмульгаторы нейтрализуют действие защитного слоя, например, сероуглерод и четыреххлористый углерод растворяют защитные пленки. Прямые эмульсии, стабилизированные эмульгаторами, можно разрушить добавлением электролитов с поливалентными ионами. Такие ионы не только сжимают ДЭС, но и переводят эмульгатор в малорастворимую в воде форму. Эмульгатор можно нейтрализовать другим эмульгатором, способствующим образованию эмульсии обратного типа. Можно добавить вещество более поверхностно-активное, чем эмульгатор, которое само не образует прочных пленок. Например, спирты (пентиловый, амиловый и т.д.) вытесняют эмульгаторы, растворяют их пленки и способствуют коалесценции. Для каждой эмульсии выбирается "свой" деэмульгатор, который оказывает оптимальное действие. Термические методы разрушения. Многие эмульсии можно разделить на составляющие их компоненты нагреванием до высокой температуры с последующим отстаиванием. Вероятно, нагревание ускоряет химические реакции, которые могут протекать в эмульсиях, изменяет природу поверхностного слоя, уменьшает вязкость. Таким образом, возникают условия, благоприятные для распада эмульсии. В процессе замораживания зарождаются кристаллы льда, которые затем растут, захватывая воду. Масляные капли (если эмульсия М/В) сжимаются. Кроме того, любая растворенная соль в отдельных участках эмульсии может кристаллизоваться. При этом разрываются оболочки, которые предотвращают коалесценцию. Противостоят замораживанию только эмульсии, в которых капли окружены жесткой оболочкой, например молочные сливки, но и они являются неустойчивыми при длительном хранении в условиях низкой температуры. ОСАЖДЕНИЕ ПОД ДЕЙСТВИЕМ СИЛЫ ТЯЖЕСТИ ИЛИ ЦЕНТРОБЕЖНЫХ СИЛ Грубые эмульсии, например нефтяные, содержат капли больших размеров. Для разделения жидкостей эмульсии выдерживают в отстойнике. Однако при этом мелкие капли остаются во взвешенном состоянии. Обычно время отстаивания составляет около 1 часа. Более эффективным является использование центрифуг. В них более тяжелая жидкость выталкивается к периферии и отводится, а более легкая жидкость собирается вблизи центра. Продолжительность операции составляет несколько минут. ЭЛЕКТРИЧЕСКИЕ МЕТОДЫ РАЗРУШЕНИЯ Эти методы применимы в двух случаях: • когда капли заряжены; • когда они электронейтральны, но приобретают дипольный момент, индуцируемый в постоянном или переменном электрическом поле. В последнем случае происходит коалесценция диполей. Разрушение эмульсий электрическими методами осуществляется в специальных аппаратах. 5.2.9. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭМУЛЬСИЙ Эмульсии имеют чрезвычайно широкое применение, причем не только созданные руками человека, но и природные, среди которых в первую очередь следует выделить молоко, предназначенное природой для вскармливания потомства и содержащее все необходимое для растущего организма, желток яйца, играющего аналогичную роль, млечный сок растений и т.д. Значение этих природных эмульсий трудно переоценить. Человек научился использовать их непосредственно, перерабатывать, получая из них массу продуктов и изделий. Но, вероятно, более важным является то, что человек, разобравшись в преимуществах эмульгированного состояния, смог искусственно получать эмульсии и использовать их в различных областях. Отметим основные из них. ПИЩЕВАЯ ПРОМЫШЛЕННОСТЬ Многие пищевые продукты являются эмульсиями. Это, в первую очередь, связано с тем, что жиры, являясь необходимой составной частью питания, нерастворимы в водной среде, поэтому они усваиваются организмом только в эмульгированном состоянии. Если же жир попадает в организм не в виде эмульсии, например, съели кусок свиного сала, то организм сам, растопив жир, проводит процесс эмульгирования, который происходит вначале в желудке, а затем - в двенадцатиперстной кишке, куда поступает желчь, содержащая холевые кислоты, являющиеся исключительно хорошими эмульгаторами. Понятно, что все это требует от организма дополнительной затраты энергии, избежать которой можно, используя в пищу эмульсии: сливочное масло, майонез, соусы и т.д. ФАРМАЦЕВТИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ Многие лекарства готовят в виде эмульсий, причем, как правило, внутрь принимают эмульсии М/В, а наружные средства представляют собой обратные эмульсии (В/М). ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ С эмульсиями имеют дело при проведении различных синтезов, эмульсии образуются также в экстракционных аппаратах, при процессах перемешивания. Эмульсии применяют для получения пористых органических сорбентов, мембран, пленок. К современным направлениям химической технологии относится эмульсионная полимеризация - полимеризация в каплях дисперсной фазы - основной метод получения каучуков, полистирола, поливинилхлорида, поливинилацетата, полиметилметакрилата и т.д. ЗАКЛЮЧЕНИЕ Эмульсии - это микрогетерогенные системы, состоящие из двух нерастворимых или ограниченно растворимых жидкостей (Ж/Ж). В зависимости от природы дисперсной фазы и дисперсионной среды эмульсии подразделяются на прямые (М/В) и обратные (В/M). Определить тип эмульсии можно исходя из того, что в первом случае непрерывной средой является вода, а во втором случае - масло, а это резко сказывается на электропроводности, природе растворяемых красителей и других свойствах. Большинство эмульсий относятся к лиофобным системам и являются термодинамически неустойчивыми. Для их стабилизации используются специальные вещества - эмульгаторы. В качестве эмульгаторов применяют неорганические электролиты, коллоидные ПАВ, ВМС, высокодисперсные порошки. Устойчивость эмульсий зависит от межфазового поверхностного натяжения. В тех случаях, когда по тем или иным причинам поверхностное натяжение мало, эмульсия образуется самопроизвольно (без эмульгатора) и является термодинамически устойчивой. От природы эмульгатора зависит не только устойчивость, но и тип образующейся эмульсии. При изменении природы эмульгатора может происходить обращение фаз эмульсии (переход М/В В зависимости от концентрации дисперсной фазы эмульсии делятся на разбавленные, концентрированные и высококонцентрированные. Разбавленные эмульсии по своим свойствам близки к лиофобным золям: • вследствие малых размеров частиц они седиментационно устойчивы; • проявляются молекулярно-кинетические свойства - броуновское движение, диффузия; • рассеивают падающий свет; • коагулируют (коалесцируют) под действием электролитов в соответствии с правилом Шульце-Гарди. Концентрированные эмульсии седиментационно неустойчивы - вследствие высокой концентрации капли находятся в контакте и легко наступает коалесценция. Устойчивость таких эмульсий зависит только от эмульгатора. Высококонцентрированные эмульсии - по своим свойствам сходны со структурированными коллоидными системами - гелями. Для разрушения эмульсий применяются седиментация, коалесценция, химические, термические, электрические методы. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие системы называются эмульсиями? Как они классифицируются? 2. Какие факторы агрегативной устойчивости эмульсии вы знаете? 3. Какие вы знаете типы эмульгаторов? Какие факторы устойчивости играют главную роль в случае разных эмульгаторов? 4. Сформулируйте правило Банкрофта. 5. Как определить тип эмульсии? 6. Что называется обращением фаз эмульсии? 7. Какие существуют методы разрушения эмульсии? 8. Перечислите области практического использования эмульсий. 9. Почему лекарственные препараты, предназначенные для наружного применения, готовят в виде обратных эмульсий, а принимаемые внутрь - в виде прямых эмульсий? Изучив содержание главы 16, вы должны знать: • классификацию эмульсий; • свойства разбавленных, концентрированных и высококонцентрированных эмульсий; • типы эмульгаторов и основные факторы устойчивости; • способы получения и разрушения эмульсий. 5.3. ГЛАВА 17. ПЕНЫ Пены - это грубодисперсные высококонцентрированные системы, в которых дисперсной фазой являются пузырьки газа, а дисперсионной средой - жидкость в виде тонких пленок. Условно пены обозначаются в виде дроби: Г/Ж. В приведенном выше определении термин "грубодисперсные" обозначает, что пузырьки газа могут иметь и макроразмеры вплоть до 10 см. Слово "высококонцентрированная" означает, что в системе концентрация пузырьков газа (Q) должна быть больше, чем 74% (объемных). В этом случае пузырьки газа имеют не сферическую форму, а форму многогранников. Если пена монодисперсна, т.е. все пузырьки газа имеют одинаковые размеры, то каждый пузырек газа имеет форму правильного пентагонального додекаэдра - двенадцатигранника, любая сторона которого представляет собой правильный пятиугольник (рис. 17.1 ). Многогранные пузырьки газа разделены тонкими прослойками жидкой дисперсионной среды. В зоне соприкосновения трех пленок, принадлежащих трем соприкасающимся пузырькам, образуется канал Плато (по имени известного бельгийского ученого Ж. Плато, занимавшегося исследованием устойчивости дисперсных систем), В плоскости рисунка (рис. 17.2 ) канал имеет форму зазора между тремя соприкасающимися цилиндрами - пузырьками газа. Так как натяжение пленок В каждой вершине многогранника (ячейки) сходятся четыре канала, образуя угол, равный 10928' (второе правило Плато). Место пересечения каналов называется узлом. Каналы пронизывают всю структуру пены, представляя собой цельную систему. Получается пространственная конструкция, в разрезе похожая на пчелиные соты. Такая пена характеризуется минимальной поверхностной энергией, следовательно, она наиболее устойчива. Если же пена полидисперсна (пузырьки газа имеют разные размеры), форма правильного пентагонального додекаэдра нарушается, что приводит к снижению устойчивости. Следует отметить, что если бы концентрация дисперсной фазы была меньше 74% (объемных) - пузырьки газа имели бы сферическую форму, и толщина жидких прослоек была бы соизмерима с размерами газовых пузырьков, мы имели бы систему, называемую газовой эмульсией. Примерами газовых эмульсий являются газированная вода, шампанское в бокале и т.д. Газовые эмульсии, в отличие от пен, являются бесструктурными системами. Несмотря на то, что пузырьки газа могут иметь макроразмеры, пена является микрогетерогенной системой. Это обусловлено тем, что дисперсионная среда (жидкость) хотя и является непрерывной, представляет собой тонкие пленки, имеющие микроразмеры (пленки часто обнаруживают интерференцию - радужную окраску, что показывает, что толщина пленки соизмерима с длиной световой волны). Это дало основание П.А. Ребиндеру определить пены как пластинчато-диспергированную жидкость в газе. 5.3.1. КЛАССИФИКАЦИЯ ПЕН Классификация пен часто основывается на такой важной характеристике как кратность пены:
где - объем пены, ГОСТ определяет условия, при которых следует определять кратность пены. В градуированный цилиндр емкостью 1000 следует налить 98 воды и 2 пенообразователя, закрыть пробкой и встряхивать в течение 30 с (двумя руками держать с торцов в горизонтальном положении и встряхивать вдоль оси цилиндра). Поставить на стол, вынуть пробку, измерить объем пены. Отношение объема пены к объему раствора (100 ) и есть кратность пены. Таким образом, кратность пены показывает, сколько объемов пены можно получить из одного объема жидкости. Если кратность пены В строительстве и производстве стройматериалов используют пены с от 5 до 10, в прачечных - с кратностью 5.3.2. МЕТОДЫ ПОЛУЧЕНИЯ ПЕН Установлено, что образование сколько-нибудь устойчивой пены в чистой жидкости невозможно. Пену можно получить только в присутствии специального вещества - стабилизатора, часто называемого пенообразователем. Основные стадии образования пены можно проследить на примере поведения нескольких пузырьков газа, всплывающих в воде, содержащей пенообразователь. В качестве пенообразователя возьмем ПАВ. Как только в таком растворе появятся пузырьки газа, на их поверхности начнут адсорбироваться молекулы ПАВ и образуют своеобразную "шубу", состоящую из одного слоя молекул. Всплывая, каждый пузырек достигает поверхности жидкости, давит на нее, растягивает и образует полусферический купол. Молекулы пенообразователя из раствора устремляются к растущей поверхности, адсорбируются на ней, предотвращая разрыв пленки жидкости. Таким образом, пузырек оказывается окруженным оболочкой уже из двух монослоев пенообразователя, между которыми находится пленка жидкости. Адсорбционные слои ПАВ обеспечивают длительное существование возникающих пленок. Увеличение числа пузырьков на поверхности раствора приводит к их сближению, при этом форма пузырьков постепенно переходит из сферической в многогранную, а толщина жидких перегородок уменьшается, возникают тонкие жидкие пленки. В результате на поверхности раствора сначала образуется монослой газовых пузырьков, затем формируются последующие слои, что приводит к возникновению объемной пены. В результате вся жидкость превращается в пену. Пену, как любую дисперсную систему, можно получить двумя путями: из грубодисперсных систем, используя диспергационные методы, и из истинных растворов с помощью конденсационных методов. ДИСПЕРГАЦИОННЫЕ МЕТОДЫ Эти методы основаны на дроблении газа на пузырьки при подаче его в раствор пенообразователя. Обычно небольшие порции газа вводят в раствор и дробят их до мелких пузырьков. Легче всего этого добиться, продувая газ через трубку, опущенную в жидкость. В промышленности обычно используют следующие принципы. 1. Прохождение струй газа через жидкость в аэрационных и барботажных установках, в аппаратах с "пенным слоем", в пеногенераторах с сеткой, орошаемой раствором пенообразователя, 2. Действием движущихся устройств на жидкость или движущейся жидкости на преграду (в технических аппаратах с быстроходными мешалками; при взбивании, встряхивании, переливании растворов). 3. Эжектирование (франц. ejection - выбрасывание) воздуха движущейся струей раствора в пеногенераторах. В настоящее время в технике пены готовят, в основном, диспергационными методами. Во всем мире непрерывно ведется разработка более эффективного оборудования. КОНДЕНСАЦИОННЫЕ МЕТОДЫ В этих случаях будущая газовая фаза вначале присутствует в виде отдельных молекул, из которых затем образуются пузырьки. Конденсационный способ ценообразования можно осуществить четырьмя путями. Первый путь - изменить параметры физического состояния системы: • понижая давление пара над раствором; • повышая температуру раствора. Этот метод почти мгновенного вспенивания служит наглядной иллюстрацией закона: растворимость газа в жидкости увеличивается при повышении давления и понижении температуры. Если снизить давление и увеличить температуру, газ, растворенный в жидкости, сразу начнет выделяться из нее и, если жидкость содержит пенообразователь, образуется пена. Стойкость пены зависит от свойств и концентрации пенообразователя. Так, лимонад почти не содержит веществ, которые могут играть роль пенообразователей, поэтому, когда мы наливаем его из бутылки в стакан, возникающая на поверхности жидкости пена почти мгновенно разрушается. Другое дело пиво, которое содержит много пенообразователей. Аналогичная картина наблюдается при кипячении жидкостей. Если кипящая жидкость содержит пенообразователь, то на ее поверхности образуется пена, объем и стойкость которой зависят от природы и концентрации пенообразователя. Достаточно сравнить кипящую воду и кипящее молоко - обильная пена, возникающая над последним, переливается через край кастрюли, попадает на раскаленную плиту и превращается в аэрозоль, который образуется из продуктов горения пены. Второй путь - провести химическую реакцию, сопровождающуюся выделением газа. Примерами могут служить взаимодействие соды с кислотой, пероксида водорода с перманганатом калия, разложение карбоната аммония. Этот путь используется при приготовлении пресного теста, когда в качестве разрыхлителя используют питьевую соду
Эти реакции протекают в кислой среде, поэтому в муку добавляют лимонную кислоту или смешивают с ней разрыхлитель, готовя так называемый пекарский порошок. Третий путь - использовать микробиологические процессы, сопровождающиеся выделением газов, чаще всего Таким путем получают дрожжевое тесто - под действием дрожжей идет спиртовое брожение гексоз:
Выделяющийся углекислый газ обусловливает разрыхление теста, оно увеличивается в объеме в несколько раз. При производстве пива углекислый газ также образуется в результате микробиологического процесса. Четвертый путь связан с электрохимическими процессами. При электролизе воды на катоде выделяется водород, а на аноде - кислород. За счет пузырьков газа в присутствии ПАВ, вводимого в раствор, образуется пена. Этот метод используется при электрофлотации. Конденсационные методы широко применяются в пищевой промышленности, при производстве пенопластмасс, в бытовых огнетушителях, в технологии производства пенобетона. 5.3.3. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ПЕН Для оценки свойств пены, а значит, ее пригодности для тех или иных целей существует много общих и специальных характеристик. Основные показатели: кратность пены; дисперсность пены; устойчивость во времени. ДИСПЕРСНОСТЬ ПЕНЫ Для оценки дисперсности пены используют: • средний радиус пузырька - радиус сферы, эквивалентной по объему пузырьку полиэдрической пены; • максимальное расстояние между противолежащими "стенками" пузырька (условный диаметр); • удельная поверхность раздела "жидкость-газ". Наиболее полно дисперсность пен характеризуется распределением пузырьков по размерам, например, по радиусу эквивалентной сферы. Экспериментальные данные представляют обычно в виде гистограмм. От дисперсности пены зависит скорость многих технологических процессов в микробиологической и химической промышленности, эффективность тушения пожаров, качество вспененной пластмассы, вкус мороженого и конфет. Поэтому определение дисперсности является обязательным почти для всех производств, использующих пены. Существуют следующие методы определения дисперсности пен. Микрофотографирование пены - метод прямого определения размеров пузырьков. Фотосъемку ведут в отраженном или проходящем свете при увеличении в 10-100 раз. Пены, в которых размер пузырьков быстро изменяется, предварительно замораживают жидким кислородом или азотом. Определение дисперсности пены по электропроводности. Измеряют электрическое сопротивление цилиндрического столба однородной пены, заключенного между двумя пористыми пластинками. Определение дисперсности пены путем измерения ее удельной поверхности. Удельная поверхность - это площадь поверхности пузырьков в 1 или в 1 г пеномассы. Ее определение основано на измерении различных параметров пены. ВРЕМЯ СУЩЕСТВОВАНИЯ ПЕНЫ Для характеристики пены часто приводят время, которое проходит с момента образования пены до ее самопроизвольного разрушения. Иногда определяют время разрушения половины объема пены. Пену также характеризуют временем жизни отдельного пузырька газа на поверхности жидкости, из которой он образовался. Однако эта характеристика пены весьма относительна, так как время жизни отдельного пузырька газа может значительно отличаться от времени жизни его в пене. 5.3.4. СВОЙСТВА ПЕНЫ СТРУКТУРНО-МЕХАНИЧЕСКИЕ (РЕОЛОГИЧЕСКИЕ) СВОЙСТВА К наиболее важным реологическим характеристикам пены относятся предельное напряжение сдвига и вязкость, поскольку течение пены - составная часть многих процессов при получении и применении пен (подземное пожаротушение, получение вспененных полимерных материалов и замороженной пены, пылеулавливание и т.д.). Предельное напряжение сдвига. Его часто выражают через жесткость, которая характеризует способность пены воспринимать определенные механические нагрузки, например, давление вышележащего столба пены без деформации, т.е. изменения объема или формы. Пены обладают некоторой жесткостью, даже если их пленки жидкие. Это объясняется тем, что состояние равновесия отвечает минимальной поверхностной энергии, а любая деформация увеличивает эту энергию, т.е. требует внешней работы. Жесткость пен особенно разительна, если принять во внимание их низкую плотность: водная пена с пузырьками диаметром 1 см и с пленками толщиной см имеет плотность около 0,003 г/. Вязкость пены. Вязкость - это реологическая характеристика, знание которой позволяет определять условия перекачивания пены по трубам, растекаемость пенной массы по поверхности (например, при тушении пожара), способность к свободному истечению из отверстий. Значения структурной (эффективной) вязкости, получаемые разными исследователями, изменяются в широком интервале в зависимости от кратности и дисперсности пен и от напряжения сдвига (скоростей течения). По данным Венцеля, вязкость пен кратностью 100-400 изменялась от 0,7 до 2,0 ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ ПЕНЫ Электропроводной в пене является только жидкая фаза, поэтому удельная электропроводность пены NV зависит от содержания жидкой фазы и ее удельной электропроводности
где n - кратность пены, В - коэффициент формы, зависящий от кратности пены и распределения жидкой фазы между каналами и пленками в пене. Экспериментально установлено, что он монотонно увеличивается от 1,5 до 3,0 при возрастании кратности пены. ОПТИЧЕСКИЕ СВОЙСТВА ПЕН Ослабление светового потока, проходящего через слой пены, происходит в результате рассеяния света и поглощения его раствором. Однако в полиэдрической пене доля жидкости в общем объеме весьма мала, поэтому интенсивность светового потока уменьшается практически лишь в результате рассеяния. В такой пене поверхности раздела фаз относятся к трем четко выраженным и различающимся по оптическим свойствам структурным элементам: пленкам, каналам Плато и узлам. Ослабление светового потока определяется отношением 5.3.5. УСТОЙЧИВОСТЬ ПЕНЫ Пены, как и другие дисперсные системы, являются термодинамически неустойчивыми системами. Их образование сопровождается увеличением свободной энергии. Избыточная энергия вызывает самопроизвольные процессы, которые ведут к уменьшению дисперсности и разрушению ее как дисперсной системы. Минимальное значение свободной энергии достигается при полном разделении пены на две сплошные фазы: жидкость и газ. Пленки пены лопаются, потому что площадь (и, следовательно, поверхностная энергия) полученных капель меньше площади первоначальной системы. У пузырька радиусом 1 см и толщиной стенок см площадь поверхности равна 25 , а капля жидкости, которая образуется при разрушении этого пузырька, имеет площадь всего ~0,1 . Разность энергии так велика, что когда пленка лопается, образовавшаяся капелька жидкости летит со скоростью 1000 см/с. Таким образом, пены обладают только относительной устойчивостью, которая подразделяется на два вида: • кинетическая (седиментационная) устойчивость - способность системы сохранять неизменным во времени распределение частиц дисперсной фазы в объеме системы, т.е. способность системы противостоять силе тяжести; • агрегативная устойчивость - способность сохранять неизменными размеры частиц дисперсной фазы (дисперсность) и их индивидуальность. АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ ПЕНЫ Реальная пена, как правило, является полидисперсной, т.е. пузырьки газа в ней имеют разные размеры. Чем меньше пузырек газа, тем больше в нем давление. Следовательно, во времени самопроизвольно идет процесс диффузии газа из маленьких пузырьков в большие, при этом маленькие пузырьки становятся еще меньше, а большие - увеличиваются, что приводит к изменению стабильности пены - говорят, "пена стареет". Чем больше различия в размерах пузырьков (больше степень полидисперсности), тем сильнее проявляется диффузия газа. Кроме степени полидисперсности на скорость диффузионного разрушения пены влияют: • растворимость газа в жидкой пленке; • коэффициент диффузии газа в жидкой пленке - для большинства газов, которые используются для получения пен, он равен • толщина жидких пленок; • поверхностное натяжение раствора пенообразователя. Экспериментальные данные показывают, что диффузия газа в пене - процесс относительно медленный, и можно утверждать, что пены являются относительно агрегативно устойчивыми. СЕДИМЕНТАЦИОННАЯ УСТОЙЧИВОСТЬ Нарушение седиментационной устойчивости пен связано с процессом самопроизвольного стекания жидкости в пленке пены, что приводит к ее утончению и, в конце концов, к разрыву. Этот процесс вызывается действием сил гравитации и капиллярных сил всасывания. Жидкость стекает по каналам Плато. Если сосуд наполнить пеной и оставить на некоторое время, то постепенно на дне собирается слой жидкости, который будет расти до тех пор, пока в пленках пены не останется совсем мало жидкости или пока пленки не лопнут. Истечение жидкости из пены может происходить и вследствие капиллярного всасывания (всасывание через границы Плато). Стенка между соприкасающимися пузырьками одинакового размера в пене плоская, это своего рода плоский капилляр, поэтому жидкость, заполняющая стенку, находится под таким же давлением, как и газ в двух пузырьках. Однако поверхность "жидкость-воздух" вблизи места соединения трех пузырьков (граница Плато) вогнута по отношению к воздушной фазе. Следовательно, жидкость на границе Плато находится под отрицательным капиллярным давлением, и перепад давления гонит жидкость из плоской стенки между пузырьками к границе Плато. Процесс истечения жидкости из пленки очень сложен и не может быть описан простым математическим уравнением. Утончение пленок возможно не только в результате вытекания жидкости, но и при ее испарении. Большая поверхность пены этому способствует, а замкнутость газовых пузырьков тормозит этот процесс. Разрыв пленки, по Дерягину, включает три стадии: • постепенное утончение всей пленки; • скачкообразное появление отдельных участков меньшей толщины, чем толщина всей пленки; • образование на этих участках отверстий, расширяющихся с большой скоростью. ФАКТОРЫ, ВЛИЯЮЩИЕ НА УСТОЙЧИВОСТЬ ПЕНЫ Эти факторы можно разделить на три группы. 1. Факторы, связанные с наличием пенообразователя. В качестве пенообразователей обычно используются: • коллоидные ПАВ; • ВМС. Обычно в качестве пенообразователей используются средние члены гомологических рядов, причем анионные ПАВ лучше, чем катионные и неионогенные. Лучшими пенообразователями среди ВМС являются полиэлектролиты, например белки, Установлено, что большей пенообразующей способностью обладают те пенообразователи, которые способны стабилизировать эмульсии I рода. Под пенообразующей способностью понимают объем пены, получающийся при данных условиях (t, концентрация ПАВ, способ пенообразования) из определенного объема раствора. Важную роль играет концентрация пенообразователя. Для пенообразователей - коллоидных ПАВ максимальная пенообразующая способность достигается в определенном интервале концентраций, при дальнейшем росте концентрации она остается постоянной или даже снижается. В случае ВМС с увеличением концентрации пенообразующая способность возрастает. 2. Факторы, связанные со свойствами дисперсионной среды. Дисперсионную среду в пене характеризуют обычно следующими параметрами: вязкостью - чем больше вязкость, тем устойчивее пена; водородным показателем рН; наличием в жидкости низкомолекулярных электролитов. Два последних параметра определяют состояние и свойства пенообразователя. Так, жирные кислоты и их щелочные соли в кислой среде практически не образуют пену. Максимальное ценообразование обычно наблюдается при Пенообразующая способность неионогенных ПАВ не зависит от рН в интервале 3-9. Белковые растворы проявляют максимальную пенообразующую способность в изоэлектрической точке. Растворы желатина и лактальбумина имеют максимальную вспениваемость при рН = 4,5. При рН ~2 их пенообразующая способность также несколько повышается. Увеличение вспениваемости растворов желатина наблюдается в щелочной среде. В жесткой воде (т.е. в присутствии большого количества солей) кратность и устойчивость пен невысока, а в морской воде она совсем низкая. 3. Факторы, связанные с внешними воздействиями: • температура; • испарение жидкости из пены; • механическое воздействие - сотрясение, ветер и т.д. Повышение температуры отрицательно влияет на устойчивость пены, так как: • усиливает десорбцию молекул пенообразователя; • ускоряет испарение жидкости из пленки; • понижает вязкость жидкости в пленке. Однако для некоторых пен, стабилизированных ВМС (тесто, белковая пена), термическая обработка приводит к переходу жидкой дисперсионной среды в твердообразную, образуется твердая пена, что делает пену практически абсолютно устойчивой. Механические воздействия отрицательно влияют на устойчивость пены, так как: • происходит механическое разрушение структуры пены; • усиливается испарение жидкости из пленки. Все перечисленные факторы не затрагивали природы газа, так как поведение газа в составе пены мало зависит от его химической природы, за исключением растворимости некоторых газов в жидкостях, что важно для агрегативной устойчивости пен. МЕХАНИЗМ УСТОЙЧИВОСТИ ПЕНЫ При объяснении относительной устойчивости пен обычно исходят из трех факторов: кинетического; структурно-механического; термодинамического. Кинетический фактор устойчивости заметно проявляется только в малоустойчивых пенах; его часто называют эффектом самозалечивания или эффектом Марангони. Суть его заключается в том, что утончение пленки вследствие истечения жидкости в пленке происходит неравномерно. Отдельные участки пленки вокруг газового пузырька становятся очень тонкими, растягиваются, это приводит к уменьшению концентрации ПАВ на их поверхности и, следовательно, к увеличению поверхностного натяжения. Вследствие этого раствор с повышенной концентрацией ПАВ из этой зоны низкого поверхностного натяжения, т.е. с участков с утолщенной пленкой, устремляется к истонченным зонам. Истонченные участки пленки самопроизвольно залечиваются, т.е. утолщаются. Время, за которое происходит такое перетеканке раствора, измеряется сотыми и даже тысячными долями секунды, поэтому вероятность разрыва пленки понижается и устойчивость возрастает. Подтверждением этому служат наблюдения Дюпре: твердые вещества (свинцовая дробь) и капли жидкости (ртуть) могут пройти через пленку пены, не оставив разрыва. Однако после длительной сушки пленки (высыхание пены), когда количество жидкости в ней сильно уменьшается, и перетекание раствора ПАВ становится невозможным, каждый такой "снаряд" вызывает разрыв. Скорость поверхностного переноса ПАВ зависит от: • значения поверхностного натяжения раствора ПАВ; • разности концентрации в тонком и утолщенном участках. В очень тонких пленках, состоящих из двух адсорбционных слоев, эффект "залечивания" проявляется слабо. Структурно-механический фактор устойчивости пен связан со специфическим упрочнением тонких пленок за счет гидратации адсорбированных слоев, а также за счет повышения вязкости межпленочной жидкости. Взаимодействие полярной группы молекул ПАВ с водой ограничивает истечение межпленочной жидкости из среднего слоя "сэндвича" пленки под действием сил тяжести и капиллярных сил. В самом адсорбционном слое гидратированные молекулы ПАВ сцепляются между собой, в результате повышается прочность на растяжение и адсорбционных слоев и пленки в целом. Для повышения вязкости межпленочной жидкости в ПАВ добавляют некоторые специальные вещества: например, в присутствии тысячных долей процента жирного спирта вязкость раствора ПАВ увеличивается в десятки раз. Структурно-механический фактор обычно рассматривают во взаимодействии с кинетическим и термодинамическим факторами устойчивости. Термодинамический фактор устойчивости часто называют расклинивающим давлением. Он проявляется в тонких пленках, когда возникает избыточное давление, препятствующие их утончению под действием внешних сил. Причиной расклинивающего давления в пленках пены, стабилизированных ионогенными веществами, является отталкивание двойных электрических слоев, образованных ионами пенообразователя в растворе около поверхностей пленок, т.е. реализуется электростатическая составляющая расклинивающего давления. В заключение отметим, что чисто термодинамический фактор устойчивости недостаточен для обеспечения устойчивости пены, необходимо учитывать и другие факторы, рассмотренные выше. СТАБИЛИЗАЦИЯ ПЕН СПЕЦИАЛЬНЫМИ ДОБАВКАМИ Этот метод предусматривает добавление в растворы ПАВ стабилизаторов. Их действие основано на увеличении вязкости растворов и замедлении за счет этого истечения жидкости из пен. Другими словами, к действию кинетического фактора устойчивости, характерного для пенобразователей - ПАВ, добавляется структурно-механический фактор. Все стабилизаторы можно подразделить на пять групп. 1. Вещества, повышающие вязкость самого пенообразующего раствора, их называют загустителями. Их добавляют в больших концентрациях. Это глицерин, этиленгликоль, метилцеллюлоза. Производные целлюлозы уже в количестве 1-2% увеличивают вязкость раствора и устойчивость пены в десятки раз, а глицерин эффективен только при концентрации 15-20%. 2. Вещества, вызывающие образование в пленках жидкости коллоидных частиц. В результате очень сильно замедляется обезвоживание пленок. Коллоидные стабилизаторы являются более эффективными, чем вещества первой группы. К ним относятся: желатин, клей, крахмал, агар-агар. Эти вещества, взятые в количестве 0,2-0,3% от массы ПАВ, увеличивают вязкость жидкости в пленках более, чем в 100 раз, а устойчивость пен возрастает в 2-8 раз. 3. Вещества, полимеризующиеся в объеме пены. Полимеризация сильно увеличивает прочность пленок; возможен даже их переход в твердое состояние. Это наиболее эффективные стабилизаторы. Это могут быть полимерные композиции - синтетические смолы, например, карбамидные или латексы. 4. Вещества, образующие с пенообразователем нерастворимые в воде высокодисперсные осадки. Такие вещества бронируют пленки и препятствуют их разрушению. Это наиболее дешевые и широко распространенные стабилизаторы. К ним относятся соли тяжелых металлов: железа, меди, бария, реже алюминия. В пены вводят очень небольшие добавки этих веществ. 5. Вещества, участвующие в построении адсорбционных слоев на границе раздела "жидкость-газ". Главные представители - жирные спирты, в основном, тетрадециловый спирт. Введение всего 0,05% спирта в растворы пенообразователей сильно снижает поверхностное натяжение, что приводит к повышению устойчивости пен. Ту или иную группу стабилизаторов выбирают в зависимости от требований к стойкости пены и технологических условий производства. Например, на кондитерских фабриках для изготовления пастилы, халвы, конфет нужны высокостойкие пены, а добавки должны быть съедобными и не должны ухудшать вкус изделий. Этим требованиям удовлетворяют стабилизаторы второй группы. При производстве теплоизоляционных материалов стремятся получить твердые пены, в этом случае эффективны стабилизаторы третьей группы. ТРЕХФАЗНЫЕ ПЕНЫ Тонкоизмельченные твердые вещества - талые, асбест, кварц, сажа при равномерном распределении на поверхности пузырьков упрочняют пленки и продлевают жизнь пены. Такие пены называют минерализованными. Образование такой пены происходит за счет прилипания твердых минеральных частиц к пузырькам пены, обусловленного взаимодействием между поверхностью твердой частицы и полярными группами ПАВ. Большое влияние на бронирование оказывает размер твердых частиц, а также соотношение размеров зерна и газового пузырька - тонкие порошки твердых веществ дают прочные пленки пены, совместное присутствие крупных и мелких твердых частиц уменьшает прочность пены. Предпочтительным для минерализации пены является большое различие в размерах воздушного пузырька и твердой частицы и неупругое соударение их при встрече, так как прилипание тем эффективнее, чем значительнее потеря кинетической энергии. Механизм стабилизации трехфазных пен (газ - жидкость - твердые частицы) объясняют, в первую очередь, сужением каналов Плато. В результате уменьшения диаметра канала скорость истечения раствора уменьшается и пробки из зерен, не прилипших к пузырькам, дополнительно закупоривают эти каналы. Теоретические основы стабилизации пен и пути ее достижения составляют сложный раздел коллоидной химии. Пока еще нет достаточных данных для создания единой теории устойчивости пен, и мы ограничились лишь качественным изложением существующих взглядов. 5.3.6. МЕТОДЫ РАЗРУШЕНИЯ ПЕН Разрушить пену - казалось бы, что может быть проще? Легкое дуновение ветерка - и трепещущие хлопья пены у линии морского прибоя исчезли. Но когда многометровый пенный вал ползет из вакуум-фильтров на целлюлозных фабриках или из резервуаров на станциях биологической очистки сточных вод, никаким "дуновением ветерка" с такой пеной не совладать. Пену нужно обязательно уничтожать при производстве антибиотиков и других лекарственных препаратов, бумаги, сахара, дрожжей, пива, томатного сока, при очистке сточных вод, при обработке пряжи и тканей и во многих других случаях. Способы пгногашеиия столь же многообразны, как и способы получения пены. Возможны два пути борьбы c пеной: предупреждение пенообразования; разрушение образовавшейся пены. ПРЕДУПРЕЖДЕНИЕ ЦЕНООБРАЗОВАНИЯ Для предупреждения пенообразования используют, прежде всего, химические способы, т.е. применяют вещества, препятствующие образованию пены. К сожалению, эти вещества часто загрязняют конечную продукцию или затрудняют технологический процесс. Для предупреждения вспенивания смазочных масел, олифы, массы для производства бумаги используют спирты - изоамиловый, октиловый, цетиловый, глицерин, а также некоторые кремнийорганические соединения. Широко используется эффект ограниченного пенообразования при совместном применении двух ПАВ. Если в обильную душистую пену, полученную с помощью шампуня для ванн, добавить немного мыльной пены, произойдет пеногашение: объем пены уменьшится в несколько раз, хотя моющая способность раствора останется высокой. А если в ванну с водой одновременно налить шампунь и положить кусочек мыла, то пены образуется совсем мало. Другое направление - удаление из технологических растворов, содержащих ПАВ, стабилизаторов пен. При этом устойчивость пены резко снижается и она самопроизвольно разрушается. Например, при получении дрожжей из жидкостей на основе патоки из сырья удаляют коллоиды, являющиеся эффективными стабилизаторами пены. Для этого раствор обрабатывают бентонитовыми глинами. Если ввести в патоку всего 2% бентонита, устойчивость пены снизится в 6 раз, а объем пены - в 40 раз. Таким же способом борются с обильным пенообразованием при производстве растворимого кофе. Стабилизатором пены в этом случае являются ионы металлов, их удаляют из раствора кофе с помощью синтетических ионообменных смол или природных цеолитов. Еще одно направление - изменение режима технологического процесса, параметров технических аппаратов. Например, известно, что при равных объемах аппарата, чем больше диаметр сосуда, тем меньше высота столба пены и тем менее она устойчива. СПОСОБЫ РАЗРУШЕНИЯ ПЕНЫ Все известные способы можно подразделить на две группы - химические и нехимические. Химические пеногасители (антивспениватели). Вещества для химического пеногашения должны отвечать следующим требованиям: • быстро гасить пену уже при малых концентрациях и длительное время препятствовать новому вспениванию растворов; • не изменять свойств перерабатываемых и вновь получаемых веществ, а также не замедлять технологический процесс и не снижать производительность оборудования; • не изменять свои свойства при хранении, а также при нагревании в процессе пеногашения. Многие производства предъявляют к химическим пеногасителям и особые требования, например, в пищевой промышленности они должны быть нетоксичными, а в микробиологической промышленности - стерильными. Для пеногасителей характерна специфичность действия: вещества, вызывающие гашение пены в одной среде, оказываются малоэффективными в другой. В качестве пеногасителей применяют природные жиры и масла, органические кислоты, кремнийорганические соединения, силиконовые масла, спирты, эфиры, неорганические вещества. В производстве сахара и спиртов для пищевых целей используют подсолнечное, оливковое, касторовое масла, в производстве дрожжей - масло вазелиновое, при проведении ферментации - свиной жир. Кроме того, в пищевой и фармацевтической промышленности широко применяются искусственно синтезируемые эфиры - этилацетат, винилацетат, а также кремнийорганические соединения. Пеногашение при обработке сточных вод, растворов моющих средств, буровых растворов осуществляют с помощью спиртов, стеариновой кислоты, фосфорорганических соединений (например, трибутилфосфата), извести, а также отходов промышленности. Наиболее широкое распространение получили пеногасители из семейства кремнийорганических высокомолекулярных соединений - они устойчивы, химически инертны, дешевы, эффективны при высоких температурах. Вещества-антивспениватели можно подразделить на две группы. К первой группе относятся вещества, принцип пеногасящего действия которых основан на взаимодействии их с пенообразователем с образованием нерастворимых или малорастворимых соединений. Так, при добавлении растворимых солей кальция или алюминия к пенообразующему раствору натриевых или калиевых солей жирных кислот или катионных ПАВ образуются нерастворимые соединения, и пена разрушается. Чем менее растворимы образующиеся соединения, тем более эффективен антивспениватель. Наиболее эффективным способом применения антивспенивателей этой группы является подача их в виде пены. Например, пену, стабилизированную катионными ПАВ, подают на подлежащую разрушению пену из раствора анионного ПАВ. К недостаткам антивспенивателей этой группы следует отнести большой расход вещества. Кроме того, образование нерастворимых соединений часто оказывается неприемлемым по условиям производства. Ко второй группе антивспенивателей, более многочисленной, относятся вещества, химически не взаимодействующие с пенообразователем. Они разрушают пену в результате развития различных физических процессов. Механизм действия этих антивспенивателей более сложен. Их эффективность зависит от физико-химических параметров, определяющих свойства пенных пленок. Нехимические способы разрушения пен делятся на: • физические; • механические. Физические способы погашения: • термические (пены разрушаются при нагревании); • акустические (воздействие ультразвуком); • электрические (разрушение под действием электрического поля). Наиболее старый и распространенный способ - термический. При нагревании происходит испарение жидкости из пленки пены, что обеспечивает их разрыв. Этот принцип используется для пеногашения при сахароварении, при очистке сточных вод, при производстве бумаги и т.д. Температуру регулируют таким образом, чтобы она была выше температуры кипения растворителя, но не оказывала вредного влияния на конечный продукт производства. Акустический способ применяют для гашения пены в промышленных аппаратах небольшого объема: при производстве растворимого кофе, красителей и т.д. Из физических методов он является наиболее перспективным. Первые публикации о возможности использовать ультразвук появились в 1940-1950 гг. Но только в последнее время с появлением мощных и экономичных акустических генераторов стали разрушать пену на промышленных установках большой мощности. При использовании этого метода очень важно правильно подобрать частоту звука. Акустический метод не всегда надежен, его нельзя использовать для разрушения быстро поднимающихся пен. Существуют два типа промышленных устройств акустического пеногашения. Один из них предназначен для ликвидации пены в трубопроводах на выходе из резервуара. Генератор со свистком создает в небольшом пространстве сильное акустическое поле, разрушающее пену. Устройство для звукового пеногашения второго типа - это звуковые сирены. Пневматические или электрические сирены создают мощные звуковые излучения либо горизонтально над поверхностью жидкости, либо перпендикулярно к ее поверхности в смесителях, ферментационных сосудах и т.д. В последнее время установлена способность радиоактивного излучения (нейтронов, б-частиц) разрушать пленки пены. Такое пеногашение не требует энергетических затрат, пеногасящее устройство невелико по размерам, легко может быть вмонтировано в технологическое оборудование и не требует никакого обслуживания. Однако этот способ пеногашения непригоден для пищевой, фармацевтической и некоторых других отраслей промышленности. Проходят также промышленные испытания пеногашения с помощью электрического разряда непосредственно в пене. Подача высокоимпульсного напряжения вызывает почти мгновенное оседание пены. При этом легко разрушаются даже высокостойкие белковые пены. Однако применение этого метода требует надежных мер безопасности, так как должно использоваться очень высокое напряжение, а пены обладают достаточно высокой электрической проводимостью. Механические способы пеногашения разнообразны. Для этого служат специальные устройства: диспергаторы, сетки и крыльчатки, струи пара или воздуха, вакуумные устройства и т.д. По характеру воздействия на пену механические способы могут быть центробежными (движущая пена разрушается, ударяясь о неподвижную поверхность), гидродинамическими и аэродинамическими (пена разрушается струей жидкости или газа, выбрасываемыми под давлением), барометрическими (пена разрушается в результате изменения давления в аппаратах). Недостатками механических способов являются: • малая эффективность при разрушении высокоустойчивых низкократных пен; • сложность и громоздкость оборудования; • большой расход энергии. Кроме того, механические способы пеногашения обычно только понижают объем и кратность пены, но не разрушают ее полностью. Итак, для разрушения пен разработаны десятки различных способов пеногашения, сотни промышленных аппаратов и устройств. Выбор того или иного способа гашения определяется: • стойкостью пены; • технологическими требованиями; • экономическими показателями. 5.3.7. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ПЕН Область применения пен необъятна. Ограничимся только перечислением наиболее популярных из них. 1. Многие пищевые продукты представляют собой пены: хлебобулочные изделия, кремы, муссы, торты, конфеты, взбитые сливки, коктейли, мороженое и др. 2. Пеносушка - сушка с предварительным вспениванием, обеспечивает получение сухих продуктов с тонкой структурой, которая определяется геометрическими размерами ячеек пены. Пеносушка используется при производстве сухого картофельного пюре, кофе, овощных и фруктовых пюре, соков, порошков для приготовления шипучих напитков, казеинатов, кормовых дрожжей и т.д. 3. Многие лекарства мы принимаем в виде пен. 4. В химической промышленности используются эффективные пенные аппараты для проведения процессов в газожидкостных системах: адсорбции, десорбции, испарения, конденсации, сушки, очистки газов. Большая скорость процессов достигается увеличением поверхности контактирующих фаз. ЗАКЛЮЧЕНИЕ Пены - это грубодисперсные высококонцентрированные системы, в которых дисперсной фазой являются пузырьки газа, а дисперсионной средой - жидкость в виде тонких пленок. Концентрация пузырьков газа должна быть более 74% (объемных). Классификация пен часто основывается на их кратности : если меньше 10 - пены называют жидкими, если Основными характеристиками пен являются: кратность, дисперсность, устойчивость во времени. В пенах пузырьки газа прижаты друг к другу тонкой прослойкой дисперсионной среды - пенными пленками. Система находится в устойчивом равновесии, когда контакт осуществляется между тремя пузырьками. Пленки жидкости между этими пузырьками образуют треугольник Плато, углы между пленками примерно 120. В местах, где стыкуются пленки, образуются утолщения, называемые каналами. Пены являются типичными лиофобными системами. Термодинамически они не устойчивы. В них протекают следующие процессы, ведущие к изменению строения и постепенному разрушению пены. 1. Диффузионный перенос газа из мелких пузырьков в более крупные и из поверхностных пузырьков во внешнюю среду. В этом проявляется агрегативная неустойчивость. 2. Отекание дисперсионной среды под действием силы тяжести. В этом состоит седиментационная неустойчивость пен. 3. Указанные процессы ведут к утончению пенных пленок и их постепенному разрушению. Устойчивыми пены получаются только в присутствии специальных веществ - пенообразователей. В качестве пенообразователей обычно используются: • коллоидные ПАВ; • ВМС. Адсорбционные слои, образуемые этими веществами, стабилизируют пенные пленки, замедляя вытекание из них жидкости. Основные свойства пены: • структурно-механические (предельное напряжение сдвига и вязкость); • оптические (рассеяние и поглощение света); • электрическая проводимость. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие системы называются пенами? Как они обозначаются? 2. Как классифицируются пены? Что называется кратностью пены? 3. С помощью каких величин оценивают дисперсность пены? Какие существуют методы определения дисперсности? 4. Являются ли пены термодинамически устойчивыми системами? 5. В чем заключается седиментационная устойчивость пены? 6. Что понимается под агрегативной устойчивостью пены? 7. Какие вещества используют в качестве пенообразователей? 8. Какие вы знаете факторы устойчивости пены? 9. Как можно предотвратить образование пены в технологическом процессе? 10. Какие существуют методы разрушения пен? Изучив содержание главы 17, вы должны знать: • структуру пен, их седиментационную и агрегативную устойчивость; • факторы устойчивости пен; • основные пенообразователи и способы разрушения пен; • способы получения и разрушения пен. 5.4. ГЛАВА 18. АЭРОЗОЛИ Аэрозолем называется микрогетерогенная система, в которой частички твердого вещества или капельки жидкости взвешены в газе. Условное обозначение аэрозолей: Т/Г или Ж/Г. Чтобы было ясно, насколько важным является этот вид дисперсных систем, приведем примеры аэрозолей. Космическое пространство, атмосфера Земли, воздух, которым мы дышим, - все это аэрозоли. Аэрозоли возникают естественным путем, образуются искусственно и сопутствуют промышленному производству. Ветер поднимает и разносит облака пыли, создавая пыльные бури. Пыль может подниматься на высоту 5-6 км и переноситься на расстояния, измеряемые тысячами километров. В Норвегии, например, была обнаружена пыль пустыни Сахара. При извержении вулканов, а их на Земле более 600, в атмосферу выбрасывается несколько десятков миллионов тонн грунта, большая часть которого переходит в аэрозольное состояние. Так, в результате гигантского извержения вулкана Тамбора в Индонезии в 1815 г. в стратосферу было выброшено такое количество пыли, что следующий, 1816 г., вошел в историю как "год без лета". Микроорганизмы, вирусы и споры растений подхватываются потоком воздуха и образуют аэрозоли. Споры плесени и дрожжей находят в атмосфере на высоте свыше 11 км. Аэрозоли биологического происхождения переносятся на огромные расстояния - были отмечены случаи, когда споры грибов были обнаружены над Карибским морем в 1000 км от ближайшего возможного места их образования. Вода, испаряемая с водной поверхности Земли, образует аэрозоли, разрушение которых приводит к возникновению дождя, снега, града. До 30% всех естественных аэрозолей дает космическая пыль. Все это - аэрозоли, которые возникают естественным путем, без участия человека. Около 10% всех аэрозолей получается искусственно: это распыление ядохимикатов и удобрений, орошение, бытовые аэрозоли и т.д. И, наконец, третья группа аэрозолей - это промышленные аэрозоли. В шахтах, карьерах для добычи полезных ископаемых, около металлургических и химических комбинатов, при работе различных агрегатов (дробилок, мельниц, многочисленных котельных) образуются аэрозоли, загрязняющие воздух. Все виды наземного, воздушного и водного транспорта являются источниками аэрозолей за счет сгорания топлива. Достаточно отметить, что в результате сгорания топлива ежегодно выбрасывается в атмосферу более 100 т твердых и 1 млн т газообразных веществ. Производство ядерного топлива, эксплуатация атомных электростанций, испытания ядерного оружия приводят к образованию радиоактивных аэрозолей. Таковы основные источники образования аэрозолей. Ежегодно в среднем 1 5.4.1. КЛАССИФИКАЦИЯ АЭРОЗОЛЕЙ 1. По агрегатному состоянию дисперсной фазы: туман (Ж/Г); дым, пыль (Т/Г); смог (Ж+Т)/Г [Smog] = Smoke (дым) + fog (туман) 2. По дисперсности: туман (Ж/Г), см; дым (Т/Г), пыль Т/Г, d > см. 3. По методам получения: конденсационные; диспергационные. 5.4.2. МЕТОДЫ ПОЛУЧЕНИЯ АЭРОЗОЛЕЙ Как и другие микрогетерогенные системы, аэрозоли могут быть получены двумя разными путями: из грубо-дисперсных систем (диспергационные методы) и из истинных растворов (конденсационные методы). КОНДЕНСАЦИОННЫЕ МЕТОДЫ Эти методы связаны с образованием в гомогенной системе новой фазы. Обязательным условием ее образования является наличие пересыщенного пара, конденсация которого и приводит к образованию частиц дисперсной фазы. Объемная конденсация пересыщенного пара может происходить в трех случаях: при адиабатическом расширении; при смешении паров и газов, имеющих разные температуры; при охлаждении газовой смеси. 1. Адиабатическое расширение газа. Таким путем образуются облака. Теплые массы влажного воздуха поднимаются в более высокие слои атмосферы. Поскольку там атмосферное давление ниже, происходит адиабатическое расширение, сопровождающееся охлаждением воздуха и конденсацией водяного пара. На относительно небольшой высоте образуются кучевые облака, в которых вода находится в виде жидких капель, в верхних же слоях атмосферы, где температура более низкая, возникают перистые облака, содержащие кристаллики льда. 2. Смешение газов и паров, имеющих разные температуры. Так образуются атмосферные туманы. Чаще всего туман появляется при ясной погоде ночью, когда поверхность Земли, интенсивно отдавая тепло, сильно охлаждается. Теплый влажный воздух соприкасается с охлаждающейся Землей или с холодным воздухом вблизи ее поверхности и в нем образуются капельки жидкости. То же происходит при смешении фронтов теплого и холодного воздуха. 3. Охлаждение газовой смеси, содержащей пар. Этот случай можно проиллюстрировать на примере чайника, в котором закипела вода. Из носика вырывается водяной пар, который невидим, поскольку не рассеивает свет. Далее водяной пар быстро охлаждается, вода в нем конденсируется, и уже на небольшом расстоянии от носика чайника мы видим молочное облачко - туман, ставший видимым из-за способности рассеивать свет. Аналогичное явление наблюдается, когда мы открываем форточку в морозный день. Более прочный аэрозоль образуется, когда закипевшее на сковородке масло создает в помещении газ (масляный аэрозоль), удалить который можно лишь хорошо проветрив помещение. Кроме того, конденсационный аэрозоль может образовываться в результате газовых реакций, ведущих к образованию нелетучих продуктов: • при сгорании топлива образуются дымовые газы, конденсация которых приводит к появлению топочного дыма; • при сгорании фосфора на воздухе образуется белый дым ( • при взаимодействии газообразных • окисление металлов на воздухе, происходящее в различных металлургических и химических процессах, сопровождается образованием дымов, состоящих из частиц оксидов металлов. ДИСПЕРГАЦИОННЫЕ МЕТОДЫ Диспергационные аэрозоли образуются при измельчении (распылении) твердых и жидких тел в газовой среде и при переходе порошкообразных веществ во взвешенных состояниях при действии воздушных потоков. Распыление твердых тел происходит в две стадии: измельчение, а затем распыление. Перевод вещества в состояние аэрозоля должен быть осуществлен в момент применения аэрозоля, так как в отличие от других дисперсных систем - эмульсий, суспензий, аэрозоли нельзя приготовить заранее. В бытовых условиях почти единственным средством получения жидких и порошкообразных аэрозолей является устройство, называемое "аэрозольной упаковкой" или "аэрозольным баллоном". Вещество в нем упаковывается под давлением и распыляется при помощи сжиженных или сжатых газов. Эти устройства будут подробнее рассмотрены ниже. 5.4.3. ОБЩАЯ ХАРАКТЕРИСТИКА АЭРОЗОЛЕЙ Свойства аэрозолей определяются: • природой веществ дисперсной фазы и дисперсионной среды; • частичной и массовой концентрацией аэрозоля; • размером частиц и распределением частиц по размерам; • формой первичных (неагрегированных) частиц; • структурой аэрозоля; • зарядом частиц. Для характеристики концентрации аэрозолей, как и других дисперсных систем, используются массовая концентрация и численная (частичная) концентрация. Массовая концентрация - масса всех взвешенных частиц в единице объема газа. Численная концентрация - число частиц в единице объема аэрозоля. Как бы ни велика была численная концентрация в момент образования аэрозоля, уже через несколько секунд она не может превышать РАЗМЕРЫ ЧАСТИЦ АЭРОЗОЛЯ Минимальный размер частиц определен возможностью существования вещества в агрегатном состоянии. Так, одна молекула воды не может образовать ни газа, ни жидкости, ни твердого, тела. Для образования фазы необходимы агрегаты по крайней мере из 20-30 молекул. Самая маленькая частица твердого вещества или жидкости не может иметь размер меньше Таблица 18.1. Размеры частиц некоторых золей Аэрозоли Условное обозначение Размеры частиц, м Туман (Н2О) Ж/Г 5 · 10-7 Слоистые облака Ж/Г 1 · 10-6 - 1 · 10-5 Дождевые облака Ж/Г 1 · 10-5 - 1 · 10-4 H2SO4 (туман) Ж/Г 1 · 10-6 - 1 · 10-5 ZnO (дым) Т/Г 5 · 10-8 Табачный дым Т/Г 1 · 10-7 - 1 · 10-6 Топочный дым Т/Г 1 · 10-7 - 1 · 10-4 P2O5 (дым) Т/Г 1 · 10-6 - 1 · 10-5 ФОРМА ЧАСТИЦ АЭРОЗОЛЯ Жидкие капли в аэрозолях всегда сферичны, твердые частицы могут иметь самые различные формы. Их можно разделить на три класса. 1. Изометрические частицы, для которых три размера в первом приближении совпадают. К этому классу относятся шарики, правильные многогранники или частицы, близкие к ним по форме. 2. Пластинки - частицы, имеющие два больших размера и один малый: лепестки, чешуйки, диски. 3. Волокна - частицы, протяженные лишь в одном направлении и имеющие меньшие размеры в двух других направлениях: иглы, нити или минеральные волокна. Форма частиц зависит от способа получения и материала. Так, например, частицы, возникающие при конденсации пара, имеют обычно сферическую форму. СТРУКТУРА АЭРОЗОЛЯ Частицы аэрозоля могут существовать сами по себе или объединяться в цепочки, которые называют агломератами или флокулами. Они обычно образуются из высокозаряженных маленьких частиц, которые находятся в плотных дымах. Аэрозоли могут также состоять из полых капель, заполненных газом или полых частиц, содержащих вещество - наполнитель. Таким образом, плотность частиц в аэрозоле может значительно отличаться от плотности исходного вещества. ПОВЕРХНОСТНЫЕ СВОЙСТВА Аэрозольные частицы, имея малые размеры, обладают развитой поверхностью, на которой могут протекать адсорбция, горение и другие химические реакции. Большая поверхность обусловливает такие физические свойства, как гигроскопичность или способность взаимодействовать с электрическими зарядами. ОПТИЧЕСКИЕ СВОЙСТВА АЭРОЗОЛЕЙ Оптические свойства аэрозолей подчиняются тем же закономерностям, что и оптические свойства лиозолей но в аэрозолях они проявляются более ярко за счет большой разности в плотностях, а значит - в показателях преломления аэрозольной частицы и газовой среды. Характер взаимодействия света с аэрозольной частицей зависит от соотношения между размером частицы d и длиной волны света . Если Интенсивность рассеянного света
Поскольку показатель преломления частицы значительно больше показателя преломления среды , для аэрозолей величина К значительно больше, чем для лиозолей. Из уравнения Рэлея видно, что красный свет рассеивается гораздо меньше, чем синий и желтый, и если учесть тот факт, что аэрозольных частиц в нижних слоях атмосферы намного больше, чем в верхних, становится ясным, почему на восходе и закате небо окрашивается в багровые тона, а в полдень сияет голубизной. Ведь когда Солнце приближается к горизонту, мы наблюдаем лучи, почти горизонтально расположенные, проходящие через запыленные нижние слои атмосферы, сильно рассеивающие свет, до нас доходит, главным образом, красный свет. Когда же Солнце стоит высоко, в вертикальном столбе атмосферного воздуха суммарное количество частиц относительно невелико и, следовательно, невелико рассеяние, поэтому солнечный свет мы наблюдаем неискаженным, незначительно рассеивается только коротковолновая (голубая) составляющая света, которая и придает небу голубой цвет. Некоторые, главным образом, металлические или угольные частицы могут поглощать свет. Черный цвет дыма обусловлен тем, что дымовые частицы эффективно поглощают видимые лучи всех длин волн. Белый цвет дыма вызван интенсивным рассеянием его частицами всех видимых длин волн. Благодаря большой способности рассеивать свет аэрозоли широко применяются для создания дымовых завес. Из всех дымов наибольшей способностью рассеивать и отражать свет обладает дым , его маскирующая способность принимается за единицу. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЕ СВОЙСТВА АЭРОЗОЛЕЙ Особенности молекулярно-кинетических свойств аэрозолей обусловлены: • малой концентрацией частиц дисперсной фазы - так, если в 1 гидрозоля золота содержится • малой вязкостью дисперсионной среды - воздуха, следовательно, малым коэффициентом трения (В), возникающего при движении частиц; • малой плотностью дисперсионной среды, следовательно Все это приводит к тому, что движение частиц в аэрозолях происходит значительно интенсивнее, чем в лиозолях. Рассмотрим самый простой случай, когда аэрозоль находится в закрытом сосуде (т.е. исключены внешние потоки воздуха) и частички имеют сферическую форму радиусом r и плотность . На такую частицу одновременно действуют сила тяжести, направленная вертикально вниз, и сила трения прямо противоположного направления. Кроме того, частица находится в броуновском движении, следствием которого является диффузия. Для количественной оценки процессов диффузии и седиментации в аэрозолях можно использовать значения удельного потока диффузии и удельного потока седиментации
Чтобы выяснить, какой поток будет преобладать (
В этом выражении Если r > 1 мкм, то Если r < 0,01 мкм, то Таблица 18.2. Данные для водного тумана в закрытом помещении Дисперсная система d, мкм Скорость оседания, см/с Время оседания в помещении высотой 3 м Высокодисперсная 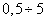 0,00075-0,075 4,65 сут - 1,1 час Среднедисперсная  0,075-1,9 1,1 час - 2,6 мин Низкодисперсная  1,9-27 2,6 мин - 11,1 с Мелкодисперсная  27-95 11,1 с - 3,2 с Крупнокапельная  95-162 3,2 с - 1,9 с Таким образом, из аэрозоля быстро исчезают как очень мелкие, так и очень крупные частицы: первые вследствие прилипания к стенкам или слипания, вторые - в результате оседания на дно. Частицы промежуточных размеров обладают максимальной устойчивостью. Поэтому, как бы ни велика была численная концентрация частиц в момент образования аэрозоля, уже через несколько секунд она не превышает Для частиц аэрозолей характерно движение частиц в поле температурного градиента в направлении изменения температуры. Этим обусловлены такие явления, как термофорез, термопреципитация, фотофорез. Термофорез - самопроизвольное движение частиц в направлении снижения температуры. Оно обусловлено тем, что с "горячей" стороны на частицу налетают более быстрые молекулы газа и она смещается в "холодную" сторону. Термопреципитация - осаждение частиц аэрозоля преимущественно на холодных поверхностях, когда вблизи присутствуют горячие тела. Термопреципитацией обусловлено оседание пыли на стенах и потолке вблизи радиаторов, ламп, горячих труб, печей и т.д. Фотофорез - передвижение частиц аэрозоля при одностороннем освещении, является частным случаем термофореза. Для непрозрачных частиц наблюдается положительный фотофорез, т.е. частицы движутся в направлении светового луча. Для прозрачных частиц имеет место отрицательный фотофорез, причем при увеличении размеров частиц он может переходить в положительный. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА АЭРОЗОЛЕЙ Электрические свойства частиц аэрозоля значительно отличаются от электрических свойств частиц в лиозоле. 1. На частицах аэрозоля не возникает ДЭС, так как из-за низкой диэлектрической проницаемости газовой среды в ней практически не происходит электролитическая диссоциация. 2. Заряд на частицах возникает, главным образом, за счет неизбирательной адсорбции ионов, которые образуются в газовой фазе в результате ионизации газа космическими, ультрафиолетовыми или радиоактивными лучами. 3. Заряд частиц носит случайный характер, и для частиц одной природы и одинакового размера может быть различным как по величине, так и по знаку. 4. Заряд частицы изменяется во времени как по величине, так и по знаку. 5. В отсутствие специфической адсорбции заряды частиц очень малы и обычно превышают элементарный электрический заряд не более, чем в 10 раз. 6. Специфическая адсорбция характерна для аэрозолей, частицы которых образованы сильно полярным веществом, так как в этом случае на межфазной поверхности возникает достаточно большой скачок потенциала, обусловленный поверхностной ориентацией молекул. Например, на межфазной поверхности аэрозолей воды или снега существует положительный электрический потенциал порядка 250 мВ. Из практики известно, что частицы аэрозолей металлов и их оксидов обычно несут отрицательный заряд (Zn, ZnO, MgO, АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ. КОАГУЛЯЦИЯ В отличие от остальных дисперсных систем в аэрозолях отсутствует всякое взаимодействие между поверхностью частиц и газовой средой, а значит, отсутствуют силы, препятствующие сцеплению частиц между собой и с макроскопическими телами при соударении. Таким образом, аэрозоли являются агрегативно неустойчивыми системами. Коагуляция в них происходит по типу быстрой коагуляции, т.е. каждое столкновение частиц приводит к их слипанию. Скорость коагуляции быстро возрастает с увеличением численной концентрации аэрозоля (табл. 18.3). Таблица 18.3. Зависимость скорости коагуляции от увеличения численности концентрации аэрозоля Начальная численность концентрация в 1 см3 Время, необходимое для уменьшения концентрации аэрозоля в 2 раза 1012 Доли секунды 1010 15-30 с 108 30 мин 106 Несколько суток Независимо от начальной концентрации аэрозоля через несколько минут в 1 находится Коагуляции аэрозолей также способствуют: • низодиаметрическая форма частиц; • полидисперсность; • наличие противоположно заряженных частиц; • конвекционные потоки, механическое перемешивание, ультразвуковые колебания, так как они увеличивают вероятность столкновения частиц. 5.4.4. МЕТОДЫ РАЗРУШЕНИЯ АЭРОЗОЛЕЙ Несмотря на то, что аэрозоли являются агрегативно неустойчивыми, проблема их разрушения стоит очень остро. Основные проблемы, при разрешении которых возникает необходимость разрушения аэрозолей: • очистка атмосферного воздуха от промышленных аэрозолей; • улавливание из промышленного дыма ценных продуктов; • искусственное дождевание или рассеивание облаков и тумана. Разрушение аэрозолей происходит путем • рассеивания под действием воздушных течений или вследствие одноименных зарядов частиц; • седиментации; • диффузии к стенкам сосуда; • коагуляции; • испарения частиц дисперсной фазы (в случае аэрозолей летучих веществ). Из очистных сооружений наиболее древним является дымовая труба. Вредные аэрозоли стараются выпускать в атмосферу как можно выше, так как некоторые химические соединения, попадая в приземный слой атмосферы под действием солнечных лучей и в результате разных реакций, превращаются в менее опасные вещества (на Норильском горно-металлургическом комбинате, например, трехканальная труба имеет высоту 420 м). Однако современная концентрация промышленного производства требует, чтобы дымовые выбросы проходили предварительную очистку. Разработано много способов разрушения аэрозолей, но любой из них состоит из двух стадий: первая - улавливание дисперсных частиц, отделение их от газа, вторая - предотвращение повторного попадания частиц в газовую среду, это связано с проблемой адгезии уловленных частиц, формированием из них прочного осадка. Пылеулавливание, главным образом, основано на инерционных или на электрических силах. Способы пылеулавливания можно представить в виде схемы . Рассмотрим эти способы более подробно. Инерционное осаждение проводится с помощью центробежных отделителей, называемых циклонами. Они представляют собой металлические цилиндры, в которых аэрозоль по спирали движется сверху вниз, при этом частицы оседают на стенках цилиндра, а очищенный газ по специальной трубе выводится из циклона. Высокопроизводительный циклон может обеспечить практически полное улавливание частиц крупнее 30 мкм, частицы размерами 5 мкм улавливаются на 80%, а размерами 2 мкм - менее чем на 40%. К инерционному осаждению можно отнести и мокрое пылеулавливание. В этих случаях главная задача состоит в том, чтобы частицы привести в соприкосновение с каплями жидкости, вместе с которыми они удаляются из аппарата. Мокрое пылеулавливание осуществляется двумя способами: 1) для частиц с d > 2-5 мкм используют скрубберы (полые или с насадкой), мокрые циклоны, барботажные или пенные пылеулавливатели; 2) для частиц с d < 2 мкм используются скоростные пылеулавливатели. Ультразвуковые установки используются для разрушения туманов. Достаточно нескольких секунд, чтобы туман, движущийся в ультразвуковом поле, скоагулировал на 90%. В настоящее время разработаны промышленные установки с производительностью до 1000 Электростатическое осаждение с успехом применяют для улавливания пылей и туманов в цементной, сернокислотной, металлургической промышленности и особенно для улавливания летучей золы из дымовых газов электростанций. Принцип метода состоит в следующем. Аэрозоль пропускают между электродами, создающими поле высокого напряжения (70-100 кВ), возникает коронный разряд, при котором катод испускает огромное количество электронов. Электроны ионизируют молекулы газа. Образующиеся анионы адсорбируются частицами аэрозоля, затем отрицательно заряженные частицы осаждаются на положительно заряженной стенке трубы, после чего собираются в специальном бункере. Простые по конструкции и недорогие пылеуловители высокой производительности малоэффективны для частиц размером до 5 мкм, а именно такие частицы представляют наибольшую опасность. В связи с этим чрезвычайно заманчивой является идея так называемого конденсационного метода пылеулавливания. В этом методе используется свойство аэрозольных частиц выступать в роли центров конденсации водяных паров. Механизм конденсационного метода состоит в том, что за счет конденсации водяных паров трудноуловимый тонкодисперсный аэрозоль превращается в туман, капли которого размерами 2-5 мкм легко осаждаются простыми методами. Достоинством этого метода является то, что превратить в капли тумана можно частицы любой природы и любого размера. Пылеулавливающий фильтр конденсационного типа производительностью 30 000 5.4.5. АЭРОЗОЛЬНЫЕ БАЛЛОНЫ ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ДИСПЕРГИРОВАНИЯ ВЕЩЕСТВ ПРИ ПОМОЩИ АЭРОЗОЛЬНЫХ БАЛЛОНОВ Принцип действия аэрозольного баллона состоит в том, что помещенный в упаковку препарат смешивается с эвакуирующей жидкостью, давление насыщенного пара которой в интервале температур, при которых эксплуатируется упаковка, выше атмосферного. Выброс смеси из баллона происходит под действием давления насыщенного пара, находящегося над жидкостью. Известно, что давление насыщенного пара любого стабильного вещества определяется только температурой и не зависит от объема. Поэтому в течение всего времени работы баллона давление в нем будет оставаться постоянным, следовательно, практически постоянной будет оставаться дальность полета частиц и угол конуса распыления. В зависимости от характера взаимодействия распыляемого вещества с эвакуирующей жидкостью и его агрегатного состояния, системы в аэрозольной упаковке будут состоять из различного числа фаз. В случае взаимной растворимости компонентов образуется гомогенный жидкий раствор, в других случаях - эмульсия или суспензия и, наконец, гетерогенная система, когда препарат и эвакуирующая жидкость образуют макроскопически неоднородную систему. Очевидно, что в первом случае в аэрозольной упаковке находится двухфазная система - жидкость и насыщенный пар. При выпуске в атмосферу эмульсии или суспензии происходит дробление только дисперсионной среды - получаемые частицы в лучшем случае будут иметь размеры, которые они имели в жидкой фазе. Когда препарат и эвакуирующая жидкость не смешиваются или ограниченно смешиваются между собой, причем одна из жидкостей диспергирована в другой в виде мелких капелек, образуются эмульсии. Характер системы, образующейся при выходе продукта из упаковки в атмосферу, зависит от того, какая из жидкостей является дисперсной фазой. Если дисперсная фаза - это препарат, то образуется аэрозоль. Если дисперсной фазой является эвакуирующая жидкость, то получается пена. Размер частиц, получаемых при помощи аэрозольных баллонов, зависит от физико-химических свойств веществ, входящих в состав препарата, соотношения компонентов, конструктивных особенностей баллона и температурных условий его эксплуатации. Степень дисперсности можно регулировать: • варьируя размеры выходного отверстия; • изменяя давление насыщенного пара эвакуирующей жидкости; • меняя количественное соотношение препарата и эвакуирующего агента. ЭВАКУИРУЮЩИЕ ВЕЩЕСТВА Важнейшим вспомогательным компонентом является вещество, которое обеспечивает выброс препарата в атмосферу и последующее его диспергирование. Эти вещества получили название пропеллентов (лат. "рrоpellere" - гнать). Пропеллент должен выполнять две функции: • создавать необходимое давление для выброса препарата; • диспергировать продукт, выпущенный в атмосферу. В качестве пропеллентов используют фреоны и сжатые газы. Фреоны - это низкомолекулярные фторорганичес-кие соединения алифатического ряда Принята следующая система обозначений фреонов: последняя цифра (число единиц) означает число атомов фтора в молекуле, предшествующая цифра (число десятков) - число атомов водорода, увеличенное на единицу, и третья (число сотен) - число атомов углерода, уменьшенное на единицу. Например: F-22 - это Вещества, состоящие из молекул циклического строения, также имеют цифровое обозначение, но перед цифрами ставится буква "С", например: С318 - В качестве сжатых газов применяют ПРЕИМУЩЕСТВА АЭРОЗОЛЬНЫХ УПАКОВОК 1. Перевод препарата в мелкодисперсное состояние происходит за счет потенциальной энергии сжиженного пропеллента и не требуется применение каких-либо посторонних устройств. 2. Для создания аэрозолей не нужны какие-либо насадки. 3. В единицу времени можно диспергировать значительное количество вещества с получением частиц малого размера - в случае применения других способов потребовалось бы гораздо больше энергии. 4. Режим туманообразования стабилен: размер получаемых частиц, дальность их полета, угол в вершине конуса в течение всего времени эксплуатации мало меняются. 5. Можно заранее фиксировать дозировку распыляемого вещества. 6. Можно задавать размер частиц. 7. Степень полидисперсности аэрозоля невелика. 8. Все частицы имеют одинаковый химический состав. 9. Обеспечивается стерильность распыляемых препаратов. 10. Препарат в упаковке не соприкасается с кислородом воздуха, что обеспечивает его стабильность. 11. Автоматически закрывающийся клапан исключает возможность потери за счет проливания или испарения неиспользованной части продукта. 12. Упаковка постоянно готова к работе. 13. Упаковка компактна. Дает возможность индивидуального или коллективного использования. Первые аэрозольные упаковки появились в 30-х гг. XX в. в Европе. Во время Второй мировой войны инициативу в области их разработки захватили США. В 1941 г. была создана аэрозольная упаковка - средство для уничтожения насекомых, упакованное в стеклянный сосуд. Пропеллентом служил фреон-12. В промышленных масштабах производство началось после Второй мировой войны в США, а затем в других странах мира. 5.4.6. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ АЭРОЗОЛЕЙ Широкое использование аэрозолей обусловлено их высокой эффективностью. Известно, что увеличение поверхности вещества сопровождается увеличением его активности. Незначительное количество вещества, распыленное в виде аэрозоля, занимает большой объем и обладает большой реакционной способностью. В этом состоят преимущества аэрозолей перед другими дисперсными системами. Аэрозоли применяются: • в различных областях техники, в том числе в военной и космической; • в сельском хозяйстве; • в здравоохранении; • в метеорологии; • в быту и т.д. Остановимся подробнее на применении аэрозольных упаковок. В настоящее время насчитывается более 300 видов товаров в аэрозольных упаковках. Первая группа: средства бытовой химии. • Инсектициды - препараты для уничтожения насекомых. • Средства против моли. • Инсектициды для обработки домашних животных. • Средства защиты комнатных растений и плодово-ягодных культур от грибковых болезней и вредителей. • Лаки и краски. • Освежители воздуха. • Полирующие и чистящие составы. Вторая группа: парфюмерно-косметические средства. • Средства ухода за волосами (лаки, шампуни и т.д.). • Пены и гели для бритья. • Кремы для рук и ног. • Масло для и от загара. • Дезодоранты. • Духи, одеколоны, туалетная вода. Третья группа: медицинские аэрозоли. Четвертая группа: технические аэрозоли. • Смазочные масла. • Антикоррозионные покрытия. • Защитные пленки. • Сухие смазки. • Эмульсии для охлаждения резцов на сверлильных станках. Пятая группа: пищевые аэрозоли. ПИЩЕВЫЕ АЭРОЗОЛИ Первые баллоны с пищевыми продуктами появились в 1947 г. в США. Они содержали кремы для отделки тортов и пирожных и применялись только в ресторанах, которые возвращали их для повторного заполнения. Массовое производство этого вида аэрозольных упаковок началось лишь в 1958 г. Аэрозольные упаковки пищевых продуктов можно разделить на три основных группы: • упаковки, требующие хранения при низкой температуре; • упаковки с последующей тепловой обработкой; • упаковки без последующей тепловой обработки. В аэрозольных упаковках выпускаются пищевые продукты трех видов: кремы, жидкости, пасты. В аэрозольных упаковках можно купить приправы для салатов, плавленый сыр, соки, корицу, майонез, томатный сок, 30%-е взбитые сливки и т.д. Рост производства пищевых аэрозолей объясняется следующим: • преимуществами перед обычными видами тары; • разработкой новых пропеллентов; • усовершенствованием технологии заполнения. Преимущества аэрозольной упаковки пищевых продуктов: • удобство использования; • экономия времени; • пища упаковывается в подготовленном к употреблению состоянии и выдается из упаковки в однородном виде; • нет утечки продуктов; • влага не теряется и не проникает в упаковку; • не теряется аромат; • продукт сохраняется в стерильном виде. К рецептурам пищевых аэрозолей предъявляются следующие требования: 1. Пропелленты должны быть высокой чистоты, не быть токсичными, не иметь вкуса и запаха. В настоящее время используются диоксид углерода, закись азота, азот, аргон и фреон С318. 2. Сжатые газы, имеющие весьма ограниченную растворимость в водных растворах, не могут участвовать в образовании пены, а это необходимо для взбитых сливок, декоративных кремов, муссов и т.п. С этими продуктами предпочтительнее использовать фреон С318, хотя он значительно дороже. 3. Использование фреонов дает еще одно преимущество: сжиженные газы, вводятся в рецептуры продуктов, которые выделяются в виде пены, в количестве не более 10% веса, при этом они занимают сравнительно небольшой объем. Это позволяет загрузить в баллон значительно больше продуктов - 90% емкости баллона (в упаковках со сжатым газом лишь 50%) и гарантирует полную выдачу продукта из упаковки. 4. Выбор пропеллента диктуется типом пищевого продукта и предполагаемой формой его выдачи (крем, жидкость, паста). Хорошо зарекомендовали себя смеси и закиси азота высокой чистоты. Для получения пены применяются смеси фреона С318 с закисью азота. Упакованный с этой смесью крем для отделки тортов дает устойчивую пену, хорошо сохраняющую цвет. Для сиропов самым подходящим пропеллентом считается . Таблица 18.4. Примеры рецептур различных пищевых аэрозолей Ингредиенты, входящие в состав аэрозолей Количество, % массы 1. Сбитый крем для закусочных бутербродов Творог со сливками 50-60 Микрокристаллическая целлюлоза 25-30 Растительное масло и ароматические добавки 6-10 Фреон С318 7 2. Сахарная глазурь для отделки кондитерских изделий Сахар 55-60 Вода 15-25 Растительное масло
твердое 9-14 жидкое 3-5 Соль поваренная 0,1-0,3 Микрокристаллическая целлюлоза 1,0 Отдушки 1-4 Эмульгаторы 0,5-1 Фреон С318 7 3. Мусс Мед или фруктовый сироп 78-83 Вода 7-9 Растительное масло (твердое) 3-5 Микрокристаллическая целлюлоза 1-2 Моноглицериды 0,5-1 Полиэфиры сорбита 0,05-1 Фреон С318 7
4. Декоративный соус в виде пены Горчица (тонко измельченный порошок) 0,94 Лимонный сок 4,72 Уксус 9,44 Вода 34 Полисорбат 80 0,5 Эмульгирующая смесь 2,25 Микрокристаллическая целлюлоза 2,5 Добавки - стабилизаторы пены 4,59 Фреон С318 + закись азота (Р=8 атм) 7 5. Масляно-уксусная заправка в виде пены Вода 11,80 Соль 1,96 Сахар 1,47 Винный уксус 22,81 Оливковое масло 61,75 Полисорбат 80 0,10 Чесночное масло 0,12 Масло черного перца 0,10 Фреон С318 10,0 6. Заправка для жареных кукурузных зерен Соль (экстра) 10,00 Растительное масло 58,97 Прочие добавки из масел 0,03 Краситель 1,00 Фреон-С318 10,00 Качество выдачи содержимого из баллона зависит от следующих факторов: • технологии приготовления продукта; • стабилизатора (широко используется микрокристаллическая целлюлоза); • правильного выбора баллона и клапана. Для корицы и лимонного сока разработана управляемая распылительная головка, которая по желанию может выдавать продукты либо в виде капель, либо в виде струи. Для искусственных подсластителей применяются дозирующие клапаны, одна выдаваемая ими доза соответствует одному куску пиленого сахара и т.д. 5.4.7. АЭРОЗОЛЬНЫЙ ТРАНСПОРТ В мукомольной, крупяной, комбикормовой промышленности широко применяется пневматический транспорт, который создает условия для внедрения автоматизации, повышения производительности труда и снижения себестоимости. Однако применение пневматического транспорта сопряжено с большой затратой электроэнергии на перемещение большого объема воздуха (1 кг воздуха перемещает 5-6 кг сыпучего материала). Более прогрессивным является аэрозольный транспорт, при котором большая концентрация материала в воздушном потоке достигается благодаря аэрации муки в начале транспортирования и высокому давлению воздуха. Аэрация нарушает сцепление между частицами муки, и она приобретает свойство текучести, подобно жидкости, в результате 1 кг воздуха перемещает до 200 кг муки. Аэрозольтранспортная установка состоит из питателя, нагнетателя, материалопровода и разгрузителя. Основным элементом является питатель, в котором смешиваются воздух с материалом и смеси сообщается начальная скорость, что обеспечивает ее подачу в материалопровод. Внедрение аэрозольтранспорта дает возможность повысить производительность мельниц и снизить удельный расход электроэнергии. Аэрозольному транспорту принадлежит будущее не только в мукомольной, но и в других отраслях промышленности, связанных с использованием сыпучих материалов и порошков. ЗАКЛЮЧЕНИЕ Аэрозоли - это микрогетерогенные системы, в которых частицы твердого вещества или капельки жидкости взвешены в газе (Т/Г или Ж/Г). По агрегатному состоянию дисперсной фазы аэрозоли подразделяют на: туман (Ж/Г); дым, пыль (Т/Г); смог [(Ж+Т)/Г)]. По дисперсности аэрозоли бывают: туман, дым, пыль. Как и другие микрогетерогенные системы, аэрозоли могут быть получены из истинных растворов (конденсационные методы) или из грубодисперсных систем (диспергационные методы). Капельки воды в туманах всегда сферические, а твердые частицы дыма могут иметь разную форму в зависимости от их происхождения. Благодаря очень маленьким размерам частиц дисперсной фазы они имеют развитую поверхность, на которой могут активно протекать адсорбция, горение, другие химические реакции. Молекулярно-кинетические свойства аэрозолей обусловлены: малой концентрацией частиц дисперсной фазы; малой вязкостью дисперсионной среды; малой плотностью дисперсионной среды. В зависимости от размеров частиц дисперсной фазы они могут либо быстро седиментировать (при r Для аэрозолей характерны явления термофореза, термопреципитации, фотофореза. Оптические свойства аэрозолей сходны со свойствами лиозолей, однако рассеяние света ими выражено значительно сильнее из-за больших различий показателей преломления дисперсной фазы и дисперсионной среды. Специфичность электрических свойств аэрозолей состоит в том, что на частицах не возникает ДЭС, заряд частиц носит случайный характер и мал по величине, При сближении частиц не возникает электростатическое отталкивание и происходит быстрая коагуляция. Разрушение аэрозолей является важной проблемой и осуществляется путем седиментации, коагуляции, пылеулавливания и другими методами. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие системы называют аэрозолями, как они обозначаются? 2. По каким признакам и как классифицируют аэрозоли? 3. На какие группы делятся методы получения аэрозолей? 4. Какими основными факторами определяются свойства аэрозолей? 5. В чем состоит сходство и различие оптических свойств аэрозолей и лиозолей? 6. В чем состоит сущность таких явлений, как термофорез, термопреципитация, фотофорез? 7. В чем состоит отличие электрических свойств аэрозолей и лиозолей? 8. Какие факторы способствуют коагуляции аэрозолей? 9. Какими методами может осуществляться разрушение аэрозолей? 10. Каков принцип действия аэрозольного баллончика? 11. Какие вещества называются пропеллентами? Какие пропелленты вы знаете? Изучив главу 18, вы должны знать: • классификацию аэрозолей; • методы получения аэрозолей; • особенности молекулярно-кинетических, оптических и электрических свойств; • методы разрушения аэрозолей. 5.5. ГЛАВА 19. ПОРОШКИ Порошками называются высококонцентрированные дисперсные системы, в которых дисперсной фазой являются твердые частицы, а дисперсионной средой - воздух или другой газ. Условное обозначение: Т/Г. В порошках частицы дисперсной фазы находятся в контакте друг с другом. Традиционно к порошкам относят большинство сыпучих материалов, однако в узком смысле термин "порошки" применяют к высокодисперсным системам с размером частиц, меньшим некоторого критического значения, при котором силы межчастичного взаимодействия становятся соизмеримыми с массой частиц. Наибольшее распространение имеют порошки с размерами частиц от 1 до 100 мкм. Удельная межфазная поверхность таких порошков меняется в пределах от нескольких (сажа) до долей ( мелкие пески). От аэрозолей с твердой дисперсной фазой (тоже Т/Г) порошки отличаются гораздо большей концентрацией твердых частиц. Порошок получается из аэрозоля с твердой дисперсной фазой при его седиментации. В порошок превращается также суспензия (Т/Ж) при ее высушивании. С другой стороны, и аэрозоль, и суспензия могут быть получены из порошка. 5.5.1. КЛАССИФИКАЦИЯ ПОРОШКОВ 1. По форме частиц: • равноосные (имеют примерно одинаковые размеры по трем осям); • волокнистые (длина частиц гораздо больше ширины и толщины); • плоские (длина и ширина значительно больше толщины). 2. По межчастичному взаимодействию: • связнодисперсные (частицы сцеплены между собой, т.е. система обладает некоторой структурой); • свободнодисперсные (сопротивление сдвигу обусловлено только трением между частицами). 3. Классификация по размерам частиц дисперсной фазы:
5.5.2. МЕТОДЫ ПОЛУЧЕНИЯ ПОРОШКОВ Порошки, так же как любую другую дисперсную систему, можно получить двумя группами методов: • со стороны грубодисперсных систем - диспергационными методами; • со стороны истинных растворов - конденсационными методами. Выбор метода зависит от природы материала, назначения порошка и экономических факторов. ДИСПЕРГАЦИОННЫЕ МЕТОДЫ Производится дробление сырья на вальцовых, шаровых, вибрационных или коллоидных мельницах с последующим разделением на фракции, так как в результате помола получаются полидисперсные порошки (например, мука одного и того же сорта может содержать частицы от 5 до 60 мкм). Эффективное диспергирование может быть произведено при перетирании весьма концентрированных суспензий. Для облегчения диспергирования применяют понизители твердости, в качестве которых выступают ПАВ. В соответствии с правилом уравнивания полярностей, ад-сорбируясь на поверхности измельчаемого твердого тела, они уменьшают поверхностное натяжение, снижая энергозатраты при диспергировании и повышая дисперсность измельченной фазы. В некоторых случаях перед диспергированном проводят предварительную обработку материала. Так, титан или тантал нагревают в атмосфере водорода, переводя в гидриды, которые измельчают и нагревают в вакууме - получаются чистые металлические порошки. При получении чешуйчатых порошков, которые входят в состав красок и пиротехнических составов, для измельчения используют шаровые мельницы. Шары расплющивают и прокатывают частицы измельчаемого материала. Порошки с частицами сферической формы из тугоплавких металлов (вольфрам, молибден, ниобий) получают в низкотемпературной плазме дугового и высокочастотного разряда. Проходя через зону плазмы, частицы плавятся и принимают сферическую форму, затем охлаждаются и затвердевают. В ходе диспергирования химический состав материала не изменяется. КОНДЕНСАЦИОННЫЕ МЕТОДЫ Эти методы можно разделить на две группы. Первая группа методов связана с осаждением частиц вследствие коагуляции лиофобных золей. В результате упаривания раствора или частичной замены растворителя (снижение растворимости) образуется суспензия, а после ее фильтрации и сушки получаются порошки. Вторая группа методов связана с проведением химических реакций (химическая конденсация). Методы химической конденсации можно классифицировать на основе типа используемой реакции: 1. Обменные реакции между электролитами. Например, осажденный мел (зубной порошок) получают в результате реакции:
2. Окисление металлов. Например, высокодисперсный оксид цинка, являющийся основным компонентом цинковых белил, получают окислением паров цинка воздухом при 300. 3. Окисление углеводородов. Различные виды сажи, которую применяют при производстве резины, пластмасс, типографской краски получают сжиганием газообразных или жидких углеводородов при недостатке кислорода. 4. Восстановление оксидов металлов. Восстановление природным газом, водородом или твердыми восстановителями используется для получения высокодисперсных металлических порошков. 5. Термическая диссоциация карбонилов металлов. Карбонилы 6. Электролиз водных растворов солей. Этим методом получают высокодисперсные порошки металлов и сплавов высокой степени чистоты. Таким образом, методы химической конденсации связаны с изменением химического состава материалов. 5.5.3. ОБЩАЯ ХАРАКТЕРИСТИКА ПОРОШКОВ Обычно порошки рассматривают с точки зрения природы вещества дисперсной фазы и размеров частиц. ПРИРОДА ВЕЩЕСТВА ДИСПЕРСНОЙ ФАЗЫ Рассмотрим только те характеристики вещества, на которых основаны свойства порошков, влияющие на технологию их использования и переработки. Когезия определяет связь между молекулами (атомами, ионами) внутри тела в пределах одной фазы, т.е. прочность конденсированных тел и их способность противодействовать внешнему воздействию. Следовательно, энергетические затраты при диспергировании тем больше, чем больше когезия. Кроме того, величина когезии определяет такую важную характеристику порошка, как его насыпная масса. Насыпная масса - масса порошка, который занимает единичный объем при свободном его заполнении, "свободной упаковке частиц". Чем больше когезионные силы, тем сильнее связь между частицами, тем хаотичнее они распределены по объему формы и тем больше объем свободной упаковки и соответственно меньше насыпная масса. Если когезия мала, то малы силы сцепления, порошок лучше уплотняется под действием силы тяжести и объем свободной упаковки частиц оказывается небольшим. Адгезия - это явление соединения приведенных в контакт поверхностей конденсированных фаз. Например, частички порошка взаимодействуют со стенками емкости, в которой они находятся. Адгезия обусловливает прилипание и удержание частиц на поверхности. Чем больше адгезия, тем сложнее бороться с прилипанием порошка к стенкам технологического оборудования. Аутогезия - частный случай адгезии - сцепление одинаковых по составу и строению частиц. Адгезионное и аутогезионное взаимодействие направлены перпендикулярно площади контакта. В результате адгезии частицы порошка прижимаются к поверхности, а под действием аутогезии - друг к другу. Аутогезия определяется, главным образом, природой и силой межчастичного взаимодействия. Основной вклад в межчастичное взаимодействие вносят • межмолекулярное притяжение; • электростатическое отталкивание. Электростатическое отталкивание связано с появлением заряда поверхности при перемещении частиц друг относительно друга и их соударениях. Роль электростатических взаимодействий особенно велика для полимерных частиц. Установлено, что для сферических частиц число точек контактов не превышает 12. Чем больше точек соприкосновения частиц, тем больше поверхность контакта и меньше удельная поверхность. Под поверхностью контакта для порошков понимают поверхность двух соприкасающихся частиц, расположенную в зоне действия молекулярных сил (~0,1 нм). Для сферической частицы радиусом r поверхностью контакта считается поверхность ее сегмента с высотой h = 0,1 нм, а доля этой поверхности составляет
где Из приведенной формулы следует, что поверхность контакта увеличивается с уменьшением размера частиц. РАЗМЕРЫ ЧАСТИЦ ПОРОШКА (ДИСПЕРСНОСТЬ) От размера частиц зависит удельная площадь межфазной поверхности . Напомним, что для сферической частицы диаметра d:
а для частиц сложной формы
где - коэффициент, зависящий от формы частиц (> 6). Увеличение удельной межфазной поверхности приводит к следующему: • интенсификации процессов, протекающих на поверхности порошка; • усилению яркости окраски пигментов; • повышению качества композиционных материалов; • улучшению вкусовых качеств пищевых продуктов. Однако с уменьшением размеров частиц порошка усиливаются и его негативные свойства: • слеживаемость; • прилипаемость к поверхностям оборудования и тары; • уменьшение текучести (сыпучести). Это затрудняет технологические процессы: смешение, дозировку, транспортировку и др. Начиная с некоторого критического размера частиц ( где n - число контактов, m - масса частицы; g - ускорение свободного падения. Дальнейшее уменьшение размеров частиц приводит к самопроизвольному образованию пространственных структур. Для высокодисперсных порошков критический размер:
где Высокодисперсные порошки с диаметром частиц d гораздо меньше являются связнодисперсными, в них возникает пространственная структура. Если 5.5.4. СВОЙСТВА ПОРОШКОВ Характерными свойствами порошков являются способность к течению и распылению, флуидизация (переход в состояние, подобное жидкому) и гранулирование. СПОСОБНОСТЬ К ТЕЧЕНИЮ И РАСПЫЛЕНИЮ Порошки, так же как сплошные тела, способны течь под действием внешнего усилия, направленного тангенциально (по касательной) к поверхности. Способность к течению или движению порошка на поверхности слоя наблюдается при пересыпании продуктов или при пневматическом транспортировании сыпучих продуктов. Такое движение лежит в основе переноса песка, почвы, снега ветром: песчаные и снежные бури, эрозия почв. В отличие от течения сплошных тел течение порошков заключается в отрыве слоя частиц от себе подобных или от поверхности и в перемещении отдельных частиц или их агрегатов при сохранении границы раздела между ними. Движение может осуществляться тремя способами: • частицы перекатываются по поверхности; • частицы отрываются и падают обратно, т.е. переносятся "прыжками"; • частицы переносятся в состоянии аэрозоля. В качестве примера рассмотрим движение песка, помещенного толстым слоем на дно аэродинамической трубы. При определенной скорости воздуха частицы, выступающие из слоя песка, начинают перекатываться по поверхности. Однако, попав в небольшие углубления, они останавливаются. Если увеличить скорость воздуха, некоторое количество частиц перекатится по поверхности и остановится и т.д. Движущиеся песчинки, сталкиваясь с более крупными, выступающими над поверхностью, подскакивают. При некоторой скорости воздуха, называемой критической, большая часть частиц будет передвигаться прыжками. Из полидисперсного порошка выдувается более мелкая фракция. Самая тонкая фракция под действием воздушного потока переходит в состояние аэрозоля и в таком виде перемещается над поверхностью порошка. Опыты показали, что для порошка с частицами, имеющими радиус больше 50 мкм, критическая скорость "течения" по поверхности пропорциональна Рассмотренный выше характер течения порошков обусловливает зависимость текучести порошков от адгезионных и аутогезионных сил, затрудняющих отрыв и передвижение частиц. Учитывая рассмотренную выше зависимость интенсивности межчастичных взаимодействий от размеров частиц, можно сделать важный практический вывод: грубодисперсные порошки обладают более высокой текучестью, чем высокодисперсные. Следует также иметь в виду, что для мягких веществ характерна пластическая деформация, в результате которой увеличивается площадь контакта частиц, а значит, уменьшается текучесть. Важной характеристикой порошка является его распыляемостъ при пересыпании. Она определяется силами сцепления между частицами, следовательно, увеличивается при возрастании размеров частиц и уменьшается с увеличением влажности. Существует несколько эмпирических закономерностей: • гидрофобные порошки распыляются лучше, чем гидрофильные; • порошки из твердых веществ распыляются лучше, чем из мягких; • монодисперсные порошки распыляются лучше полидисперсных. ФЛУИДИЗАЦИЯ (ПСЕВДООЖИЖЕНИЕ) Псевдоожижение - это превращение слоя порошка под влиянием восходящего газового потока в систему, твердые частицы которой находятся во взвешенном состоянии, напоминающую жидкость - псевдоожиженный слой. Из-за внешнего сходства с кипящей жидкостью, псевдоожиженный слой часто называют кипящим слоем. Простейшую псевдоожиженную систему создают в заполненном слоем порошка вертикальном аппарате, через днище которого равномерно по сечению вводят инертный сжижающий агент (газ). При его небольшой скорости W порошок неподвижен. С увеличением W высота слоя начинает возрастать (слой расширяется). Когда W достигает критического значения, при котором сила гидравлического сопротивления слоя восходящему потоку становится равной весу твердых частиц, слой приобретает текучесть и переходит в псевдоожиженное состояние. Если порошок является высокодисперсным, сказывается сила сцепления частиц и наблюдается не равномерное расширение порошка, а образование отдельных агрегатов. Между ними возникают каналы, по которым проходит значительная часть газа. Это агрегативная флуидизация. Так как с увеличением размера частиц гидродинамические силы возрастают, а молекулярные силы ослабевают, можно ожидать, что при некоторой средней степени дисперсности порошка условия для флуидизации будут оптимальными. И действительно, наиболее равномерная и полная флуидизация наблюдается для порошков, радиус которых близок к 20-25 мкм. Линейная скорость сжижающего агента, при которой порошок переходит в псевдоожиженное состояние, называется скоростью начала псевдоожижения или его первой критической скоростью При дальнейшем возрастании W слой разрушается и начинается интенсивный вынос порошка из аппарата. Отвечающая данному состоянию слоя скорость потока называется скоростью уноса (свободного витания) частиц или второй критической скоростью псевдоожижения Псевдоожижение газом - наиболее распространенный способ получения псевдоожиженных систем, хотя существуют и другие способы. Псевдоожиженный слой применяется очень широко: • псевдоожижение в проточных системах "газ - твердое тело" часто применяют при нагревании и охлаждении, адсорбции, сушке и т.д.; при этом создаются оптимальные условия взаимодействия фаз; • многочисленные химические процессы; • получение гранулированных продуктов. ПНЕВМОТРАНСПОРТ Это вид трубопроводного транспорта для перемещения сыпучих материалов под действием газа. Пневмотранспорт широко используется в химической, нефтехимической, нефтеперерабатывающей и других отраслях промышленности не только для перемещения материалов, но и как составная часть технологических процессов в системах "газ - твердое тело". Преимущества пневмотранспорта: • простота; • высокая производительность и надежность; • возможность полной автоматизации. Наиболее распространенный транспортирующий агент - воздух, хотя по технологическим соображениям могут использоваться и другие газы. Скорость перемещения материала зависит от: • размеров частиц; • плотности частиц; • концентрации твердой фазы; • плотности, вязкости и скорости газа. Скорость транспортирования пылевидных материалов низкой концентрации может приближаться к скорости движения газа, при пневмотранспорте в плотном слое скорость не превышает 4-7 м/с. ГРАНУЛИРОВАНИЕ Гранулирование (грануляция) - формирование твердых частиц (гранул) определенных размеров и формы с заданными свойствами. Размер гранул зависит от вида материала, способа его дальнейшей переработки и применения и составляет обычно (в мм): • для минеральных удобрений - 1-4; • для термопластов - 2-5; • для реактопластов - 0,2-1,0; • для каучуков и резиновых смесей - 15-25; • для лекарственных препаратов (таблетки) - 3-25. Формирование гранул размером меньше 1 мм иногда называют микрогранулированием. По своей природе гранулирование является процессом, обратным флуидизации и распылению. Гранулирование может быть основано на уплотнении порошкообразных материалов с использованием связующих или без них. Оно улучшает условия хранения веществ и транспортировки; позволяет механизировать и автоматизировать процессы последующего использования продуктов; повышает производительность и улучшает условия труда; снижает потери сырья и готовой продукции. Важнейшими методами гранулирования являются сухое гранулирование, мокрое скатывание и прессование. Сухое гранулирование. При сухом гранулировании путем обкатывания в специальных вращающихся барабанах в порошкообразную массу вводят "зародыши" - мелкие плотные комочки того же вещества, что и порошок, или инородные (зерна растений, кристаллы сахара и т.д.), важно только, чтобы они не были намного тяжелее, чем вещество порошка. При обкатывании порошок как бы налипает на зародыши, и при этом образуются сферические гранулы. Число гранул обычно равно числу зародышей, и это позволяет, меняя соотношение между количеством порошка и зародышей, получать гранулы любого размера вплоть до 1-2 см в поперечнике. Важно отметить, что с увеличением соотношения "порошок - зародыши" снижается прочность гранул. Установлено, что гранулирование идет наиболее эффективно при средней скорости обкатывания. При очень больших скоростях центробежная сила прижимает весь порошок к стенкам барабана и порошок не обкатывается. При очень малых скоростях не достигается вращательного движения порошка, при котором один слой, накатываясь на другой, обусловливает трение частиц, необходимое для гранулирования. Отдельные частицы порошка под действием молекулярных сил вступают во взаимодействие, образуя агрегаты. Причиной возникновения достаточно прочной связи между частицами может быть либо контакт частиц в особо активных участках, либо соприкосновение частиц плоскими гранями, в результате чего межмолекулярные силы действуют на сравнительно большой площади. Если порошок перемешивать или пересыпать с не слишком большой скоростью, ведущей к разрушению агрегатов, в порошке постепенно будут накапливаться агрегаты частиц. Вследствие меньшей кривизны поверхности этих агрегатов при столкновении их с отдельными частицами последние прилипают к ним особенно прочно. Все это приводит к тому, что постепенно весь порошок превращается в агрегаты-гранулы. Форма этих агрегатов должна быть близкой к сферической, так как все выступы на поверхности этих гранул сглаживаются при перемешивании или пересыпании. Положительную роль зародышей при гранулировании можно объяснить их большей массой и меньшей кривизной поверхности по сравнению с частицами порошка, что способствует налипанию отдельных частиц на зародыши, это и приводит к гранулированию. С увеличением длительности обкатывания возрастает плотность и прочность гранул. Сухое гранулирование имеет место также при неинтенсивных механических воздействиях. Так, при просеивании муки через сита на их поверхности возникает (вследствие толчков при перекатывании частичек и мягких ударов гранулы о гранулу) большое число контактов и образуются не очень прочные окатыши. Мокрое окатывание. Первая стадия заключается в смачивании частиц порошка связующим, в качестве которого используется вода, сульфит - спиртовая барда, смесь с водой извести, глины, шлаков и других вяжущих материалов. В результате образуются отдельные комочки - агломераты частиц и происходит наслаивание мелких частиц на более крупные. Вторая стадия состоит в уплотнении агломератов в слое материала. Этот процесс осуществляется в барабанных, тарельчатых или вибрационных грануляторах. Прессование - получение гранул в форме брикетов, плиток, таблеток путем уплотнения сухих порошков, имеющих влажность до 15% , иногда с последующим дроблением спрессованного материала. Для прессования используют валковые и вальцевые прессы или таблеточные машины. Прессование происходит в формах под высоким давлением. Энергия расходуется на уплотнение заготовки в результате деформации частиц и их смещения в поры, а также на преодоление сил трения между частицами и о стенки формы. При повышении давления увеличивается плотность материала и площадь контакта между частицами. Чем больше площадь контакта, тем прочнее связь между частицами. Для упрочнения заготовки в нее иногда добавляют некоторое количество связующих. СЛЕЖИВАНИЕ Слеживание - процесс, обусловленный длительным нахождением сыпучих материалов в неподвижном состоянии. В результате слеживания сыпучие материалы теряют способность течь и могут превратиться в монолит. Особый вред слеживание оказывает при хранении муки, сахара, крахмала, дрожжей и других пищевых масс. Количественно слеживание можно характеризовать прочностью слежавшегося материала на разрыв. Она равна прочности индивидуальных контактов Пк, умноженной на их число N, в расчете на единицу поверхности сыпучих материалов: При слеживании одновременно происходят два процесса. Первый из них связан с увеличением числа контактов N, вследствие постепенного проникновения мелких частиц в пространство между крупными частицами. Второй обусловлен увеличением прочности индивидуальных контактов вследствие заполнения имеющихся пустот. Оба процесса приводят к повышению прочности сыпучей массы в целом и к потере ее подвижности вплоть до образования монолита. Связнодисперсные порошки в той или иной мере подвергаются слеживанию. Растворимые в воде порошки (минеральные удобрения, сахарный песок) проявляют склонность к слеживанию при увлажнении и последующем высушивании, так как при достижении пересыщения раствора выделяются кристаллы, которые образуют "мостики срастания" между частицами порошка. Слеживаемость порошков при хранении в емкости может вызывать увеличение площади контакта между частицами в результате их пластической деформации под тяжестью вышележащих слоев. Способы борьбы со слеживанием можно условно разделить на две большие группы: активные и пассивные. Активные способы предотвращают слеживание. Они связаны с воздействием на сыпучую пищевую массу до начала слеживания. Пассивные способы - это возвращение слежавшемуся продукту исходной текучести или уменьшение отрицательного влияния слеживания. Предотвратить слеживание можно следующими путями: • регулированием физико-химических свойств продуктов. Гигроскопические порошки гидрофобизируют, модифицируя поверхность частиц с помощью ПАВ, а в ряде случаев - вводя твердые высокодисперсные, нерастворимые в воде добавки; • введением водопоглощающих добавок (например, в сахар добавляют измельченную мальтозу или глюкозу, в поваренную соль, используемую в технических целях, - до 2% порошка цеолита); • укрупнением частиц порошка с образованием гранул и таблеток; • герметизацией емкостей для хранения порошков. 5.5.5. УСТОЙЧИВОСТЬ ПОРОШКОВ Порошки неустойчивы по отношению к агрегации и седиментации. Это объясняется тем, что газообразная среда не может взаимодействовать с дисперсной фазой в такой степени, чтобы поверхностная энергия снижалась до необходимых значений. Малая плотность газов ограничивает возможности регулирования также седиментационной устойчивости. 5.5.6. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ПОРОШКОВ Область распространения порошков необъятна. Достаточно вспомнить, что прогретая солнцем почва, песчаные отмели и пляжи, грунтовые дороги, покрытые толстым слоем пыли, - все это примеры порошкообразных систем. Зимой выпадает снег, который также можно рассматривать как порошкообразную систему, причем на его примере можно проиллюстрировать все свойства порошков, которые мы рассматривали в этой главе: способность к течению и распылению, слеживаемость, гранулирование и др. Эти свойства в природных системах часто приводят к катастрофическим последствиям: песчаные и снежные бури, суховеи, снежные лавины. Столь же необъятной является и область практического применения порошков. Кроме того, порошки имеют немалое значение и как самостоятельные объекты. Практически любая отрасль промышленности в той или иной степени использует многочисленные порошкообразные материалы. Не претендуя на полноту освещения, рассмотрим здесь лишь некоторые аспекты применения порошков в пищевой и химической промышленности. ПИЩЕВАЯ ПРОМЫШЛЕННОСТЬ Многие продукты пищевых производств выпускаются в виде порошков: мука, крахмал, сахарный песок, сахарная пудра, специи, молотые кофе и какао, сухое молоко и сливки, различные крупы и др. Некоторые пищевые продукты выпускаются в виде гранул и таблеток, например, гранулированные чай и кофе. Многие виды пищевого сырья в технологических процессах используются в виде порошков: мука, крахмал, сухое молоко и сухие сливки, сахарная пудра, какао-порошок, поваренная соль, размолотые пряности, горчица и др. Качество получаемых продуктов во многом зависит от степени дисперсности используемого порошка и его предварительной подготовки. Так, своеобразная нежность шоколадных изделий определяется степенью размола какао-порошка. Для получения высококачественного шоколада исходный какао-порошок должен содержать частицы размером не более 10-16 мкм. Для образования теста нормальной консистенции мука должна обладать определенной влагопоглотительной способностью, которая возрастает с увеличением тонкости помола муки. Кроме того, мука подвергается предварительной подготовке. Ее выдерживают в темном помещении при температуре не ниже 12, а затем просеивают. При этом мука освобождается от посторонних частиц и аэрируется, что оказывает благоприятное влияние на процессы брожения. Кроме того, при просеивании разрушаются комки, образующиеся при хранении муки за счет слипания частиц. И в домашних условиях при приготовлении теста рекомендуется предварительно просеивать муку. Если вместо муки используется манная крупа, которую получают в результате гораздо более грубого помола пшеницы, то технология приготовления теста (манника) изменяется, она включает в себя стадию предварительного набухания крупы. ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ Порошки - одна из наиболее распространенных форм применения веществ в химико-технологических процессах переработки и получения различных материалов. Достаточно отметить, что большинство продуктов химических предприятий выпускается в виде порошков, гранул или окатышей, например, минеральные удобрения, полимеры, красители, ионообменные смолы, флокулянты, химические реактивы для учебных, научно-исследовательских и заводских лабораторий и др. Сверхтонкие металлические порошки являются эффективными катализаторами. В химических синтезах они часто используются в виде суспензий. Так, например, органозоли никеля успешно применяются в процессах гидрирования жиров и других ненасыщенных соединений в жидкой фазе. Скорость гидрирования в присутствии такого катализатора повышается в десятки раз, что объясняется высокой удельной поверхностью этих порошков. Высокодисперсные порошки используются также в качестве стабилизаторов микрогетерогенных систем, в частности эмульсий. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Какие дисперсные системы называются порошками, по каким признакам они классифицируются? 2. Какие методы получения порошков вам известны? Какие химические реакции лежат в основе конденсационного метода? 3. Что называется когезией? Может ли когезия определять насыпную массу порошка? 4. В чем состоит сущность аутогезии? Чем она определяется? 5. К чему приводит увеличение межфазной удельной поверхности порошка? Что называется критическим размером порошка? 6. Перечислите характерные свойства порошков. 7. От чего зависит распыляемость порошка? 8. Что называется флуидизацией? Какими способами создают псевдоожиженные системы? 9. Перечислите важнейшие методы гранулирования. 10. Какие факторы влияют на слеживание порошка? Как можно бороться со слеживанием? ЗАКЛЮЧЕНИЕ В IV части учебника (главы 15-19) рассмотрены пять типов дисперсных систем, различающихся природой дисперсной фазы и дисперсионной среды: суспензии (Т/Ж), эмульсии (Ж/Ж), пены (Г/Ж), аэрозоли (Ж/Г, Т/Г), порошки (Т/Г). Эти системы имеют много общего: • частицы дисперсной фазы имеют размеры от 1 мкм и выше, т.е. указанные системы занимают промежуточное положение между коллоидными растворами и макросистемами; • образование всех указанных систем возможно двумя путями: диспергационным и конденсационным; • все указанные системы характеризуются наличием большой межфазной поверхности (до 1 ), что обусловливает их термодинамическую неустойчивость - стремление к укрупнению частиц дисперсной фазы; различают седиментационную и агрегативную устойчивость; • агрегативная устойчивость и длительное существование дисперсных систем с сохранением их свойств обеспечивается введением стабилизаторов: низкомолекулярных электролитов, ПАВ, полимеров. В зависимости от природы стабилизатора реализуются несколько факторов устойчивости: • электростатический; • адсорбционно-сольватный; • структурно-механический; • энтропийный; • гидродинамический. Наряду с общими свойствами каждая из дисперсных систем имеет свои особенности, которые были рассмотрены в соответствующих главах. 6. СПИСОК ЛИТЕРАТУРЫ Амелин А.Г. Теоретические основы образования туманов при конденсации паров. М.: Химия, 1972. 109 с. Вейцер Ю.И., Минц Д.М. Высокомолекулярные флокулянты в процессе очистки природных и сточных вод. М.: Стройиздат, 1984. С. 201. Воюцкий С.С. Курс коллоидной химии. М.: Химия, 1976. С. 512. Зимон А.Д., Лещенко Н.Ф. Коллоидная химия. М.: Химия, 1991. Ковалевич О.В. Коллоидная химия. Кемерово, 1997. 144 с. Кругляков П.М., Ежерова Д.Р. Пены и пенные пленки. М.: Химия. 1990. 492 с. Маркин А.П., Таубе П.Р. Непрочное чудо. М.: Химия, 1983. 224 с. Методы испытаний водных растворов ПАВ. М.: НИИТЭМ, 1965. 86 с. Райст В.П. Аэрозоли. М.: Химия, 1987. 280 с. Ребиндер П.А. Поверхностные явления в дисперсных системах. Коллоидная химия. Избранные труды. М.: Наука, 1978. С. 398. Сургутский В.П., Перевозова В.А. Физико-химические и коллоидные явления в технологии продуктов общественного питания. Красноярск, 1992. 60 с. Тихомиров В.К. Пены. Теория и практика их получения и разрушения. М.: Химия, 1983. 254 с. Урьев Н.Б. Физико-химические основы технологии дисперсных систем и материалов. М.: Химия, 1988. 256 с. Урьев Н.В., Талейсник М.А. Пищевые дисперсные системы. М.: Агропромиздат, 1985. 296 с. Фридрихсберг Д.А. Курс коллоидной химии. Л.: Химия, 1984. 308 с. Фролов Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М.: Химия, 1988. С. 464. Цетлин В.М. Аэрозольные баллоны. Л.: Химия, 1970. 160 с. Цюрупа Н.Н. Практикум по коллоидной химии. М., 1963. Шварц А., Деррк Дж., Берг Дж. ПАВ и моющие средства. М.: Издатинлит, 1980. 329 с. Шерман Ф. Эмульсии. Л.: Химия, 1972. 448 с. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||


 ).
).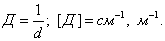
 - это межфазная поверхность (
- это межфазная поверхность ( ), приходящаяся на единицу объема дисперсной фазы (V) или ее массы (m).
), приходящаяся на единицу объема дисперсной фазы (V) или ее массы (m).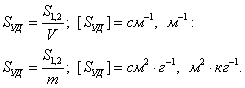
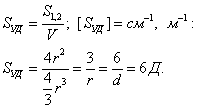
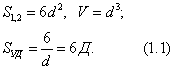
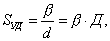
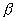 - коэффициент формы частиц (для сферических и кубических частиц = 6).
- коэффициент формы частиц (для сферических и кубических частиц = 6).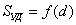 (см. уравнение 1.1) графически выражается равносторонней гиперболой (рис. 1.2 ).
(см. уравнение 1.1) графически выражается равносторонней гиперболой (рис. 1.2 ).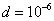 cм, величина общей межфазной поверхности возрастет с 6
cм, величина общей межфазной поверхности возрастет с 6  до 600
до 600  .
.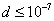 см гипербола обрывается, так как частицы уменьшаются до размеров отдельных молекул, и гетерогенная система становится гомогенной, в которой межфазная поверхность отсутствует. По степени дисперсности ДС делятся на:
см гипербола обрывается, так как частицы уменьшаются до размеров отдельных молекул, и гетерогенная система становится гомогенной, в которой межфазная поверхность отсутствует. По степени дисперсности ДС делятся на: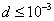 см;
см;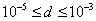 см;
см;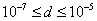 см;
см;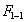 больше сил взаимодействия между молекулами газа
больше сил взаимодействия между молекулами газа 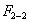 . Возникает вопрос: какие межмолекулярные взаимодействия реализуются на межфазной поверхности? Молекула А (рис. 2.1 ) внутри жидкости окружена со всех сторон другими молекулами. Силы взаимодействия при этом взаимно уравновешиваются. На молекулу В, находящуюся на межфазной поверхности, с одной стороны действуют молекулы жидкости, а с другой - молекулы газа. Поскольку
. Возникает вопрос: какие межмолекулярные взаимодействия реализуются на межфазной поверхности? Молекула А (рис. 2.1 ) внутри жидкости окружена со всех сторон другими молекулами. Силы взаимодействия при этом взаимно уравновешиваются. На молекулу В, находящуюся на межфазной поверхности, с одной стороны действуют молекулы жидкости, а с другой - молекулы газа. Поскольку 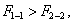 возникает результирующая сила Р, направленная в глубь жидкости. Эту силу часто называют внутренним давлением.
возникает результирующая сила Р, направленная в глубь жидкости. Эту силу часто называют внутренним давлением.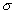 ) равно термодинамически обратимой
) равно термодинамически обратимой , изотермической работе, которую надо совершить, чтобы увеличить площадь межфазной поверхности на единицу.
, изотермической работе, которую надо совершить, чтобы увеличить площадь межфазной поверхности на единицу.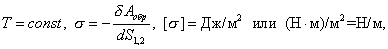
 - термодинамически обратимая работа, затраченная на образование поверхности площадью
- термодинамически обратимая работа, затраченная на образование поверхности площадью  , так как работа совершается над системой, то она является отрицательной.
, так как работа совершается над системой, то она является отрицательной.
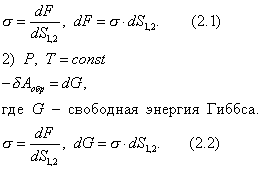
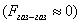 и, значит, поверхностное натяжение характеризует интенсивность межмолекулярных сил в конденсированной фазе. В таблице 2.1. приведены значения некоторых веществ на границе с воздухом.
и, значит, поверхностное натяжение характеризует интенсивность межмолекулярных сил в конденсированной фазе. В таблице 2.1. приведены значения некоторых веществ на границе с воздухом.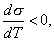 причем температурный коэффициент
причем температурный коэффициент 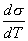 имеет практически постоянное отрицательное значение вплоть до температур, близких к критической. При критической температуре исчезает различие между граничащими фазами, и поверхностное натяжение становится равным нулю. Для большинства неполярных жидкостей температурная зависимость поверхностного натяжения линейная и в первом приближении может быть представлена соотношением:
имеет практически постоянное отрицательное значение вплоть до температур, близких к критической. При критической температуре исчезает различие между граничащими фазами, и поверхностное натяжение становится равным нулю. Для большинства неполярных жидкостей температурная зависимость поверхностного натяжения линейная и в первом приближении может быть представлена соотношением: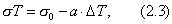
 - поверхностное натяжение соответственно при температуре T и при стандартной температуре;
- поверхностное натяжение соответственно при температуре T и при стандартной температуре;  T - разность между данной и стандартной температурами; а - постоянная, равная температурному коэффициенту поверхностного натяжения, взятому с обратным знаком. Другие вещества менее строго следуют указанной зависимости, но часто отклонениями можно пренебречь, так как температурные коэффициенты мало зависят от температуры.
T - разность между данной и стандартной температурами; а - постоянная, равная температурному коэффициенту поверхностного натяжения, взятому с обратным знаком. Другие вещества менее строго следуют указанной зависимости, но часто отклонениями можно пренебречь, так как температурные коэффициенты мало зависят от температуры. . Рассмотрим, какие процессы в поверхностном слое отвечают указанным условиям.
. Рассмотрим, какие процессы в поверхностном слое отвечают указанным условиям. то
то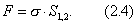
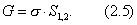
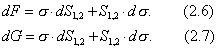
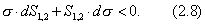
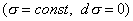 . В этих случаях самопроизвольно могут протекать процессы, сопровождающиеся уменьшением площади межфазной поверхности
. В этих случаях самопроизвольно могут протекать процессы, сопровождающиеся уменьшением площади межфазной поверхности 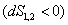 . К поверхностным явлениям, связанным с уменьшением поверхности, можно отнести:
. К поверхностным явлениям, связанным с уменьшением поверхности, можно отнести: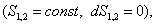 условие (2.8) может выполняться за счет уменьшения поверхностного натяжения
условие (2.8) может выполняться за счет уменьшения поверхностного натяжения 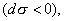 которое может быть обусловлено процессом адсорбции.
которое может быть обусловлено процессом адсорбции.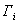 ).
).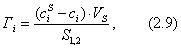
 - молярная концентрация i-го компонента соответственно в поверхностном слое и в объеме фазы,
- молярная концентрация i-го компонента соответственно в поверхностном слое и в объеме фазы,  - объем поверхностного слоя, который принято считать двухмерным и равным 1
- объем поверхностного слоя, который принято считать двухмерным и равным 1 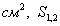 - площадь поверхностного слоя.
- площадь поверхностного слоя.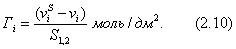
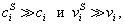 адсорбцию характеризуют величиной
адсорбцию характеризуют величиной  , называемой абсолютной адсорбцией.
, называемой абсолютной адсорбцией.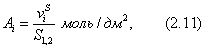
 - количество вещества в поверхностном слое.
- количество вещества в поверхностном слое. ) относят к массе адсорбента m, используя величину удельной адсорбции
) относят к массе адсорбента m, используя величину удельной адсорбции  :
: С, 1 атм) 1 моль любого газа занимает объем, равный 22,4
С, 1 атм) 1 моль любого газа занимает объем, равный 22,4 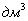 . Тогда удельная адсорбция измеряется
. Тогда удельная адсорбция измеряется 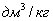 .
.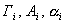 > 0, адсорбцию называют положительной (в дальнейшем термином "адсорбция" будем называть именно положительную адсорбцию), если < 0, то имеет место отрицательная адсорбция.
> 0, адсорбцию называют положительной (в дальнейшем термином "адсорбция" будем называть именно положительную адсорбцию), если < 0, то имеет место отрицательная адсорбция.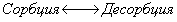
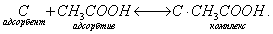
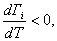 так как увеличивается скорость десорбции.
так как увеличивается скорость десорбции.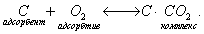
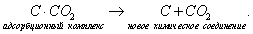
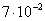 мм, а плотность угля -
мм, а плотность угля - 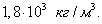
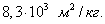 Рассчитайте средний диаметр частиц силикагеля, если его плотность равна 2,2
Рассчитайте средний диаметр частиц силикагеля, если его плотность равна 2,2 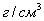 .
.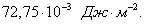 Чему равна избыточная поверхностная энергия капли ртути диаметром 1,2 мм?
Чему равна избыточная поверхностная энергия капли ртути диаметром 1,2 мм?
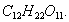
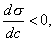 для поверхноcтно-инактивных
для поверхноcтно-инактивных 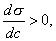 а для поверхностно-неактивных
а для поверхностно-неактивных 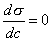 (на графике
(на графике 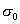 - поверхностное натяжение воды).
- поверхностное натяжение воды).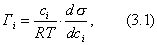
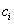 - его молярная концентрация в растворе, Т - температура, при которой происходит адсорбция, R - газовая постоянная,
- его молярная концентрация в растворе, Т - температура, при которой происходит адсорбция, R - газовая постоянная, 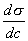 - изменение поверхностного натяжения раствора при изменении концентрации на
- изменение поверхностного натяжения раствора при изменении концентрации на 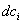 .
.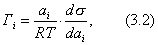
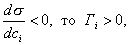 т.е. наблюдается положительная избыточная адсорбция - 1-е вещество концентрируется на поверхности раствора; если
т.е. наблюдается положительная избыточная адсорбция - 1-е вещество концентрируется на поверхности раствора; если 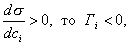 т.е. наблюдается отрицательная избыточная адсорбция - 1-е вещество уходит с поверхности в объем раствора. Для того чтобы рассчитать по уравнению адсорбции Гиббса, надо знать
т.е. наблюдается отрицательная избыточная адсорбция - 1-е вещество уходит с поверхности в объем раствора. Для того чтобы рассчитать по уравнению адсорбции Гиббса, надо знать 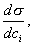 т.е. производную поверхностного натяжения от концентрации 1-го компонента. Из математики известно, что производная - это тангенс угла наклона касательной, проведенной к данной точке. Следовательно, имея зависимость от с (рис. 3.2 ), можно определить значение
т.е. производную поверхностного натяжения от концентрации 1-го компонента. Из математики известно, что производная - это тангенс угла наклона касательной, проведенной к данной точке. Следовательно, имея зависимость от с (рис. 3.2 ), можно определить значение 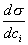 (при концентрации
(при концентрации 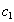 касательная в точке 1).
касательная в точке 1).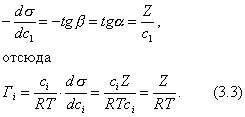
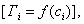 общий вид которой представлен на рис. 3.3 . По мере увеличения концентрации адсорбция возрастает вначале резко, затем все медленнее, асимптотически приближаясь к некоторой величине, называемой предельной адсорбцией
общий вид которой представлен на рис. 3.3 . По мере увеличения концентрации адсорбция возрастает вначале резко, затем все медленнее, асимптотически приближаясь к некоторой величине, называемой предельной адсорбцией . Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной концентрации ПАВ в растворе
. Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной концентрации ПАВ в растворе  она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна (т.е. однослойна), дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.
она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна (т.е. однослойна), дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.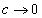 ). Эту величину П.А. Ребиндер (1924) назвал поверхностной активностью g.
). Эту величину П.А. Ребиндер (1924) назвал поверхностной активностью g.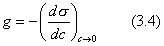
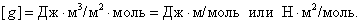
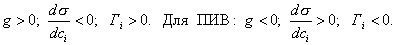
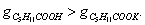
 ).
).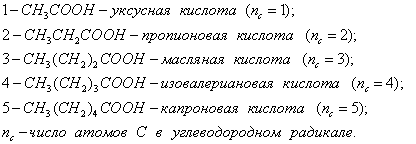
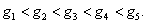
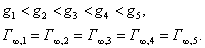
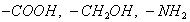 ) и неполярного углеводородного радикала (R). Это позволило ему сформулировать принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверхностного слоя толщиной в одну молекулу. Образуется так называемый мономолекулярный слой. Рассмотрим схему образования такого слоя в зависимости от концентрации ПАВ в растворе (рис. 3.6 ).
) и неполярного углеводородного радикала (R). Это позволило ему сформулировать принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверхностного слоя толщиной в одну молекулу. Образуется так называемый мономолекулярный слой. Рассмотрим схему образования такого слоя в зависимости от концентрации ПАВ в растворе (рис. 3.6 ). ).
).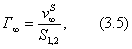
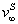 - количество ПАВ в поверхностном слое. Так как поверхностный слой полностью заполнен молекулами ПАВ,
- количество ПАВ в поверхностном слое. Так как поверхностный слой полностью заполнен молекулами ПАВ,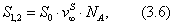
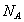 - число Авогадро.
- число Авогадро.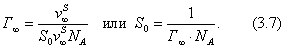
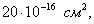 а предельных спиртов -
а предельных спиртов - 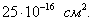 Из величины предельной адсорбция была найдена также длина молекулы
Из величины предельной адсорбция была найдена также длина молекулы  .
.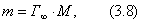
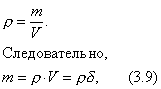
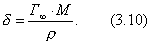
 нм для всего ряда. Величина 0,13 нм близка к диаметру атома углерода.
нм для всего ряда. Величина 0,13 нм близка к диаметру атома углерода.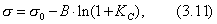
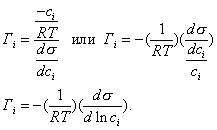
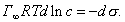
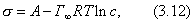
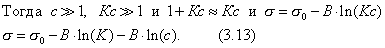
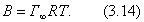
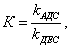
 - константа скорости адсорбции;
- константа скорости адсорбции;  - константа скорости десорбции.
- константа скорости десорбции.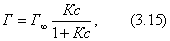
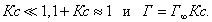 .
.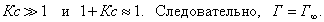
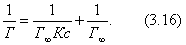
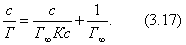
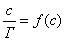 .
.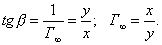
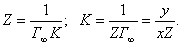
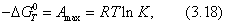
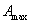 - работа адсорбции.
- работа адсорбции.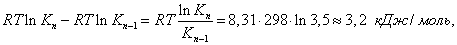
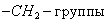 из поверхностного слоя в объемную фазу надо затратить 3,2 кДж/моль энергии. Это работа раздвижения диполей воды на величину объема - величина аддитивная и одинаковая для различных рядов алифатических предельных соединений. Постоянная разность работ адсорбции для двух соседних членов превращается в постоянное отношение (3-3,5), фигурирующее в правиле Дюкло-Траубе. Сущность этого правила, таким образом, заключается в том, что работа адсорбции на каждую
из поверхностного слоя в объемную фазу надо затратить 3,2 кДж/моль энергии. Это работа раздвижения диполей воды на величину объема - величина аддитивная и одинаковая для различных рядов алифатических предельных соединений. Постоянная разность работ адсорбции для двух соседних членов превращается в постоянное отношение (3-3,5), фигурирующее в правиле Дюкло-Траубе. Сущность этого правила, таким образом, заключается в том, что работа адсорбции на каждую 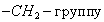 является постоянной, близкой к 3,5 кДж/моль.
является постоянной, близкой к 3,5 кДж/моль.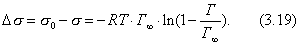
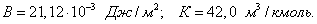 Поверхностное натяжение чистой воды при заданной температуре равно
Поверхностное натяжение чистой воды при заданной температуре равно 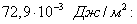
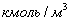 ,
,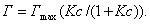 . Найдите графическим методом константы
. Найдите графическим методом константы 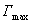 и К.
и К.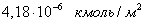 . Рассчитайте значение константы В в уравнении Шишковского при стандартной температуре.
. Рассчитайте значение константы В в уравнении Шишковского при стандартной температуре.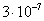 см.
см.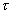 . Существуют методы, позволяющие экспериментально определить . Так, для паров кадмия, адсорбированных на стекле,
. Существуют методы, позволяющие экспериментально определить . Так, для паров кадмия, адсорбированных на стекле, 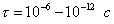 в зависимости от температуры; для паров аргона на стекле
в зависимости от температуры; для паров аргона на стекле 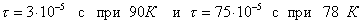 .
. 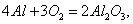
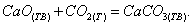
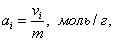
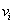 - количество i-гo газа, адсорбированного на твердом адсорбенте; m - масса адсорбента.
- количество i-гo газа, адсорбированного на твердом адсорбенте; m - масса адсорбента.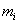 ):
):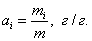
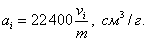
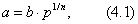
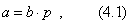
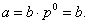
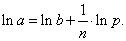
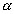 равен 1/n, а отрезок, отсекаемый ею на оси ординат, равен ln b. Уравнение Фрейндлиха часто используется при обработке экспериментальных результатов.
равен 1/n, а отрезок, отсекаемый ею на оси ординат, равен ln b. Уравнение Фрейндлиха часто используется при обработке экспериментальных результатов.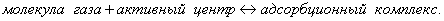
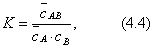
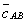 - концентрация образовавшегося на поверхности комплекса;
- концентрация образовавшегося на поверхности комплекса; 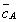 - концентрация активных центров;
- концентрация активных центров; 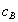 - концентрация газа.
- концентрация газа.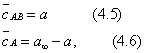
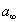 - емкость адсорбционного монослоя, т.е. число адсорбционных центров, приходящихся на единицу площади поверхности или на единицу массы адсорбента. Подставляя (4.5) и (4.6) в уравнение (4.4), получим:
- емкость адсорбционного монослоя, т.е. число адсорбционных центров, приходящихся на единицу площади поверхности или на единицу массы адсорбента. Подставляя (4.5) и (4.6) в уравнение (4.4), получим: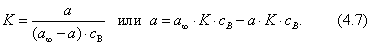
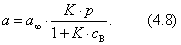
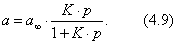
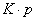 по сравнению с единицей. Тогда
по сравнению с единицей. Тогда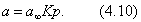
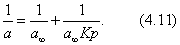
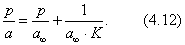
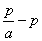 это уравнение прямой (рис. 4.3).
это уравнение прямой (рис. 4.3).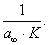
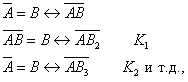
 - константы соответствующих адсорбционных равновесии.
- константы соответствующих адсорбционных равновесии.
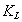 - константа конденсации пара, равная отношению активностей вещества в жидком состоянии
- константа конденсации пара, равная отношению активностей вещества в жидком состоянии 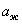 и в состоянии насыщенного пара -
и в состоянии насыщенного пара - 
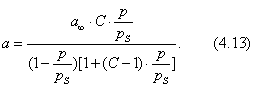
 - давление насыщенного пара при данной температуре,
- давление насыщенного пара при данной температуре, 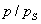 - относительное давление пара,
- относительное давление пара, 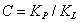 .
.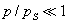 , уравнение (4.13) превращается в уравнение мономолекулярной адсорбции Ленгмюра, а при дальнейшем уменьшении давления (
, уравнение (4.13) превращается в уравнение мономолекулярной адсорбции Ленгмюра, а при дальнейшем уменьшении давления ( ) переходит в закон Генри. По мере приближения р к число свободных активных центров уменьшается и кратность комплексов растет. При р = происходит объемная конденсация пара. Таким образом, уравнение БЭТ описывай всю S-образную изотерму адсорбции (см. рис. 4.5). Точка А на этой кривой отвечает завершению монослоя адсорбтива.
) переходит в закон Генри. По мере приближения р к число свободных активных центров уменьшается и кратность комплексов растет. При р = происходит объемная конденсация пара. Таким образом, уравнение БЭТ описывай всю S-образную изотерму адсорбции (см. рис. 4.5). Точка А на этой кривой отвечает завершению монослоя адсорбтива.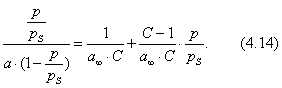
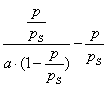 (рис. 4.7 ). Тангенс угла наклона прямой к оси абсцисс равен
(рис. 4.7 ). Тангенс угла наклона прямой к оси абсцисс равен 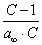 , а отрезок, отсекаемый на оси ординат, -
, а отрезок, отсекаемый на оси ординат, - 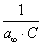 .
.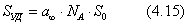
 , аргон - 0,138 , криптон - 0,195 .
, аргон - 0,138 , криптон - 0,195 .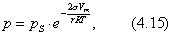
 - молярный объем этой жидкости, R - газовая постоянная, Т - температура.
- молярный объем этой жидкости, R - газовая постоянная, Т - температура.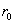 более 2-3 диаметров молекулы.
более 2-3 диаметров молекулы.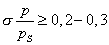 для микропор (
для микропор ( нм) уравнение Кельвина неприменимо.
нм) уравнение Кельвина неприменимо. графитированная сажа, белая сажа, аэросил.
графитированная сажа, белая сажа, аэросил. 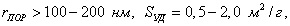 поры играют роль транспортных каналов;
поры играют роль транспортных каналов; в пределах 1,5-100 нм, в пределах 10-500
в пределах 1,5-100 нм, в пределах 10-500  . На стенках этих пор при малых давлениях происходит полимолекулярная адсорбция паров, которая с увеличением давления заканчивается капиллярной конденсацией. Из промышленных адсорбентов к ним относятся силикагели, алюмогели, алюмосиликагели.
. На стенках этих пор при малых давлениях происходит полимолекулярная адсорбция паров, которая с увеличением давления заканчивается капиллярной конденсацией. Из промышленных адсорбентов к ним относятся силикагели, алюмогели, алюмосиликагели.  к общему объему тела
к общему объему тела 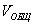 :
: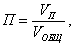
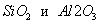 ), цеолиты.
), цеолиты.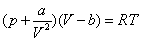
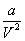 учитывает взаимное притяжение молекул газа).
учитывает взаимное притяжение молекул газа).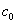 ) и после наступления адсорбционного равновесия (
) и после наступления адсорбционного равновесия (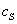 ):
):
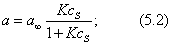
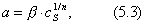
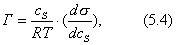
 - диэлектрической проницаемостью. Чем больше , тем больше полярность фазы. Исходя из правила Ребиндера, растворенное вещество будет адсорбироваться на твердом теле, если выполняется условие:
- диэлектрической проницаемостью. Чем больше , тем больше полярность фазы. Исходя из правила Ребиндера, растворенное вещество будет адсорбироваться на твердом теле, если выполняется условие: тем лучше, чем больше величина
тем лучше, чем больше величина 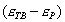 ; тем лучше, чем больше
; тем лучше, чем больше 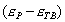
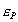 - диэлектрическая проницаемость растворителя,
- диэлектрическая проницаемость растворителя, 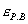 - диэлектрическая проницаемость растворенного вещества,
- диэлектрическая проницаемость растворенного вещества, 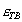 - диэлектрическая проницаемость твердого вещества.
- диэлектрическая проницаемость твердого вещества.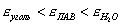 . Адсорбция будет тем большей, чем больше разность
. Адсорбция будет тем большей, чем больше разность 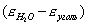 . При адсорбции молекулы ПАВ строго ориентированы: углеводородный радикал взаимодействует с поверхностью угля, а полярная часть - с водой. Этим правилом объясняется тот факт, что в водных растворах стирального порошка (ПАВ) гораздо легче и быстрее стираются синтетические ткани, чем хлопчатобумажные или льняные, так как последние являются гораздо более полярными, а значит,
. При адсорбции молекулы ПАВ строго ориентированы: углеводородный радикал взаимодействует с поверхностью угля, а полярная часть - с водой. Этим правилом объясняется тот факт, что в водных растворах стирального порошка (ПАВ) гораздо легче и быстрее стираются синтетические ткани, чем хлопчатобумажные или льняные, так как последние являются гораздо более полярными, а значит, 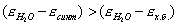 и адсорбция стирального порошка на синтетической ткани больше, чем на хлопчатобумажной или льняной.
и адсорбция стирального порошка на синтетической ткани больше, чем на хлопчатобумажной или льняной.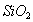 ), глину и т.д. Ориентация молекул ПАВ такова, что неполярный углеводородный радикал направлен в неполярный растворитель, а полярная часть молекулы взаимодействует с полярным адсорбентом. В этом случае выполняется неравенство:
), глину и т.д. Ориентация молекул ПАВ такова, что неполярный углеводородный радикал направлен в неполярный растворитель, а полярная часть молекулы взаимодействует с полярным адсорбентом. В этом случае выполняется неравенство: 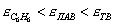
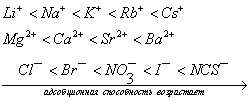
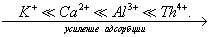
 , то адсорбироваться на кристалле будут ионы
, то адсорбироваться на кристалле будут ионы 
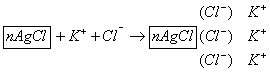
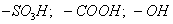 (фенольные). Примерами катионитов являются фенолформальдегидные смолы.
(фенольные). Примерами катионитов являются фенолформальдегидные смолы.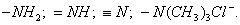
 - заряды обменивающихся ионов
- заряды обменивающихся ионов 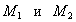 .
.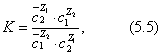
 - концентрация ионов в ионите, с - концентрация ионов в растворе.
- концентрация ионов в ионите, с - концентрация ионов в растворе.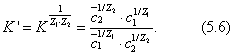
 . Поверхностное натяжение жидкости на границе с воздухом
. Поверхностное натяжение жидкости на границе с воздухом 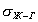 . Когда капля оказалась на твердой поверхности, между ними возникла граница, которая характеризуется поверхностным натяжением
. Когда капля оказалась на твердой поверхности, между ними возникла граница, которая характеризуется поверхностным натяжением 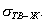 . Следовательно, поведение капли определяется соотношением
. Следовательно, поведение капли определяется соотношением 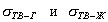 . Если
. Если 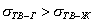 , то системе выгодно, чтобы капля закрыла часть твердой поверхности, т.е. растеклась по ней. При этом происходит частичная замена поверхности с большей поверхностной энергией
, то системе выгодно, чтобы капля закрыла часть твердой поверхности, т.е. растеклась по ней. При этом происходит частичная замена поверхности с большей поверхностной энергией 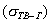 поверхностью с меньшей свободной энергией
поверхностью с меньшей свободной энергией 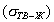 , что, естественно, приводит к уменьшению запаса энергии в системе. Однако если капля жидкости будет растекаться, то увеличится площадь поверхности "жидкость-газ", а это приведет к увеличению свободной энергии системы. Отсюда можно сделать вывод, что если
, что, естественно, приводит к уменьшению запаса энергии в системе. Однако если капля жидкости будет растекаться, то увеличится площадь поверхности "жидкость-газ", а это приведет к увеличению свободной энергии системы. Отсюда можно сделать вывод, что если 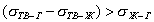 , будет происходить полное смачивание. Если
, будет происходить полное смачивание. Если 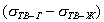 соизмеримо с , жидкость будет ограниченно растекаться по поверхности.
соизмеримо с , жидкость будет ограниченно растекаться по поверхности.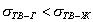 , наблюдается несмачивание твердого тела жидкостью, так как появление в системе поверхности (твердое тело-жидкость) вместо (твердое тело-газ) привело бы к увеличению свободной энергии системы. В этом случае капля жидкости в идеале должна принять сферическую форму и контактировать с твердой поверхностью только одной точкой, но в действительности на каплю жидкости действует сила тяжести, несколько сплющивая ее, поэтому форма капли лишь близка к сферической.
, наблюдается несмачивание твердого тела жидкостью, так как появление в системе поверхности (твердое тело-жидкость) вместо (твердое тело-газ) привело бы к увеличению свободной энергии системы. В этом случае капля жидкости в идеале должна принять сферическую форму и контактировать с твердой поверхностью только одной точкой, но в действительности на каплю жидкости действует сила тяжести, несколько сплющивая ее, поэтому форма капли лишь близка к сферической.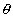 , иногда его называют углом смачивания.
, иногда его называют углом смачивания.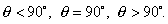
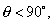 то такую поверхность называют гидрофильной, если
то такую поверхность называют гидрофильной, если 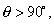 то поверхность называют гидрофобной.
то поверхность называют гидрофобной. и воздух - жидкость .
и воздух - жидкость .
 - смачивание полное или частичное; если
- смачивание полное или частичное; если 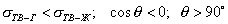 - несмачивание.
- несмачивание.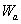 - это работа обратимого разрыва адгезионной связи, отнесенная к единице площади,
- это работа обратимого разрыва адгезионной связи, отнесенная к единице площади, 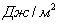 .
.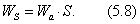
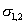 , жидкости 3 с поверхностным натяжением
, жидкости 3 с поверхностным натяжением 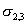 , а поверхность раздела с поверхностным натяжением
, а поверхность раздела с поверхностным натяжением 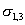 исчезнет.
исчезнет.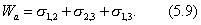
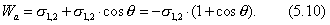
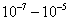 см, невидимых в оптический микроскоп, но представляющих собой агрегаты, состоящие из множества молекул или ионов, такого множества, что этим частицам присущи свойства отдельной термодинамической фазы, называемой дисперсной фазой.
см, невидимых в оптический микроскоп, но представляющих собой агрегаты, состоящие из множества молекул или ионов, такого множества, что этим частицам присущи свойства отдельной термодинамической фазы, называемой дисперсной фазой.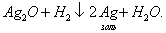
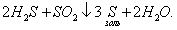
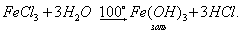
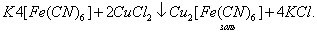
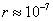 см) происходит задержка не только дисперсных частиц, но и молекул и ионов в растворах электролитов. Этот процесс, называемый гиперфильтрацией или обратным осмосом, широко применяется в настоящее время для очистки природных и технических вод. Принцип обратного осмоса представлен на рис. 6.2 .
см) происходит задержка не только дисперсных частиц, но и молекул и ионов в растворах электролитов. Этот процесс, называемый гиперфильтрацией или обратным осмосом, широко применяется в настоящее время для очистки природных и технических вод. Принцип обратного осмоса представлен на рис. 6.2 .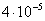 см (фиолетовый свет) до
см (фиолетовый свет) до 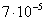 см (красный свет).
см (красный свет).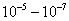 см).
см).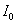 , справедливое при условии, что:
, справедливое при условии, что: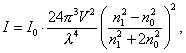
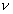 - частичная концентрация,
- частичная концентрация, 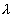 - длина волны;
- длина волны; 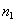 - показатель преломления частицы,
- показатель преломления частицы, 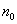 - показатель преломления среды.
- показатель преломления среды.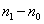 ). Таким образом, если показатели преломления
). Таким образом, если показатели преломления 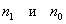 одинаковы, то светорассеяние будет отсутствовать и в неоднородной среде.
одинаковы, то светорассеяние будет отсутствовать и в неоднородной среде. , которой обычно пользуются при приготовлении растворов, связана с частичной концентрацией выражением:
, которой обычно пользуются при приготовлении растворов, связана с частичной концентрацией выражением: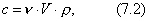
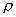 - плотность частицы.
- плотность частицы.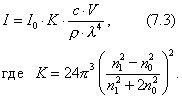
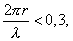
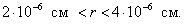 С увеличением r рост I замедляется, а при
С увеличением r рост I замедляется, а при 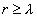 рассеяние заменяется отражением.
рассеяние заменяется отражением.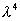 имеет и практическое значение, например, в сигнализации. Красный цвет выбран сигналом опасности именно потому, что он виден в туманную погоду на больших расстояниях, чем любой другой, вследствие малого рассеяния. Лампы синего света применяют для светомаскировки, когда хотят, чтобы они остались незамеченными с самолетов, так как синие лучи при прохождении через толстый слой воздуха, особенно если в нем содержатся частицы пыли или тумана, полностью рассеиваются.
имеет и практическое значение, например, в сигнализации. Красный цвет выбран сигналом опасности именно потому, что он виден в туманную погоду на больших расстояниях, чем любой другой, вследствие малого рассеяния. Лампы синего света применяют для светомаскировки, когда хотят, чтобы они остались незамеченными с самолетов, так как синие лучи при прохождении через толстый слой воздуха, особенно если в нем содержатся частицы пыли или тумана, полностью рассеиваются.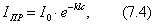
 - интенсивность прошедшего через золь света; k - коэффициент поглощения; I - толщина слоя золя; с - концентрация золя.
- интенсивность прошедшего через золь света; k - коэффициент поглощения; I - толщина слоя золя; с - концентрация золя.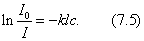
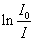 называют оптической плотностью раствора или экстинкцией. При работе с монохроматическим светом всегда указывают, при какой длине волны была определена оптическая плотность, обозначая ее
называют оптической плотностью раствора или экстинкцией. При работе с монохроматическим светом всегда указывают, при какой длине волны была определена оптическая плотность, обозначая ее 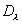 .
.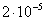 см, т.е. коллоидные частицы лежат за пределами видимости в обычном микроскопе.
см, т.е. коллоидные частицы лежат за пределами видимости в обычном микроскопе.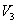 , подсчитывают число содержащихся в нем частиц, и находят частичную концентрацию
, подсчитывают число содержащихся в нем частиц, и находят частичную концентрацию 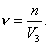 Если известна массовая концентрация золя с и плотность золя , то по формуле (7.2) можно найти средний объем частицы V:
Если известна массовая концентрация золя с и плотность золя , то по формуле (7.2) можно найти средний объем частицы V: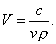
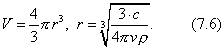
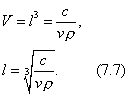
 см.
см.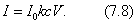
 той же концентрации, объем частиц в котором известен. Тогда:
той же концентрации, объем частиц в котором известен. Тогда: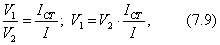
 - объем частиц в исследуемом растворе,
- объем частиц в исследуемом растворе,  - объем частиц в стандартном растворе.
- объем частиц в стандартном растворе.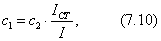
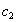 - концентрация стандартного раствора.
- концентрация стандартного раствора.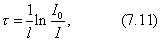
 существует соотношение:
существует соотношение:
 см?
см?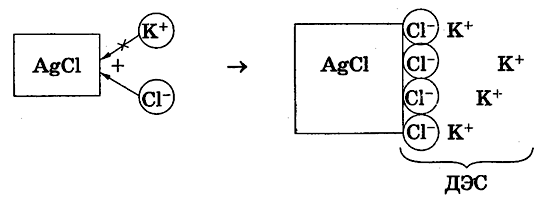
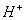 или
или 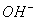 . Примером может служить возникновение ДЭС на границе: частицы твердого парафина - водный раствор щелочи. ДЭС образуется в результате избирательной адсорбции ионов .
. Примером может служить возникновение ДЭС на границе: частицы твердого парафина - водный раствор щелочи. ДЭС образуется в результате избирательной адсорбции ионов .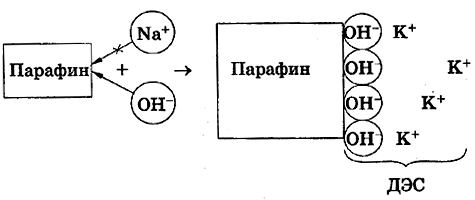
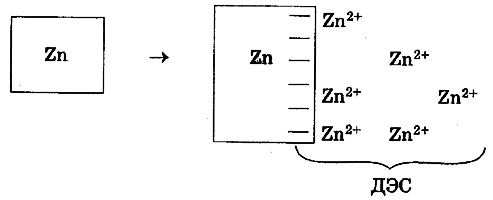
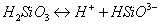
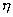 .
.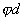 .
.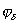 ) происходит также неравномерно - по какой-то криволинейной зависимости.
) происходит также неравномерно - по какой-то криволинейной зависимости.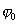 :
: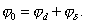
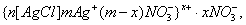
 .
.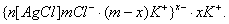
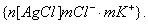
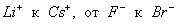 и объясняется возрастанием адсорбционной способности иона с увеличением кристаллического радиуса иона. Адсорбционная способность иона увеличивается также с увеличением его заряда.
и объясняется возрастанием адсорбционной способности иона с увеличением кристаллического радиуса иона. Адсорбционная способность иона увеличивается также с увеличением его заряда.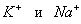 , в результате которого в адсорбционном слое будут находиться как ионы К+, так и ионы Na+.
, в результате которого в адсорбционном слое будут находиться как ионы К+, так и ионы Na+. , то ионы Fe3+ будут конкурировать с ионами калия за нахождение в адсорбционном слое, а так как адсорбционная способность ионов Fe3+ гораздо больше, в результате ионного обмена в адсорбционном слое ионов Fe3+ может оказаться так много, что они не только полностью скомпенсируют заряд потенциалопределяющих ионов, но и окажутся в избытке, придавая адсорбционному слою и дзета-потенциалу положительный заряд. Однако знак останется прежним, так как ионы Fe3+ не способны достраивать кристаллическую решетку твердой частицы и, следовательно, выступать в роли потенциалопределяющих ионов (кривая 3, рис. 8.7).
, то ионы Fe3+ будут конкурировать с ионами калия за нахождение в адсорбционном слое, а так как адсорбционная способность ионов Fe3+ гораздо больше, в результате ионного обмена в адсорбционном слое ионов Fe3+ может оказаться так много, что они не только полностью скомпенсируют заряд потенциалопределяющих ионов, но и окажутся в избытке, придавая адсорбционному слою и дзета-потенциалу положительный заряд. Однако знак останется прежним, так как ионы Fe3+ не способны достраивать кристаллическую решетку твердой частицы и, следовательно, выступать в роли потенциалопределяющих ионов (кривая 3, рис. 8.7).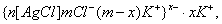
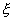 . Этот процесс идет до тех пор, пока все потенциалопределяющие ионы Сl- не свяжутся ионами Ag+ - в этот момент и станут равными нулю. Дальнейшее добавление
. Этот процесс идет до тех пор, пока все потенциалопределяющие ионы Сl- не свяжутся ионами Ag+ - в этот момент и станут равными нулю. Дальнейшее добавление 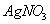 приведет к тому, что ионы Ag+ будут специфически адсорбироваться на нейтральной поверхности твердой частицы, заряжая ее положительно. Таким образом, произойдет перезарядка поверхности - термодинамический потенциал станет положительным, формула мицеллы будет иметь вид:
приведет к тому, что ионы Ag+ будут специфически адсорбироваться на нейтральной поверхности твердой частицы, заряжая ее положительно. Таким образом, произойдет перезарядка поверхности - термодинамический потенциал станет положительным, формула мицеллы будет иметь вид: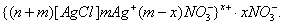
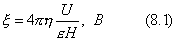
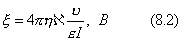
 - удельная электрическая проводимость золя;
- удельная электрическая проводимость золя;  - объемная скорость, т.е. объем жидкости, перенесенной через пористую мембрану за единицу времени; I - сила тока, при которой проводился осмос.
- объемная скорость, т.е. объем жидкости, перенесенной через пористую мембрану за единицу времени; I - сила тока, при которой проводился осмос. , стабилизированного хлоридом бария;
, стабилизированного хлоридом бария;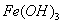 , стабилизированного ;
, стабилизированного ;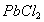 , стабилизированного хлоридом калия;
, стабилизированного хлоридом калия;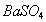 , стабилизированного сульфатом калия.
, стабилизированного сульфатом калия.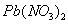 ;
;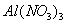 .
.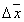 за время t, т.е. отрезок, прямой, соединяющей начальную точку Движения (при t = 0) с положением частицы в момент t в плоскости горизонтальной проекции, наблюдаемой в микроскоп.
за время t, т.е. отрезок, прямой, соединяющей начальную точку Движения (при t = 0) с положением частицы в момент t в плоскости горизонтальной проекции, наблюдаемой в микроскоп.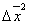 при совершенной беспорядочности движения может быть вычислен на основании статистических законов:
при совершенной беспорядочности движения может быть вычислен на основании статистических законов: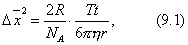
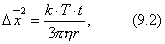
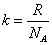 - постоянная Больцмана.
- постоянная Больцмана.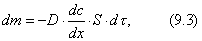
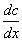 - градиент концентрации; S - площадь, через которую происходит диффузия; - продолжительность диффузии.
- градиент концентрации; S - площадь, через которую происходит диффузия; - продолжительность диффузии.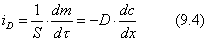
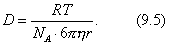
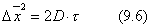
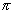 достаточно разбавленных коллоидных растворов может быть найдено по уравнению:
достаточно разбавленных коллоидных растворов может быть найдено по уравнению: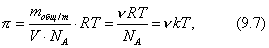
 - масса растворенного вещества; m - масса одной частицы; V - объем системы; - число Авогадро; Т - абсолютная температура; - частичная концентрация; k - постоянная Больцмана.
- масса растворенного вещества; m - масса одной частицы; V - объем системы; - число Авогадро; Т - абсолютная температура; - частичная концентрация; k - постоянная Больцмана.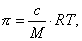
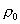 - плотность дисперсионной среды; - вязкость дисперсионной среды; V - объем частицы.
- плотность дисперсионной среды; - вязкость дисперсионной среды; V - объем частицы.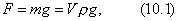
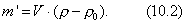
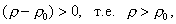 частица будет оседать, если
частица будет оседать, если  - частица будет всплывать. Примем, что
- частица будет всплывать. Примем, что  . Тогда частица дисперсной фазы будет оседать под действием силы тяжести:
. Тогда частица дисперсной фазы будет оседать под действием силы тяжести:
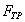 , пропорциональная скорости движения частицы:
, пропорциональная скорости движения частицы: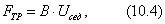
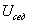 - скорость оседания частицы; В - коэффициент трения.
- скорость оседания частицы; В - коэффициент трения.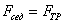 , и частица оседает с постоянной скоростью.
, и частица оседает с постоянной скоростью.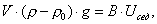 отсюда:
отсюда: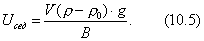
 .
.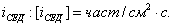
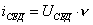
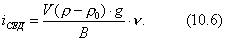
 и обратно пропорционален В.
и обратно пропорционален В.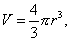 коэффициент трения по уравнению Стокса
коэффициент трения по уравнению Стокса 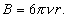 Подставив эти выражения в уравнение (10.6), получим:
Подставив эти выражения в уравнение (10.6), получим: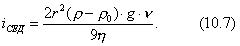
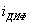 . Согласно уравнению (9.4),
. Согласно уравнению (9.4),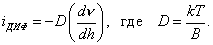
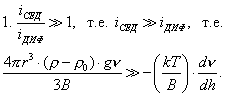
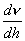 должны быть малы, а
должны быть малы, а 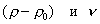 - велики. В реальных условиях эти параметры заметно изменить сложно, а радиус частиц в дисперсных системах изменяется в широком интервале:
- велики. В реальных условиях эти параметры заметно изменить сложно, а радиус частиц в дисперсных системах изменяется в широком интервале: 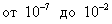 см и именно радиус частиц является определяющим. Установлено, что данное неравенство соблюдается, когда
см и именно радиус частиц является определяющим. Установлено, что данное неравенство соблюдается, когда 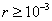 см. В этих случаях диффузией можно пренебречь, идет быстрая седиментация - система является седиментационно неустойчивой.
см. В этих случаях диффузией можно пренебречь, идет быстрая седиментация - система является седиментационно неустойчивой.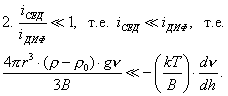
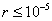 см. В этом случае можно пренебречь седиментацией, диффузия приведет к равномерному распределению частиц по всему объему сосуда. Дисперсная система является седиментационно устойчивой.
см. В этом случае можно пренебречь седиментацией, диффузия приведет к равномерному распределению частиц по всему объему сосуда. Дисперсная система является седиментационно устойчивой.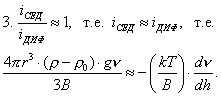
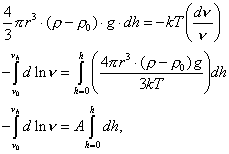
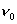 - концентрация частиц на дне сосуда;
- концентрация частиц на дне сосуда; 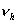 - концентрация частиц на высоте h от дна.
- концентрация частиц на высоте h от дна.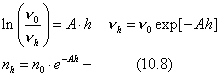
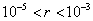 см.
см.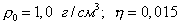 П. В таблице 10.1 приведены данные о седиментации в зависимости от радиуса частиц дисперсной фазы.
П. В таблице 10.1 приведены данные о седиментации в зависимости от радиуса частиц дисперсной фазы.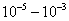 см) - устанавливается седиментационно-диффузионное равновесие, для которого характерно гипсометрическое распределение частиц по объему системы;
см) - устанавливается седиментационно-диффузионное равновесие, для которого характерно гипсометрическое распределение частиц по объему системы; 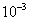 см) - седиментационно неустойчивые системы, происходит быстрая седиментация.
см) - седиментационно неустойчивые системы, происходит быстрая седиментация. 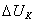 ) или значительно его снижают, и метастабильная система - коллоидный раствор в процессе коагуляции переходит в более устойчивое состояние.
) или значительно его снижают, и метастабильная система - коллоидный раствор в процессе коагуляции переходит в более устойчивое состояние.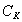 .
.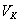 , называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита:
, называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита: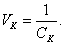
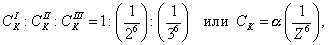
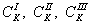 - порог коагуляции однозарядного, двухзарядного, трехзарядного иона-коагулянта.
- порог коагуляции однозарядного, двухзарядного, трехзарядного иона-коагулянта.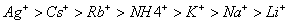
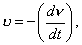
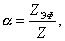
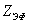 - число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени.
- число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени.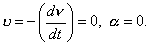 Следовательно, кинетическая энергия
Следовательно, кинетическая энергия 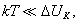 (k - постоянная Больцмана) - лиофобный золь агрегативно устойчив.
(k - постоянная Больцмана) - лиофобный золь агрегативно устойчив.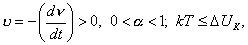 т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита-коагулянта он уменьшается, а скорость коагуляции возрастает.
т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита-коагулянта он уменьшается, а скорость коагуляции возрастает. 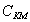 - порог медленной коагуляции,
- порог медленной коагуляции, 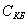 - порог быстрой коагуляций. Этот участок кривой выражает зависимость:
- порог быстрой коагуляций. Этот участок кривой выражает зависимость: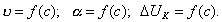
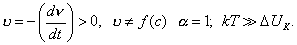
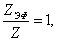 т.е. все столкновения являются эффективными.
т.е. все столкновения являются эффективными.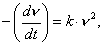
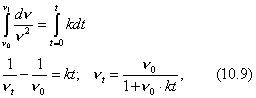
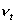 - концентрация частиц золя в момент времени t.
- концентрация частиц золя в момент времени t.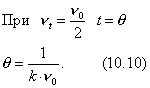
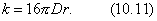
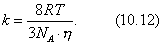
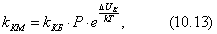
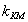 - константа скорости медленной коагуляции;
- константа скорости медленной коагуляции; 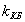 - константа скорости быстрой коагуляции; Р - стерический фактор; - потенциальный барьер коагуляции; k - постоянная Больцмана, равная
- константа скорости быстрой коагуляции; Р - стерический фактор; - потенциальный барьер коагуляции; k - постоянная Больцмана, равная 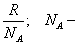 - постоянная Авогадро.
- постоянная Авогадро.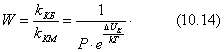
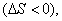 а это, как вы помните из термодинамики, приводит к увеличению свободной энергии системы
а это, как вы помните из термодинамики, приводит к увеличению свободной энергии системы 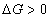 . Поэтому система самопроизвольно стремится оттолкнуть частицы друг от друга и равномерно (хаотично) распределить по объему системы. Этим обусловлен энтропийный фактор устойчивости. Однако мы помним, что число частиц в коллоидном растворе по сравнению с истинным раствором такой же массовой концентрации гораздо меньше, поэтому роль энтропийного фактора невелика. Но если частицы стабилизированы веществами, обладающими длинными гибкими цепями (ВМС) и потому имеющими много конформаций, то при сближении таких частиц их защитные слои вступают во взаимодействие. Это взаимодействие непременно приводит к уменьшению числа возможных конформаций, а значит - к уменьшению энтропии. Поэтому система стремится оттолкнуть частицы друг от друга.
. Поэтому система самопроизвольно стремится оттолкнуть частицы друг от друга и равномерно (хаотично) распределить по объему системы. Этим обусловлен энтропийный фактор устойчивости. Однако мы помним, что число частиц в коллоидном растворе по сравнению с истинным раствором такой же массовой концентрации гораздо меньше, поэтому роль энтропийного фактора невелика. Но если частицы стабилизированы веществами, обладающими длинными гибкими цепями (ВМС) и потому имеющими много конформаций, то при сближении таких частиц их защитные слои вступают во взаимодействие. Это взаимодействие непременно приводит к уменьшению числа возможных конформаций, а значит - к уменьшению энтропии. Поэтому система стремится оттолкнуть частицы друг от друга.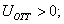
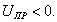
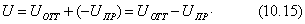
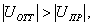 то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.
то преобладают силы отталкивания, коагуляция не происходит, золь является агрегативно устойчивым. В противоположном случае преобладают силы притяжения между частицами, происходит коагуляция.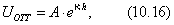
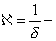 величина, обратная толщине диффузного слоя ; А - величина, не зависящая от А и определяемая параметрами ДЭС.
величина, обратная толщине диффузного слоя ; А - величина, не зависящая от А и определяемая параметрами ДЭС.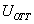 убывает с увеличением расстояния между частицами h по экспоненциальному закону.
убывает с увеличением расстояния между частицами h по экспоненциальному закону.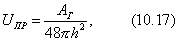
 - константа Гамакера, равная 10-12 эрг. Она рассчитана квантово-статистически и слагается из отдельных констант, характеризующих когезионные и адгезионные взаимодействия.
- константа Гамакера, равная 10-12 эрг. Она рассчитана квантово-статистически и слагается из отдельных констант, характеризующих когезионные и адгезионные взаимодействия. раз. В то же время энергия отталкивания уменьшается в
раз. В то же время энергия отталкивания уменьшается в 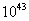 раз.
раз.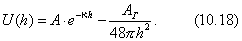
 между частицами преобладают силы притяжения, наблюдается ближний минимум.
между частицами преобладают силы притяжения, наблюдается ближний минимум. 
 - между частицами преобладают силы отталкивания.
- между частицами преобладают силы отталкивания. 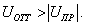
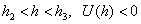 - обнаруживается дальний минимум, однако глубина его невелика.
- обнаруживается дальний минимум, однако глубина его невелика. т.е. при этих расстояниях между частицами силы притяжения уравновешиваются силами отталкивания.
т.е. при этих расстояниях между частицами силы притяжения уравновешиваются силами отталкивания. они неизбежно слипнутся, но для этого должен быть преодолен потенциальный барьер . Это возможно при достаточной кинетической энергии частиц, которая среднестатистически близка к произведению kT.
они неизбежно слипнутся, но для этого должен быть преодолен потенциальный барьер . Это возможно при достаточной кинетической энергии частиц, которая среднестатистически близка к произведению kT.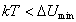 , частицы останутся на расстоянии
, частицы останутся на расстоянии 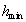 и будут связаны между собой через слой дисперсионной среды, т.е. образуют "пару", но непосредственно не слипаются и не теряют своей седиментационной устойчивости. В таких случаях говорят, что взаимодействие происходит в дальнем минимуме.
и будут связаны между собой через слой дисперсионной среды, т.е. образуют "пару", но непосредственно не слипаются и не теряют своей седиментационной устойчивости. В таких случаях говорят, что взаимодействие происходит в дальнем минимуме.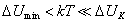 , то частицы при столкновении отлетают друг от друга. Система агрегативно устойчива.
, то частицы при столкновении отлетают друг от друга. Система агрегативно устойчива.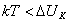 , то происходит медленная коагуляция.
, то происходит медленная коагуляция.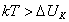 , то происходит быстрая коагуляция.
, то происходит быстрая коагуляция.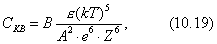
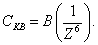
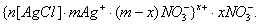
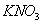 в количестве, вызывающем коагуляцию. При добавлений диффузный слой противоионов сжимается, формула мицеллы приобретает вид:
в количестве, вызывающем коагуляцию. При добавлений диффузный слой противоионов сжимается, формула мицеллы приобретает вид: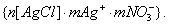
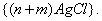
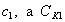 - его порог коагуляции. Аналогично по оси ординат отложена концентрация второго электролита
- его порог коагуляции. Аналогично по оси ординат отложена концентрация второго электролита 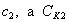 - его порог коагуляции.
- его порог коагуляции.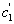 - концентраций первого электролита, то для коагуляции золя концентрация второго электролита должна быть равной
- концентраций первого электролита, то для коагуляции золя концентрация второго электролита должна быть равной 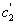 . Аддитивность наблюдается обычно при сходстве коагулирующей способности обоих электролитов.
. Аддитивность наблюдается обычно при сходстве коагулирующей способности обоих электролитов.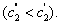 Условия, при которых наблюдается синергизм, сформулировать трудно.
Условия, при которых наблюдается синергизм, сформулировать трудно.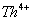 . Однако если взять для коагуляции смесь
. Однако если взять для коагуляции смесь 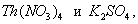 то коагулирующая способность этой смеси значительно меньше, чем отдельно взятого
то коагулирующая способность этой смеси значительно меньше, чем отдельно взятого 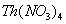 . Связано это с тем, что в результате химической реакции образуется комплекс:
. Связано это с тем, что в результате химической реакции образуется комплекс: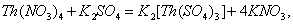
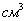 0,0006%-го красного золя золота, чтобы предотвратить его посинение при добавлении к нему 1 10%-го раствора NaCl.
0,0006%-го красного золя золота, чтобы предотвратить его посинение при добавлении к нему 1 10%-го раствора NaCl.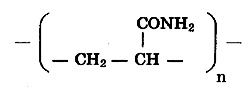
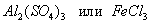 - положительно заряженные золи гидроксосоединений алюминия или железа, образующиеся в результате гидролиза, вызывают быструю коагуляцию взвешенных, отрицательно заряженных частиц почвы, микрофлоры и др.
- положительно заряженные золи гидроксосоединений алюминия или железа, образующиеся в результате гидролиза, вызывают быструю коагуляцию взвешенных, отрицательно заряженных частиц почвы, микрофлоры и др.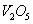 ) можно значительно увеличить, если сосуд медленно вращать. Это явление получило название реопексии (греч. образование геля при движении). Однозначного объяснения этого явления нет, но некоторые ученые считают, что причиной реопексии является возникновение в системе турбулентности, ускоряющей установление контактов между частицами.
) можно значительно увеличить, если сосуд медленно вращать. Это явление получило название реопексии (греч. образование геля при движении). Однозначного объяснения этого явления нет, но некоторые ученые считают, что причиной реопексии является возникновение в системе турбулентности, ускоряющей установление контактов между частицами.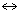 гель, протекающий при механическом воздействии. Тиксотропия характеризуется величиной - тиксотропным периодом.
гель, протекающий при механическом воздействии. Тиксотропия характеризуется величиной - тиксотропным периодом.
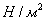 = Па). Скорость деформации является скоростью сдвига. Деформацию выражают обычно посредством безразмерных величин
= Па). Скорость деформации является скоростью сдвига. Деформацию выражают обычно посредством безразмерных величин 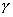 . Скорость деформации
. Скорость деформации 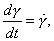 , где t - время.
, где t - время.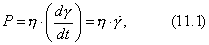
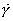 - скорость деформации; - коэффициент пропорциональности, называемый коэффициентом вязкости или динамической вязкостью,
- скорость деформации; - коэффициент пропорциональности, называемый коэффициентом вязкости или динамической вязкостью, 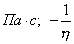 величина, обратная вязкости, называется текучестью.
величина, обратная вязкости, называется текучестью.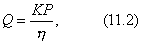
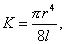 (r и l - радиус и длина трубы). Из графика, отвечающего закону Пуазейля (рис. 11.3 ), видно, что динамическая вязкость не зависит от давления, а скорость течения жидкости прямо пропорциональна давлению.
(r и l - радиус и длина трубы). Из графика, отвечающего закону Пуазейля (рис. 11.3 ), видно, что динамическая вязкость не зависит от давления, а скорость течения жидкости прямо пропорциональна давлению.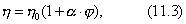
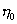 - динамическая вязкость дисперсионной среды;
- динамическая вязкость дисперсионной среды; 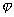 - объемная концентрация дисперсной фазы; - коэффициент, определяемый формой частиц дисперсной фазы. График, отвечающий закону Эйнштейна, дан на рис. 11.4 .
- объемная концентрация дисперсной фазы; - коэффициент, определяемый формой частиц дисперсной фазы. График, отвечающий закону Эйнштейна, дан на рис. 11.4 .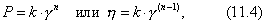
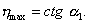 Такое поведение системы объясняется тем, что при малых скоростях течения структура, разрушаемая приложенной нагрузкой, успевает восстанавливаться. Такое течение называется ползучестью.
Такое поведение системы объясняется тем, что при малых скоростях течения структура, разрушаемая приложенной нагрузкой, успевает восстанавливаться. Такое течение называется ползучестью. . При напряжениях Р >, когда структура системы разрушена, система течет подобно ньютоновой жидкости, имеющей вязкость
. При напряжениях Р >, когда структура системы разрушена, система течет подобно ньютоновой жидкости, имеющей вязкость 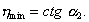
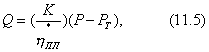
 - пластическая вязкость, она характеризует способность структуры к разрушению при изменении нагрузки, т.е.
- пластическая вязкость, она характеризует способность структуры к разрушению при изменении нагрузки, т.е. 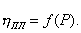
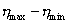 . Чем больше эта разность, тем прочнее структура. Значения и
. Чем больше эта разность, тем прочнее структура. Значения и 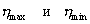 могут различаться на несколько порядков. Так, для суспензии бентонитовой глины
могут различаться на несколько порядков. Так, для суспензии бентонитовой глины 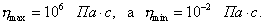
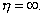 Величина PS характеризует прочность сплошной пространственной сетки.
Величина PS характеризует прочность сплошной пространственной сетки.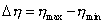 на много порядков больше, чем для жидкообразных и при достижении предела текучести РS наступает лавинообразное разрушение структуры с последующим пластическим течением.
на много порядков больше, чем для жидкообразных и при достижении предела текучести РS наступает лавинообразное разрушение структуры с последующим пластическим течением.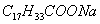 - олеат натрия;
- олеат натрия; 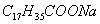 - стеарат натрия;
- стеарат натрия; 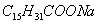 - пальмитат натрия;
- пальмитат натрия;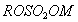 ;
;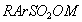 ;
; , заменяющие кислоты растительного и животного происхождения. Используют соли жирных кислот с различными катионами: с двух- и трехзарядными катионами применяют в углеводородных средах, с однозарядными катионами - в водных средах.
, заменяющие кислоты растительного и животного происхождения. Используют соли жирных кислот с различными катионами: с двух- и трехзарядными катионами применяют в углеводородных средах, с однозарядными катионами - в водных средах.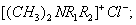 ;
;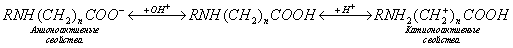
 путем присоединения ее к спиртам, карбоновым кислотам, аминам и др.
путем присоединения ее к спиртам, карбоновым кислотам, аминам и др.
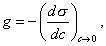 , которая зависит, главным образом, от длины углеводородного радикала; с ее увеличением поверхностная активность возрастает. Как отмечалось в главе 3, правило Дюкло-Траубе гласит: увеличение длины углеводородного радикала на одну группу
, которая зависит, главным образом, от длины углеводородного радикала; с ее увеличением поверхностная активность возрастает. Как отмечалось в главе 3, правило Дюкло-Траубе гласит: увеличение длины углеводородного радикала на одну группу 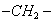 - приводит к возрастанию поверхностной активности в 3-3,5 раза.
- приводит к возрастанию поверхностной активности в 3-3,5 раза. 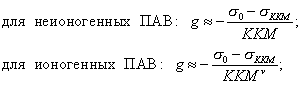
 - поверхностное натяжение раствора ПАВ при критической концентрации мицеллообразования; ККМ - критическая концентрация мицеллообразования ПАВ; - число ионов, образующихся при диссоциации одной молекулы ПАВ.
- поверхностное натяжение раствора ПАВ при критической концентрации мицеллообразования; ККМ - критическая концентрация мицеллообразования ПАВ; - число ионов, образующихся при диссоциации одной молекулы ПАВ.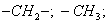 =С=С - 0,475.
=С=С - 0,475. 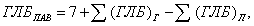
 - сумма чисел ГЛБ всех гидрофильных трут,
- сумма чисел ГЛБ всех гидрофильных трут,  - сумма чисел ГЛБ липофильных (гидрофобных) групп.
- сумма чисел ГЛБ липофильных (гидрофобных) групп.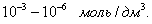 . После достижения этой концентрации в растворе самопроизвольно образуются сферические мицеллы (мицеллы Гартли) и система становится гетерогенной. Состояние коллоидного ПАВ после достижения ККМ можно записать так (без учета гидролиза соли):
. После достижения этой концентрации в растворе самопроизвольно образуются сферические мицеллы (мицеллы Гартли) и система становится гетерогенной. Состояние коллоидного ПАВ после достижения ККМ можно записать так (без учета гидролиза соли):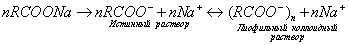

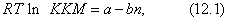
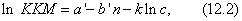
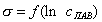 в области низких концентраций ПАВ имеет криволинейный участок, на котором в соответствии с уравнением Гиббса адсорбция ПАВ на поверхности раствора возрастает с ростом концентрации. При определенной концентрации
в области низких концентраций ПАВ имеет криволинейный участок, на котором в соответствии с уравнением Гиббса адсорбция ПАВ на поверхности раствора возрастает с ростом концентрации. При определенной концентрации 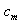 криволинейный участок изотермы переходит в прямую с постоянным значением
криволинейный участок изотермы переходит в прямую с постоянным значением 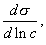 т.е. адсорбция достигает максимального значения. В этой области на межфазной границе формируется насыщенный мономолекулярный слой. При дальнейшем увеличении концентрации ПАВ
т.е. адсорбция достигает максимального значения. В этой области на межфазной границе формируется насыщенный мономолекулярный слой. При дальнейшем увеличении концентрации ПАВ 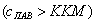 в объеме раствора образуются мицеллы и поверхностное натяжение практически не изменяется. ККМ определяется по излому изотермы при выходе ее на участок, параллельный оси ln с (рис. 12.6 ).
в объеме раствора образуются мицеллы и поверхностное натяжение практически не изменяется. ККМ определяется по излому изотермы при выходе ее на участок, параллельный оси ln с (рис. 12.6 ).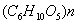 , образующиеся в растениях при фотосинтезе:
, образующиеся в растениях при фотосинтезе: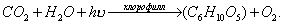
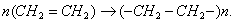
 и др. Примером может служить реакция образования найлона:
и др. Примером может служить реакция образования найлона: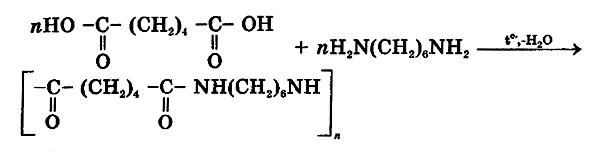
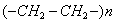 - полиэтилен. Линейные полимеры являются высокоэластичными, хорошо растворяются. Их применение основано на способности образовывать волокна, нити.
- полиэтилен. Линейные полимеры являются высокоэластичными, хорошо растворяются. Их применение основано на способности образовывать волокна, нити.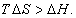
 - масса и объем сухого полимера; масса и объем набухшего полимера.
- масса и объем сухого полимера; масса и объем набухшего полимера.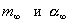 (кривая 1 на рис. 13.1 ) и далее не меняются. При неограниченном набухании (кривая 2 на рис. 13.1) m и а достигают максимальных значений, которые затем уменьшаются за счет растворения полимера. Таким образом, в этом случае набухание является первой стадией растворения.
(кривая 1 на рис. 13.1 ) и далее не меняются. При неограниченном набухании (кривая 2 на рис. 13.1) m и а достигают максимальных значений, которые затем уменьшаются за счет растворения полимера. Таким образом, в этом случае набухание является первой стадией растворения.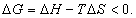
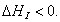 При этом энтропия в меняется или незначительно уменьшается, т.е.
При этом энтропия в меняется или незначительно уменьшается, т.е.  так как объем системы несколько уменьшается).
так как объем системы несколько уменьшается).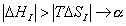 невелика
невелика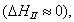 но возрастает энтропия системы
но возрастает энтропия системы 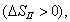 так как разрыхление сетки полимера увеличивает число конформаций:
так как разрыхление сетки полимера увеличивает число конформаций: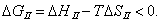
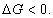 Это связано с тем, что при растворении
Это связано с тем, что при растворении 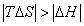 и при любом знаке
и при любом знаке  имеет место уменьшение свободной энергии Гиббса. Увеличение энтропии
имеет место уменьшение свободной энергии Гиббса. Увеличение энтропии  при растворении происходит не только вследствие смешения молекул ВМС с молекулами растворителя, но главным образом за счет того, что в растворенном состоянии молекула ВМС приобретает значительно большее число конформаций, чем в твердом состоянии. Таким образом, растворение ВМС сопровождается самопроизвольным диспергированием вещества.
при растворении происходит не только вследствие смешения молекул ВМС с молекулами растворителя, но главным образом за счет того, что в растворенном состоянии молекула ВМС приобретает значительно большее число конформаций, чем в твердом состоянии. Таким образом, растворение ВМС сопровождается самопроизвольным диспергированием вещества.
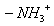 . Такие вещества в природе не встречаются, но могут быть синтезированы;
. Такие вещества в природе не встречаются, но могут быть синтезированы;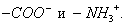
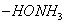 и кислотные группы -СООН:
и кислотные группы -СООН: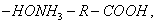
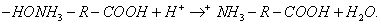
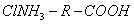 будет понижаться и молекула снова свернется в более плотный клубок.
будет понижаться и молекула снова свернется в более плотный клубок.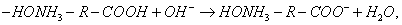
 .
. заряд будет уменьшаться и молекула будет находиться в форме клубка.
заряд будет уменьшаться и молекула будет находиться в форме клубка.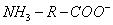 .
.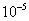 см, а дисперсионной средой - жидкость.
см, а дисперсионной средой - жидкость.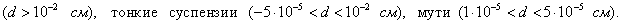
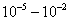 см. Размер образующихся частиц зависит от соотношения скоростей образования зародышей кристаллов и их роста. При небольших степенях пересыщения обычно образуются крупные частицы, при больших - мелкие. Предварительное введение в систему зародышей кристаллизации приводит к образованию практически монодисперсных суспензий. Уменьшение дисперсности может быть достигнуто в результате изотермической перегонки при нагревании, когда мелкие кристаллы растворяются, а за их счет растут крупные.
см. Размер образующихся частиц зависит от соотношения скоростей образования зародышей кристаллов и их роста. При небольших степенях пересыщения обычно образуются крупные частицы, при больших - мелкие. Предварительное введение в систему зародышей кристаллизации приводит к образованию практически монодисперсных суспензий. Уменьшение дисперсности может быть достигнуто в результате изотермической перегонки при нагревании, когда мелкие кристаллы растворяются, а за их счет растут крупные.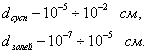
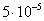 ) может наблюдаться светорассеяние, отклоняющееся от закона Рэлея. (Светорассеяние, по закону Рэлея, наблюдается для сферических, не поглощающих свет, непроводящих частиц, для которых выполняется неравенство:
) может наблюдаться светорассеяние, отклоняющееся от закона Рэлея. (Светорассеяние, по закону Рэлея, наблюдается для сферических, не поглощающих свет, непроводящих частиц, для которых выполняется неравенство: 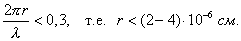 .)
.) - -20,5 мВ, золь сернистого мышьяка - -90 мВ, золь гидроксида железа (III) - +52 мВ.
- -20,5 мВ, золь сернистого мышьяка - -90 мВ, золь гидроксида железа (III) - +52 мВ.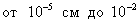 см и более. Поэтому молекулярно-кинетические свойства суспензий различны и определяются степенью их дисперсности.
см и более. Поэтому молекулярно-кинетические свойства суспензий различны и определяются степенью их дисперсности.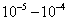 см, наблюдается установление диффузионно-седиментационного равновесия, которое описывается гипсометрическим законом Лапласа-Перрена (см. раздел 3.5.1.):
см, наблюдается установление диффузионно-седиментационного равновесия, которое описывается гипсометрическим законом Лапласа-Перрена (см. раздел 3.5.1.):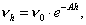
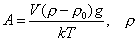 - плотность частицы; - плотность дисперсионной среды; g - ускорение свободного падения; - концентрация частиц у дна сосуда, когда h = 0; - концентрация частиц на высоте h от дна сосуда; V - объем частицы, для сферических частиц радиуса r
- плотность частицы; - плотность дисперсионной среды; g - ускорение свободного падения; - концентрация частиц у дна сосуда, когда h = 0; - концентрация частиц на высоте h от дна сосуда; V - объем частицы, для сферических частиц радиуса r 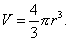
 см, броуновское движение практически отсутствует, в них наблюдается быстрая седиментация, скорость которой () определяется уравнением:
см, броуновское движение практически отсутствует, в них наблюдается быстрая седиментация, скорость которой () определяется уравнением: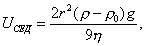
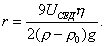
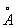 . Таким образом, возникает структурно-механический фактор устойчивости, полностью предотвращающий коагуляцию частиц и возникновение между ними непосредственного контакта. Он играет главную роль в обеспечении агрегативной устойчивости суспензий. Обычно он сопровождается энтропийным фактором устойчивости, вклад которого достаточно велик. Это обусловлено тем, что при сближении частиц, стабилизированных молекулами ВМС, уменьшается число возможных конформаций молекул полимера, а это приводит к уменьшению энтропии системы, поэтому частицы стремятся оттолкнуться друг от друга.
. Таким образом, возникает структурно-механический фактор устойчивости, полностью предотвращающий коагуляцию частиц и возникновение между ними непосредственного контакта. Он играет главную роль в обеспечении агрегативной устойчивости суспензий. Обычно он сопровождается энтропийным фактором устойчивости, вклад которого достаточно велик. Это обусловлено тем, что при сближении частиц, стабилизированных молекулами ВМС, уменьшается число возможных конформаций молекул полимера, а это приводит к уменьшению энтропии системы, поэтому частицы стремятся оттолкнуться друг от друга.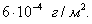 . Аналогичные соотношения установлены и для других ВМС.
. Аналогичные соотношения установлены и для других ВМС.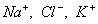 и т.д.) коагулировали и выпали осадок, образовав дельты рек.
и т.д.) коагулировали и выпали осадок, образовав дельты рек.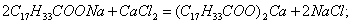
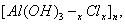 где х меняется от 0 до 3.
где х меняется от 0 до 3.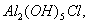 так как он имеет меньшую кислотность, интенсифицирует хлопь8 образование, дает малое остаточное содержание алюминия, его растворы не требуют использования нержавеющих сталей и противокоррозийной защиты аппаратов в оборудования.
так как он имеет меньшую кислотность, интенсифицирует хлопь8 образование, дает малое остаточное содержание алюминия, его растворы не требуют использования нержавеющих сталей и противокоррозийной защиты аппаратов в оборудования.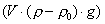 и силой сцепления ее с соседними частицами
и силой сцепления ее с соседними частицами 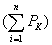 .Чем больше преобладают силы сцепления между соседними частицами над силой тяжести, тем более прочная образуется структура.
.Чем больше преобладают силы сцепления между соседними частицами над силой тяжести, тем более прочная образуется структура.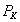 );
);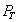 = 0). В области концентраций больших или равных критической концентрации структурообразования (3-я часть) суспензии имеют предел текучести, т.е. в них возникает и развивается структура. Такую систему можно назвать структурированной твердообразной системой (> 0).
= 0). В области концентраций больших или равных критической концентрации структурообразования (3-я часть) суспензии имеют предел текучести, т.е. в них возникает и развивается структура. Такую систему можно назвать структурированной твердообразной системой (> 0).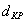 ). Его можно определить из условия соизмеримости сил сцепления между частицами структурной сетке и их весом. Хотя в каждом конкретном случае прочность элементарных контактов между частицами и соответственно прочность возникающих в них структур зависят от физических свойств и химической природы поверхности твердой фазы, состава и свойств дисперсионной среды, наибольший размер частиц, при котором начинает проявляться агрегирование и образование пространственной структуры, составляет
). Его можно определить из условия соизмеримости сил сцепления между частицами структурной сетке и их весом. Хотя в каждом конкретном случае прочность элементарных контактов между частицами и соответственно прочность возникающих в них структур зависят от физических свойств и химической природы поверхности твердой фазы, состава и свойств дисперсионной среды, наибольший размер частиц, при котором начинает проявляться агрегирование и образование пространственной структуры, составляет 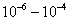 м.
м.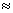 0,1%, желатин 0,5%). Придание же частицам формы, близкой к сферической, способствует достижению высоких значений концентраций при сохранении текучести суспензии (т.е. противодействует структурообразованию).
0,1%, желатин 0,5%). Придание же частицам формы, близкой к сферической, способствует достижению высоких значений концентраций при сохранении текучести суспензии (т.е. противодействует структурообразованию).
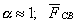 - среднее значение силы сцепления в контакте;
- среднее значение силы сцепления в контакте;  - функция концентрации;
- функция концентрации; 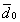 - средний характерный размер частиц.
- средний характерный размер частиц.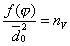 характеризует число контактов между частицами в единице объема; это число обратно пропорционально квадрату радиуса частиц. Сила же сцепления между частицами
характеризует число контактов между частицами в единице объема; это число обратно пропорционально квадрату радиуса частиц. Сила же сцепления между частицами 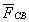 растет пропорционально радиусу частиц. Поэтому в целом растет обратно пропорционально радиусу частиц
растет пропорционально радиусу частиц. Поэтому в целом растет обратно пропорционально радиусу частиц 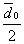 .
.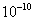 Н и ниже. Причем, прочность контакта могут уменьшать силы отталкивания между частицами, обеспечивающими агрегативную устойчивость суспензии, именно поэтому структуры в агрегативно устойчивых суспензиях не образуются или, если и образуются, то очень непрочные.
Н и ниже. Причем, прочность контакта могут уменьшать силы отталкивания между частицами, обеспечивающими агрегативную устойчивость суспензии, именно поэтому структуры в агрегативно устойчивых суспензиях не образуются или, если и образуются, то очень непрочные.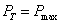 ), с другой стороны - состояние предельного разрушения структуры (уровень вязкости соответствует наименьшему значению вязкости предельно разрушенной структуры
), с другой стороны - состояние предельного разрушения структуры (уровень вязкости соответствует наименьшему значению вязкости предельно разрушенной структуры 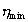 и прочность = 0).
и прочность = 0).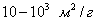 , что примерно соответствует размера частиц от 10 до 1000 нм;
, что примерно соответствует размера частиц от 10 до 1000 нм;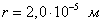 , а самая большая -
, а самая большая - 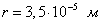 .
.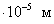 , образуют одну фракцию. Тогда:
, образуют одну фракцию. Тогда: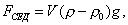
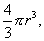 , g - ускорение свободного падения.
, g - ускорение свободного падения.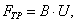
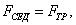 , при котором частицы начинают двигаться с постоянной скоростью. Время, которое для этого требуется, пренебрежимо мало. Так, для частиц кварца радиусом 50 мкм это время составляет
, при котором частицы начинают двигаться с постоянной скоростью. Время, которое для этого требуется, пренебрежимо мало. Так, для частиц кварца радиусом 50 мкм это время составляет  с, а для части радиусом 1 мкм -
с, а для части радиусом 1 мкм - 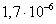 с.
с.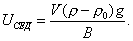
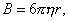 и учитывая, что V = получим
и учитывая, что V = получим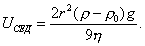
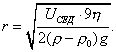
 характеризуют систему и от дисперсности не зависят, можно записать:
характеризуют систему и от дисперсности не зависят, можно записать: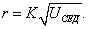
 см, при их соединении достигается высокая скорость, разрывается слой дисперсной фазы, облегающий частицу, вслед за движущейся частицей создаются завихрения, обусловливающие разность давлений, которая тормозит движение частиц. В результате этого ламинарный режим движения нарушается - возникает турбулентность. Если сила тяжести превышает силу трения, движение становится равноускоренным, а следовательно, приведенное выше уравнение становится неприменимым.
см, при их соединении достигается высокая скорость, разрывается слой дисперсной фазы, облегающий частицу, вслед за движущейся частицей создаются завихрения, обусловливающие разность давлений, которая тормозит движение частиц. В результате этого ламинарный режим движения нарушается - возникает турбулентность. Если сила тяжести превышает силу трения, движение становится равноускоренным, а следовательно, приведенное выше уравнение становится неприменимым.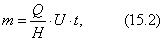
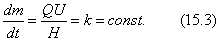
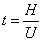 порошок переходит в осадок (m = Q). Так как суспензия монодисперсна (r = const), частицы оседают с одинаковой скоростью. Поэтому граница осветления будет четкой и определить скорость оседания можно по скорости движения этой границы
порошок переходит в осадок (m = Q). Так как суспензия монодисперсна (r = const), частицы оседают с одинаковой скоростью. Поэтому граница осветления будет четкой и определить скорость оседания можно по скорости движения этой границы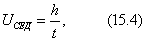
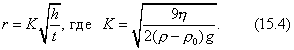
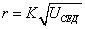 можно рассчитать только эквивалентный радиус частиц сферической формы, оседающих с такой же скоростью, что и реальные частицы.
можно рассчитать только эквивалентный радиус частиц сферической формы, оседающих с такой же скоростью, что и реальные частицы. - масса осадка без чашечки
- масса осадка без чашечки
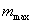 =40 мг.
=40 мг. , %) в соответствующие моменты времени:
, %) в соответствующие моменты времени: 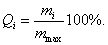 Строим седиментационную кривую = f(t) (рис. 15.5 ).
Строим седиментационную кривую = f(t) (рис. 15.5 ).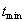 , нужное, чтобы самые крупные частицы прошли расстояние h, этих частиц в суспензии не останется. Поэтому в дальнейшем прирост массы осадка уменьшится - линия станет кривой, выпуклой к оси ординат. Время дает возможность считать радиус самой частицы:
, нужное, чтобы самые крупные частицы прошли расстояние h, этих частиц в суспензии не останется. Поэтому в дальнейшем прирост массы осадка уменьшится - линия станет кривой, выпуклой к оси ординат. Время дает возможность считать радиус самой частицы: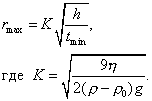
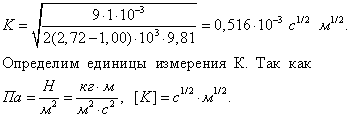
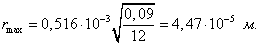
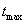 = 18 мин. Такое время потребовалось, чтобы самая маленькая частица, имеющая радиус
= 18 мин. Такое время потребовалось, чтобы самая маленькая частица, имеющая радиус 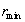 , с поверхности жидкости осела на чашечку весов, т.е. прошла расстояние h.
, с поверхности жидкости осела на чашечку весов, т.е. прошла расстояние h.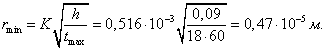
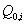 = f(r). Общее количество порошка, осевшего к произвольному моменту времени
= f(r). Общее количество порошка, осевшего к произвольному моменту времени 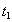 равно
равно 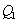 . Проведем касательную к кривой в этой точке. Она отсечет на оси ординат отрезок . Ордината окажется разделенной на две части:
. Проведем касательную к кривой в этой точке. Она отсечет на оси ординат отрезок . Ордината окажется разделенной на две части: 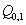 - масса частиц во фракциях, нацело выпавших к моменту
- масса частиц во фракциях, нацело выпавших к моменту 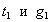 - масса частиц во фракциях, выпавших лишь частично:
- масса частиц во фракциях, выпавших лишь частично: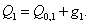
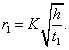
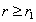 . Аналогично
. Аналогично  - масса порошка, радиусы частиц которого
- масса порошка, радиусы частиц которого 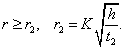
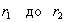 , оно равно
, оно равно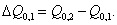
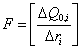 радиуса частиц.
радиуса частиц.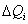 для серий фракций
для серий фракций 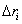 . Полученное значение F относят к среднему для данной фракции радиусу.
. Полученное значение F относят к среднему для данной фракции радиусу.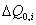 как отрезки, отсекаемые соседними касательными на оси ординат, например,
как отрезки, отсекаемые соседними касательными на оси ординат, например, 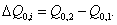 Для нахождения
Для нахождения 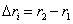 необходимо определить радиусы частиц, осевших к моментам времени
необходимо определить радиусы частиц, осевших к моментам времени  .
.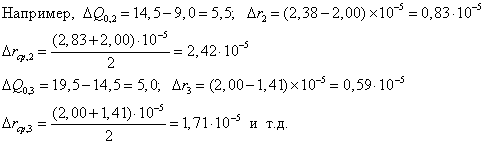
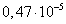 м;
м;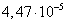 м;
м;
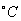 представляет собой суспензию частиц какао и кристалликов сахара в жидком какао-масле. Помадные массы кондитерского производства представляют собой пасты, твердой фазой в которых являются кристаллики сахарозы, а жидкой - водный раствор сахарозы, глюкозы и мальтозы.
представляет собой суспензию частиц какао и кристалликов сахара в жидком какао-масле. Помадные массы кондитерского производства представляют собой пасты, твердой фазой в которых являются кристаллики сахарозы, а жидкой - водный раствор сахарозы, глюкозы и мальтозы.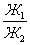 , где в числителе указано агрегатное состояние фазы (жидкость 1), а в знаменателе агрегатное состояние среды (жидкость 2).
, где в числителе указано агрегатное состояние фазы (жидкость 1), а в знаменателе агрегатное состояние среды (жидкость 2).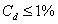 об); концентрированные (
об); концентрированные (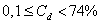 об); высококонцентрированные (желатинированные) (Cd > 74% об).
об); высококонцентрированные (желатинированные) (Cd > 74% об).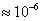 см) частицы и позволяют центрам каплеобразования расти в течение некоторого времени. В результате образуется практически монодисперсный туман, при пропускании которого в дисперсионную среду получают монодиспереную эмульсию.
см) частицы и позволяют центрам каплеобразования расти в течение некоторого времени. В результате образуется практически монодисперсный туман, при пропускании которого в дисперсионную среду получают монодиспереную эмульсию.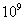 Гц. Для эмульгирования должен применяться ультразвук большой мощности, наиболее эффективной является область частот 20-50 кГц.
Гц. Для эмульгирования должен применяться ультразвук большой мощности, наиболее эффективной является область частот 20-50 кГц.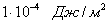 - в этих условиях самопроизвольно образуется эмульсия. Она является термодинамически устойчивой, так как избыток свободной поверхностной энергии, возникающей при образовании капель, компенсируется энтропийным фактором - стремлением вещества к равномерному распределению в объеме системы. Каждая фаза этой эмульсии является насыщенным раствором одной жидкости в другой.
- в этих условиях самопроизвольно образуется эмульсия. Она является термодинамически устойчивой, так как избыток свободной поверхностной энергии, возникающей при образовании капель, компенсируется энтропийным фактором - стремлением вещества к равномерному распределению в объеме системы. Каждая фаза этой эмульсии является насыщенным раствором одной жидкости в другой.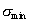 , необходимое для образования любой самопроизвольной эмульсии, включая критические эмульсии, определяется выражением:
, необходимое для образования любой самопроизвольной эмульсии, включая критические эмульсии, определяется выражением: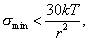
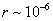 см и Т = 298 К величина должна быть меньше 0,1
см и Т = 298 К величина должна быть меньше 0,1  .
. ) и миристидиновая (
) и миристидиновая (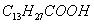 ) кислоты, дающие, согласно правилу Траубе, наибольшее понижение поверхностного натяжения по сравнению с предшествующими членами гомологического ряда.
) кислоты, дающие, согласно правилу Траубе, наибольшее понижение поверхностного натяжения по сравнению с предшествующими членами гомологического ряда.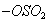 - агар. Полиэлектролиты могут одновременно содержать как кислотную, так и основную группы. Их яркими представителями являются белки, содержащие группы -СООН и
- агар. Полиэлектролиты могут одновременно содержать как кислотную, так и основную группы. Их яркими представителями являются белки, содержащие группы -СООН и 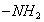 . В этих случаях к отмеченному выше структурно-механическому фактору устойчивости добавляется электростатический фактор.
. В этих случаях к отмеченному выше структурно-механическому фактору устойчивости добавляется электростатический фактор.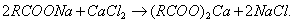
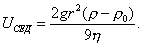
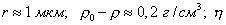 = 0,01 Па и скорость имеет порядок нескольких сантиметров в сутки. Чтобы ускорить процесс, например, для получения масла, обычно применяют центрифугирование, где центробежное ускорение более чем в 100 раз превышает ускорение свободного падения.
= 0,01 Па и скорость имеет порядок нескольких сантиметров в сутки. Чтобы ускорить процесс, например, для получения масла, обычно применяют центрифугирование, где центробежное ускорение более чем в 100 раз превышает ускорение свободного падения.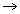 В/M или обратно).
В/M или обратно). - поверхностное натяжение жидкости) одинаково, силы натяжения их в одной плоскости уравновешиваются только при одинаковых углах (120) между пленками (первое правило Плато).
- поверхностное натяжение жидкости) одинаково, силы натяжения их в одной плоскости уравновешиваются только при одинаковых углах (120) между пленками (первое правило Плато).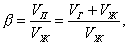
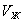 - объем жидкости, которая использована для получения пены. Оба объема легко измерить.
- объем жидкости, которая использована для получения пены. Оба объема легко измерить.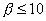 , пены называют жидкими, а если в пределах
, пены называют жидкими, а если в пределах 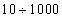 - сухими.
- сухими.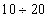 . Для пожаротушения применяют пены с от 70 до 90. Известны также пены с кратностью до 1000.
. Для пожаротушения применяют пены с от 70 до 90. Известны также пены с кратностью до 1000.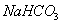 или карбонат аммония
или карбонат аммония 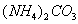
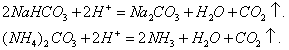
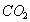 .
.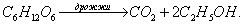
 при малых напряжениях сдвига и от 0,07 до 0,2 при больших напряжениях сдвига.
при малых напряжениях сдвига и от 0,07 до 0,2 при больших напряжениях сдвига. .
.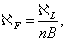
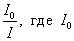 - интенсивность падающего света, I - интенсивность света, прошедшего через пену.
- интенсивность падающего света, I - интенсивность света, прошедшего через пену.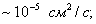 ;
;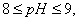 а пенообразование в случае олеата натрия наступает только при рН = 9, но даже при рН = 12 не достигает максимального значения. С увеличением длины гидрофобной цепи в ряду натриевых солей насыщенных жирных кислот максимум пенообразования смещается в щелочную область,
а пенообразование в случае олеата натрия наступает только при рН = 9, но даже при рН = 12 не достигает максимального значения. С увеличением длины гидрофобной цепи в ряду натриевых солей насыщенных жирных кислот максимум пенообразования смещается в щелочную область,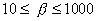 - сухими.
- сухими. земной поверхности выбрасывает в атмосферу 20 т раздробленной массы, которая превращается в атмосферные аэрозоли.
земной поверхности выбрасывает в атмосферу 20 т раздробленной массы, которая превращается в атмосферные аэрозоли. см;
см;  );
);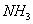 и НСl образуется дым
и НСl образуется дым 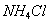 (тв);
(тв);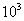 частиц/.
частиц/.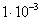 мкм. Чтобы рассматривать газ как непрерывную среду, необходимо, чтобы размеры частиц были гораздо больше, чем свободный пробег молекул газа. Верхний предел размеров частиц строго не определен, но частицы крупнее 100 мкм не способны длительное время оставаться взвешенными в воздухе.
мкм. Чтобы рассматривать газ как непрерывную среду, необходимо, чтобы размеры частиц были гораздо больше, чем свободный пробег молекул газа. Верхний предел размеров частиц строго не определен, но частицы крупнее 100 мкм не способны длительное время оставаться взвешенными в воздухе.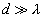 , то взаимодействие можно рассматривать с позиции геометрической оптики, если
, то взаимодействие можно рассматривать с позиции геометрической оптики, если 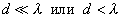 , то необходимо основываться на теории электромагнитных колебаний, т.е. учитывать волновую природу света. Для аэрозолей характерны рассеяние и поглощение света.
, то необходимо основываться на теории электромагнитных колебаний, т.е. учитывать волновую природу света. Для аэрозолей характерны рассеяние и поглощение света.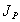 определяется уже известным нам уравнением Рэлея:
определяется уже известным нам уравнением Рэлея: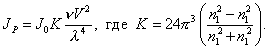
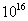 частиц, то в таком же объеме аэрозоля золота менее
частиц, то в таком же объеме аэрозоля золота менее 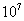 частиц;
частиц;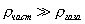 .
.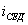 - величины, которые мы рассматривали в связи с седиментационной устойчивостью лиозолей (раздел 3.5.1):
- величины, которые мы рассматривали в связи с седиментационной устойчивостью лиозолей (раздел 3.5.1):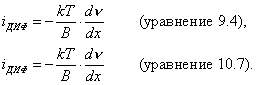
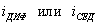 ), рассматривают их соотношение:
), рассматривают их соотношение:
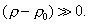 . Следовательно, величина дроби будет определяться размером частиц.
. Следовательно, величина дроби будет определяться размером частиц.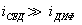 , т.е. диффузией можно пренебречь - идет быстрая седиментация и частицы оседают на дно сосуда.
, т.е. диффузией можно пренебречь - идет быстрая седиментация и частицы оседают на дно сосуда.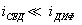 . В этом случае можно пренебречь седиментацией - идет интенсивная диффузия, в результате которой частицы достигают стенок сосуда и прилипают к ним. Если же частицы сталкиваются между собой, то они слипаются, что приводит к их укрупнению и уменьшению концентрации. Это иллюстрируется таблицей 18.2.
. В этом случае можно пренебречь седиментацией - идет интенсивная диффузия, в результате которой частицы достигают стенок сосуда и прилипают к ним. Если же частицы сталкиваются между собой, то они слипаются, что приводит к их укрупнению и уменьшению концентрации. Это иллюстрируется таблицей 18.2.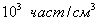 .
.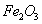 ), а частицы аэрозолей неметаллов и их оксидов (
), а частицы аэрозолей неметаллов и их оксидов (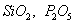 ) заряжены положительно. Положительно заряжены частицы NaCl, крахмала, а частицы муки несут отрицательные заряды.
) заряжены положительно. Положительно заряжены частицы NaCl, крахмала, а частицы муки несут отрицательные заряды.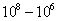 частиц (для сравнения - в лиозолях
частиц (для сравнения - в лиозолях 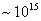 частиц). Таким образом, мы имеем дело с весьма сильно разбавленными системами.
частиц). Таким образом, мы имеем дело с весьма сильно разбавленными системами.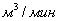 . К недостаткам этого метода следует отнести следующее: он не разрушает сильно разбавленные аэрозоли, оставляя нескоагулированной самую вредную - высокодисперсную часть аэрозоля.
. К недостаткам этого метода следует отнести следующее: он не разрушает сильно разбавленные аэрозоли, оставляя нескоагулированной самую вредную - высокодисперсную часть аэрозоля.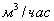 был испытан в рудничных условиях. Он показал эффективность, близкую к 99% при среднем размере частиц 0,2 мкм. При этом габариты фильтра были на порядок меньше, чем у рукавных фильтров и электрофильтров такой же мощности.
был испытан в рудничных условиях. Он показал эффективность, близкую к 99% при среднем размере частиц 0,2 мкм. При этом габариты фильтра были на порядок меньше, чем у рукавных фильтров и электрофильтров такой же мощности.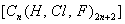 .
. .
. (октафторциклобутан).
(октафторциклобутан).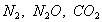 и др.
и др. 1 мкм), либо прилипать к стенкам сосуда или слипаться (при r 0,01 мкм). Наибольшей устойчивостью обладают частицы промежуточных размеров.
1 мкм), либо прилипать к стенкам сосуда или слипаться (при r 0,01 мкм). Наибольшей устойчивостью обладают частицы промежуточных размеров.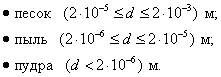
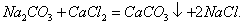
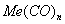 - летучие соединения, которые образуются при обработке металлов оксидом углерода при давлении 200 атм и температуре примерно 200. При нагревании карбонилы испаряются и разлагаются, образуя высокодисперсные металлические порошки.
- летучие соединения, которые образуются при обработке металлов оксидом углерода при давлении 200 атм и температуре примерно 200. При нагревании карбонилы испаряются и разлагаются, образуя высокодисперсные металлические порошки.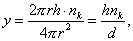
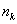 - число контактов, d = 2r.
- число контактов, d = 2r.
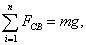
 ) сила связи между частицами становится равной силе тяжести:
) сила связи между частицами становится равной силе тяжести:
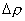 - эффективная плотность частицы в дисперсионной среде
- эффективная плотность частицы в дисперсионной среде 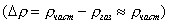 . При расчете реальных значений получается величина ~ 100 мкм. Для увлажненных порошков, в которых существенную роль играют капиллярные силы, значение на порядок больше. Итак, значение служит критерием агрегируемости порошка.
. При расчете реальных значений получается величина ~ 100 мкм. Для увлажненных порошков, в которых существенную роль играют капиллярные силы, значение на порядок больше. Итак, значение служит критерием агрегируемости порошка.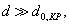 то такие порошки являются свободнодисперсными.
то такие порошки являются свободнодисперсными. . Если r < 50 мкм, критическая скорость возрастает при переходе к более мелким частицам благодаря молекулярным силам, действующим между частицами.
. Если r < 50 мкм, критическая скорость возрастает при переходе к более мелким частицам благодаря молекулярным силам, действующим между частицами. . Для мелких частиц
. Для мелких частиц  уменьшается с увеличением плотности восходящего потока.
уменьшается с увеличением плотности восходящего потока.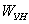 , превышающей в десятки раз. Если скорость сжижающего агента больше скорости витания самых крупных частиц, слой полностью увлекается потоком. Если после достижения полной флуидизации порошка постепенно уменьшать скорость течения, то при полной остановке тока газа слой порошка останется в расширенном состоянии, для возвращения в первоначальное состояние его надо утрясти. Отсюда следует, что в расширенном слое контакт между частицами сохраняется.
, превышающей в десятки раз. Если скорость сжижающего агента больше скорости витания самых крупных частиц, слой полностью увлекается потоком. Если после достижения полной флуидизации порошка постепенно уменьшать скорость течения, то при полной остановке тока газа слой порошка останется в расширенном состоянии, для возвращения в первоначальное состояние его надо утрясти. Отсюда следует, что в расширенном слое контакт между частицами сохраняется.