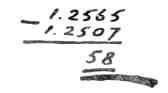|
||||
|
|
М.П. Бронштейн СОЛНЕЧНОЕ ВЕЩЕСТВО Москва ТЕРРА-КНИЖНЫЙ КЛУБ 2002 УДК 53 ББК 22.3г Б88 Разработка оформления серии художника И. Марева Суперобложка художника Р. Аюповой Бронштейн М. П. Б88 Солнечное вещество; Лучи икс; Изобретатели радиотелеграфа. — М.: ТЕРРА—Книжный клуб, 2002. — 224 с: ил. — (Мир вокруг нас). ISBN 5-275-00531-8 УДК 53 ББК 22.3г ISBN 5-275-00531-8 © ТЕРРА—Книжный клуб, 2002 СОЛНЕЧНОЕ ВЕЩЕСТВО С ЧЕГО НАЧАЛОСЬ Я расскажу о веществе, которое люди нашли сначала на Солнце, а потом уже у себя на Земле. Астрономы изучают поверхность Солнца с тех пор, как у них есть телескоп. Они видят на Солнце темные пятна, огненные облака, извержения и взрывы. Но разве можно разглядеть в телескоп химический состав Солнца, исследовать, из каких веществ оно состоит? Для этого химикам пришлось бы побывать на Солнце, захватив с собой свои пробирки, колбы, реактивы и весы. Какая же это экспедиция пролетела полтораста миллионов километров и открыла на Солнце новое вещество? Такой экспедиции никогда не было. Не отрываясь от своей планеты, люди ухитрились узнать, из чего состоит Солнце. Узнали это они не очень давно — всего только лет семьдесят пять тому назад[1].
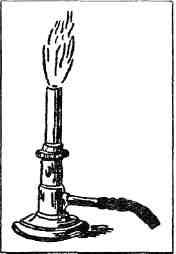
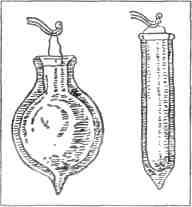
Рис. 1. Горелка Бунзена И, как часто бывает в науке, для этого необычайного открытия понадобились самые скромные средства и орудия. Эти орудия — маленькая, тусклая горелка Бунзена да еще самодельный спектроскоп, сооруженный из сигарной коробки, стеклянного клина и двух половинок распиленной подзорной трубы. Началось все дело с горелки, а потом уже дошла очередь и до спектроскопа. Горелку Бунзена вы и сейчас еще найдете в любой лаборатории. За десятки лет она нисколько не изменилась (рис. 1). Простая металлическая трубка, стоящая на подставке. По резиновому шлангу в трубку течет снизу светильный газ, а чуть пониже середины в ней проделано отверстие для воздуха. Поднесите к верхнему концу трубки зажженную спичку, и газ загорится тусклым, бледным, почти бесцветным пламенем. Днем этого пламени даже не заметишь. Горелка Бунзена горит гораздо тусклее самой плохонькой керосиновой коптилки. Но зато пламя у нее такое жаркое, какого никогда не бывает в нашей обыкновенной печке: две тысячи триста градусов. ЦВЕТНЫЕ СИГНАЛЫ Роберт Бунзен жил в прошлом веке. Много лет был он профессором химии в маленьком немецком городке Гейдельберге. К середине 50-х годов он уже изобрел свою горелку и теперь изо дня в день старательно изучал, как ведут себя различные вещества в пламени высокой температуры. Он погружал в пламя то металлы, то уголь, то соли, то известь и наблюдал, что происходит со всевозможными химическими соединениями в горячем пламени светильного газа. Осенью 1858 года он заметил и записал в лабораторном дневнике, что многие вещества ярко окрашивают бесцветное пламя. Впервые он обратил на это внимание во время опыта с поваренной солью. Тонкими платиновыми щипчиками взял он маленький кристаллик соли и сунул в пламя горелки. Бесцветное пламя сразу перестало быть бесцветным. Как только попала в него поваренная соль, оно разгорелось ярче и пожелтело. А комнату наполнил удушливый запах хлора.
Роберт Бунзен Этому запаху Бунзен не удивился. Ведь поваренная соль состоит из двух веществ: хлора и натрия. Вот она и распалась на свои составные части в жарком пламени горелки, и хлор растекся по комнате. Но почему же пламя из бесцветного сделалось желтым? Что окрасило его в желтый цвет — газ хлор или металл натрий? Чтобы узнать это, Бунзен решил повторить опыт, но только вместо поваренной соли взять вещества, в которых будет натрий, а хлора не будет, — например, соду, глауберову соль, бромистый натрий. Если пламя и при этих опытах окрасится в желтый цвет — значит, все дело в натрии. Так и оказалось: и от соды, и от глауберовой соли пламя сразу пожелтело. Тогда Бунзен проделал последний, решительный опыт: внес в пламя чистый натрий безо всяких примесей. Пламя и на этот раз стало ярко-желтым. Значит, догадка верна: натрий действительно окрашивает бесцветное пламя газовой горелки в желтый цвет. Удача этих опытов навела Бунзена на мысль: быть может, не только натрий, но и другие металлы способны окрасить бесцветное пламя горелки? Что если взять вещества, в которых натрия нет? Например, сильвин — соединение хлора с металлом калием? Крохотный кристаллик сильвина был внесен в пламя газовой горелки. Пламя разгорелось так же ярко, как и от кристаллика поваренной соли, но окрасилось в другой цвет — не желтый, а фиолетовый. И не один сильвин, а все вещества, в которых есть калий, дали тот же фиолетовый цвет: и селитра, и поташ, и едкое кали. Вывод ясен: фиолетовый цвет пламени зависит от калия. Но Бунзен и тут не отказался от последней проверки: он внес в пламя чистый калий. Все тот же фиолетовый цвет. Значит, желтый цвет — признак натрия, а фиолетовый — калия. Бунзен почувствовал, что опыты ведут его к какому-то важному открытию. Он стал испытывать металлы один за другим. Взял литий — и получил красное пламя, взял медь — и получил зеленое. Опыты за опытами убеждали Бунзена в том, что он открыл новый способ химического анализа — такого анализа, для которого не нужна сложная химическая кухня, не нужны приборы, склянки, реактивы. Теперь, когда химик захочет узнать, есть ли в каком-нибудь веществе калий, ему скажет об этом пламя газовой горелки, скажет не словами, а цветными сигналами. Если пламя сделается фиолетовым, это значит: в веществе есть калий. А если оно сделается не фиолетовым, а желтым, это будет означать: калия нет, есть натрий. Можно будет на глаз узнавать химический состав любого вещества. Надо только изучить язык газового пламени, разобраться в его цветных сигналах. НЕУДАЧА Бунзен раздобыл множество разных химических соединений и принялся их исследовать. Тоненькими платиновыми щипчиками захватывал он кусочек исследуемого вещества и вносил в пламя горелки. Если же вещество было не твердым, а жидким, то вместо щипчиков брал он платиновую проволочку толщиною с конский волос, изогнутую на конце в виде петельки (рис. 2). Каплю жидкости, повисшую на петельке, Бунзен осторожно вносил в пламя. И каждый раз в лабораторном дневнике появлялась запись о том, каким цветом окрасилось пламя.
Рис. 2. Тонкая платиновая проволочка с петелькой на конце Скоро в руках у Бунзена был длинный перечень веществ и тех цветов, по которым их можно определить. Настоящая сигнальная книга: натрий — желтый сигнал, калий — фиолетовый сигнал, медь — зеленый сигнал, стронций — красный сигнал. И так далее и так далее — на много страниц. Сигнальная книга была готова, и вот тут-то Бунзен увидел, что пользоваться этими сигналами не так-то просто. В перечне была, например, такая запись: «Раствор солей натрия — желтый цвет. Раствор солей натрия с небольшой примесью солей лития — тоже желтый цвет. Раствор солей натрия с небольшой примесью солей калия — тоже желтый цвет». Как же расшифровать эти сигналы? Как отличить чистый натрий от натрия с примесью калия и от натрия с примесью лития? Бунзен зажег три газовые горелки. В пламя каждой горелки внес он по капле раствора поваренной соли. Но в одной капле поваренная соль была чистая (соединение натрия с хлором), в другой она была смешана с солями лития, в третьей — с солями калия. Все три пламени были одного цвета: желтого. Никакой разницы между ними не было. Очевидно, натрий так сильно окрасил их в свой желтый цвет, что глазу не удалось уловить красный оттенок лития и фиолетовый оттенок калия. Тогда Бунзен подумал: «А что если помочь глазу — вооружить его цветными стеклами или цветными жидкостями?» Он налил в стаканчик немного раствора синей краски индиго и стал рассматривать все три пламени сквозь синюю жидкость. И тут он сразу заметил различие в цвете. Синяя краска индиго поглотила желтые лучи натрия, и поэтому пламя, где была поваренная соль с примесью лития, казалось теперь малиново-красным. Пламя, куда был подмешан калий, тоже казалось красным, но другого оттенка — пурпурного. А пламя, в котором была поваренная соль без всякий примесей, как будто и вовсе исчезло. Бунзен вооружился целой коллекцией цветных стекол и стаканчиков с цветными жидкостями. Он надеялся, что эта коллекция поможет ему расшифровать все сигналы в его книге. Но вот ему попалась на глаза такая запись: «Соли лития — малиново-красный цвет. Соли стронция — малиново-красный цвет». Опять два разных вещества, а цвет один и тот же. Не помогут ли и тут цветные жидкости и стеклышки? Долго бился Бунзен, подбирая цвета, сквозь которые можно было бы подметить разницу между пламенем лития и пламенем стронция. Но такого цветного стекла, такой цветной жидкости он не нашел. Пламя лития никак не удавалось отличить от пламени стронция. Значит, краски и цветные стекла помогают не всегда. А если так, — пламя газовой горелки не дает надежного ключа к химическому анализу. Казалось, Бунзен потерпел поражение. Но тут на помощь его газовой горелке пришел спектроскоп Кирхгофа. ПРОСТОЙ КУСОК СТЕКЛА В том же университетском городке Гейдельберге жил профессор физики Густав Кирхгоф. Узнав о затруднениях Бунзена, Кирхгоф решил ему помочь. Он обещал Бунзену построить такой физический прибор, который откроет разницу в цвете пламени даже и тогда, когда отказываются служить цветные стекла и растворы красок. План у Кирхгофа был очень простой В его лаборатории хранилась призма из стекла «флинтглас», которую когда-то, за много лет перед тем, выточил и отшлифовал знаменитый мюнхенский оптический мастер Йозеф Фраунгофер. Призма — это простой кусок стекла, выточенный в форме клина. Но у призмы есть замечательное свойство: лучи света никогда не проходят сквозь нее прямо, а неизменно отклоняются в сторону, — как будто что-то отталкивает их прочь от ребра призмы. И при этом не все лучи отклоняются одинаково: фиолетовые отклоняются сильнее всех других, красные меньше всех других, а лучи остальных цветов попадают в промежуток между красными и фиолетовыми.
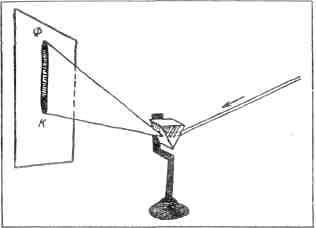
Густав Кирхгоф Поэтому если через призму пропустить пучок света, в котором смешаны лучи различных цветов, то, выйдя из призмы, эти лучи пойдут по разным дорогам. Так призма разлагает пучок света, состоящий из лучей разных цветов, разбивает его на составные части. Йозеф Фраунгофер, который изготовил флинт-гласовую призму, хранившуюся в лаборатории Кирхгофа, пользовался этим замечательным свойством призмы для того, чтобы разлагать на составные цвета солнечный луч. Через узкую щель впускал он в темную комнату пучок солнечных лучей и на пути этих лучей ставил свою призму (рис. 3). Лучи входили в призму узким пучком, а выходили широким веером. На противоположную белую стену ложилась разноцветная полоса света — солнечный спектр.
Рис. 3. Путь лучей через призму. На экране — полоска спектра: буквой Ф обозначен фиолетовый край спектра, буквой К — красный В полосе были все семь цветов радуги: красный, за ним оранжевый, потом желтый, зеленый, голубой, синий и фиолетовый. Фраунгофер, как и многие физики до него, знал, что все эти цвета, от красного до фиолетового, все тончайшие оттенки цветов радуги, постепенно переходящие друг в друга, содержатся в белом солнечном свете, но эти отдельные цвета и оттенки заметны глазу только тогда, когда призма разлучает их между собой, разлагает в разноцветный спектр. «Почему же, — подумал Кирхгоф, — не воспользоваться этой же самой стеклянной призмой для того, чтобы исследовать свет, испускаемый газовой горелкой? Если выделить узкий пучок такого света и пропустить его через призму — призма сразу разгадает те сигналы, которых не разгадали ни цветные стекла, ни стаканчики с красками». СИГНАЛЫ РАСШИФРОВАНЫ Кирхгоф принес Бунзену свой прибор. Этому прибору изобретатель дал название «спектроскоп» — слово, которое он сам придумал. Теперь это слово известно всякому физику и химику, и в любой лаборатории можно увидеть спектроскоп, изготовленный на оптической фабрике. Но как не похожи эти современные удобные и точные спектральные приборы на неуклюжий спектроскоп, который Кирхгоф изготовил собственными руками! Деревянная коробка из-под сигар, стеклянная призма и старая подзорная труба с тремя выпуклыми стеклами — вот из чего был сделан первый спектроскоп (рис. 4). Подзорную трубу Кирхгоф распилил пополам. Из одной трубы получилось две: первая с одним выпуклым стеклом, вторая — с двумя. Обе трубки Кирхгоф вставил в смежные стенки сигарной коробки под углом одна к другой. Трубку, в которой было только одно стекло, он расположил так, чтобы она глядела стеклом в коробку, а пустым отверстием наружу. Это отверстие он прикрыл картонным кружком с узкой щелью. Через щель должны были проникать в коробку лучи. Там, внутри коробки, их встречала призма, которую Кирхгоф укрепил на вращающейся оси. Пройдя сквозь призму, пучок лучей сворачивал в сторону и устремлялся в другую трубку широким разноцветным веером. Приложив глаз к этой трубке и медленно поворачивая призму вокруг оси, можно было рассмотреть весь спектр лучей, попавших в щель спектроскопа. В первый же день Бунзен и Кирхгоф испытали новый прибор. Бунзен зажег свою горелку, а Кирхгоф навел на пламя свой спектроскоп. Затем Бунзен стал вводить в пламя по очереди натрий, калий, медь, литий, стронций. И каждый раз, когда пламя меняло свой цвет, оба они внимательно рассматривали спектр лучей, испускаемых раскаленными парами металлов. Спектры эти оказались не такими, как солнечный. В солнечном спектре все семь цветов радуги — от красного до фиолетового — ложатся сплошным рядом, а в спектре окрашенного газового пламени Кирхгоф и Бунзен увидели разрозненные цветные линии[2]. В спектре раскаленных паров калия горели две красные линии и одна фиолетовая, у паров натрия была одна линия — желтая[3], у паров меди было много линий, среди которых ярче всех горели три зеленые, две желтые и две оранжевые. И каждая цветная линия появлялась всякий раз на том самом месте, где в солнечном спектре лежит цвет точно такого же оттенка: оранжевые линии меди ложились в оранжевой части спектра, желтая линия натрия — в желтой. Наконец-то Бунзену удалось узнать, чем отличается малиновое пламя лития от малинового пламени стронция. Когда он смотрел на них простым глазом, он не различал их, но спектр одного пламени оказался совсем непохожим на спектр другого. Достаточно было посмотреть на них в спектроскоп Кирхгофа, чтобы сразу сказать, где литий, где стронций. Спектр лития состоит из одной яркой красной линии и одной оранжевой послабее, а спектр стронция — из одной голубой и нескольких красных, оранжевых, желтых линий. Один за другим цветные сигналы были расшифрованы. Задача была решена. ПЕПЕЛ, ГРАНИТ И МОЛОКО Кирхгоф и Бунзен нашли ключ к разгадке химического состава любого пламени, любого светящегося газа. Не нужно химического анализа, чтобы узнать, есть ли в пламени натрий. Если вы увидите его желтую линию в том месте спектра, где ей полагается быть, вы сразу обнаружите натрий. Если в спектре у вас две красные и одна фиолетовая линии, вы мо- жете быть уверены, что в пламени есть калий. А если в спектре окажется красная линия, зелено-голубая и синяя, то, значит, в пламени есть водород. Поставьте на пути лучей спектроскоп — и линии спектра безошибочно расскажут вам о химическом составе тела, испускающего лучи. Такой способ угадывать химический состав по линиям спектра был назван спектральным анализом. Бунзен стал исследовать множество разных веществ. Все, что попадалось ему под руку, он тащил к спектроскопу. Он вносил в пламя горелки и каплю морской воды, и каплю молока, и пепел сигары, и кусочки всевозможных минералов. В спектре пепла гаванской сигары он увидел желтую линию натрия и красные линии лития и калия; в спектре кусочка мела он увидел линии натрия, лития, калия, кальция, стронция. Множество разных веществ исследовал таким образом Бунзен, раскаляя их в жарком пламени горелки и наблюдая спектр раскаленных паров. Новый способ распознавать химический состав оказался необычайно чувствительным и точным. Бунзен находил спектральные линии редкого металла лития в тех веществах, в которых лития так мало, что никаким другим способом его обнаружить невозможно. Литий был найден спектроскопом и в морской воде, и в золе водорослей, прибитых Гольфстримом к берегам Шотландии, и в ключевой воде, которую Бунзен взял из источника, бьющего из гранитной скалы в окрестностях Гейдельберга, и в кусках гранита, отколотого от той же скалы, и в листьях винограда, выросшего на скале, и в молоке коровы, которая ела эти листья, и в крови людей, которые пили это молоко. Но газовая горелка и спектроскоп помогли химику Бунзену сделать еще более важное открытие: с их помощью он обнаружил два новых металла, о существовании которых никто и не подозревал. В спектре саксонского минерала лепидолита и в спектре рассола, полученного при выпаривании дюркхеймской минеральной воды, он увидел спектральные линии, которые не совпадали с линиями знакомых химикам веществ. Бунзен понял, что и в лепидолите, и в дюркхеймской минеральной воде скрыты какие-то еще неизвестные вещества. И в самом деле, вскоре Бунзену удалось извлечь из минерала лепидолита новый металл, который он назвал рубидием, а из дюркхеймской воды другой новый металл, которому он дал имя цезий[4]. Открытие рубидия и цезия было первой большой победой спектрального анализа. ЗВЕЗДЫ В ЛАБОРАТОРИИ Шел год за годом. Физики и химики изучали все новые и новые спектры: спектры раскаленных паров разных солей, спектры раскаленных и расплавленных металлов, спектры разреженных газов, которые светятся, когда по ним проходит электрический ток, спектр электрической искры, спектр лучей, испускаемых раскаленной известью и прошедших сквозь окрашенные стекла, сквозь цветные жидкости, газы и пары.
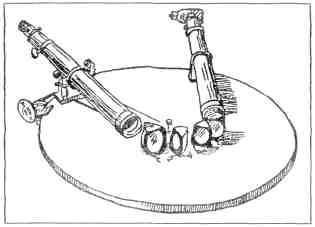
Рис. 4. Усовершенствованный спектроскоп с четырьмя призмами. Переходя из призмы в призму, веер лучей разворачивается все шире и шире Спектроскоп, когда-то построенный Кирхгофом из сигарной коробки, стеклянного клина и двух половинок подзорной трубы, стал родоначальником многих других спектроскопов, более удобных для работы и более точных (рис. 4). Сам Кирхгоф много потрудился над тем, чтобы усовершенствовать свое изобретение. Вскоре спектроскопы стали изготовляться на оптических фабриках. В каждой лаборатории появился спектроскоп. Немецкие оптические фирмы сконструировали дорогие и сложно устроенные спектральные приборы для точных измерений. Лондонская фирма «Браунинг» выпустила в продажу дешевые карманные спектроскопы. Спектроскоп пригодился и физикам, и химикам, и инженерам. Пригодился он даже сыщикам. Увидев на полу или на одежде подозрительное темное пятно, похожее на засохшую кровь, сыщик смывает пятно спиртом. А по спектру лучей, прошедших через спирт, в лаборатории могут сразу сказать, растворена ли в нем кровь[5]. Но гораздо больше, чем сыщикам, пригодился спектроскоп людям, которые изучают самые далекие светящиеся тела — планеты и звезды. До изобретения спектроскопа никто и мечтать не смел о том, что когда-нибудь нам станет известно, из чего состоят звезды, планеты и Солнце. Никто не знал, входят ли в состав небесных светил те же самые вещества, которые мы встречаем и у себя на Земле, или же небесные светила состоят из каких-то особенных, небесных веществ. Только открытие Кирхгофа и Бунзена помогло людям затащить звезды в лабораторию, создать новую науку — небесную химию, химию небесных светил. Астрономы всего мира с жадностью ухватились за спектральный анализ и стали применять его в самых разнообразных исследованиях. Здесь не хватит места рассказать обо всех тех удивительных вещах, которые были открыты с помощью спектрального анализа. Только об одном открытии я расскажу здесь — о том открытии, с которого начинается необычайная история вещества, найденного на Солнце. СПЕКТРОСКОП ИССЛЕДУЕТ СОЛНЦЕ Во время полного солнечного затмения, когда все Солнце закрыто от нас Луной, из-за черного диска Луны внезапно вырываются красные язычки пламени. Язычки кажутся нам маленькими, а на самом деле они во много раз длиннее диаметра нашей Земли. Это извержения и взрывы на огненной поверхности Солнца. Такие взрывы бывают на Солнце каждый день и по многу раз в день. Но простым глазом их можно наблюдать только во время полного солнечного затмения, когда лучезарный диск закрыт Луной и потому не ослепляет нас. Странно, что ученые обратили внимание на эти огненные взрывы, выступающие из-за края Луны, всего только несколько десятков лет тому назад, хотя полные затмения Солнца бывают чуть ли не каждый год — то в одной, то в другой части земного шара, и каждый раз можно заметить солнечные выступы.
Жюль Жансен Астрономы попросту их проглядели. Затмение длится всего несколько минут, а то и секунд, и за эти секунды надо столько записать, зарисовать, измерить! Все внимание астронома-наблюдателя поглощено лихорадочной работой, и часто волнение мешает ему видеть вещи, которые он не рассчитывал увидеть. А может быть, астрономы и замечали эти взрывы, но считали их просто обманом зрения. Как бы то ни было, 18 июля 1860 года, когда полное солнечное затмение наблюдалось в Испании, астрономы, съехавшиеся туда со всех концов Европы, наконец-то обратили внимание на солнечные выступы и даже успели их зарисовать. Тогда только ученые всего мира заговорили о солнечных выступах — протуберанцах — и стали наперебой высказывать различные догадки об их природе и происхождении. Через восемь лет после испанского затмения, 18 августа 1868 года, ожидали полного солнечного затмения в Индии. Французский астроном Жансен, который всю свою жизнь занимался исследованием Солнца, решил воспользоваться этим затмением, чтобы изучить спектр солнечных выступов. Взяв с собой спектроскоп, он отправился в далекое морское путешествие. Он поспел вовремя. В тот момент, когда затмение наступило и красные языки вырвались из-за черного лунного диска, Жансен навел на них трубу своего спектроскопа. Он увидел цветные линии — спектр тех раскаленных газов и паров, которые извергает Солнце. Линии были такие яркие, что у Жансена невольно возникла мысль: а нельзя ли увидеть их и без затмения, при полном блеске Солнца? На другой день, когда солнце как ни в чем не бывало выкатилось из-за горизонта и поднялось над пальмами и пагодами, Жансен навел щель спектроскопа на самый край Солнца. Он сделал это так осторожно и так искусно, что в щель спектроскопа попадали только лучи солнечных выступов, а лучи самого солнечного диска проходили мимо.
Норман Локьер Глядя в спектроскоп, Жансен убедился, что его вчерашняя догадка правильна. В спектроскопе были те самые цветные линии, которые он видел накануне, — линии спектра солнечных выступов. А если так — Жансен мог решить свою задачу и без затмения. К чему же было ездить в Индию? И правда, не к чему: английский астроном Локьер, сидя у себя в Англии и ничего не зная о Жансене, сделал то же открытие, что и он. Парижская академия получила в один день два письма: одно от Жансена, другое от Локьера, и в обоих письмах говорилось об одном и том же открытии. Письмо Локьера было написано 20 октября 1868 года, а письмо Жансена раньше — 19 августа того же года. Но из городка Гунтур на восточном берегу Индии, где находился Жансен, письмо шло в Европу больше двух месяцев. Вот почему оба письма пришли в Париж в один и тот же день и были зачитаны в заседании Парижской академии 26 октября 1868 года одно через несколько минут после другого. Это странное совпадение так поразило академиков, что они решили выбить золотую медаль в честь открытия спектра солнечных выступов. На одной стороне медали были портреты Жансена и Локьера, а на другой бог Солнца Аполлон в колеснице, запряженной четверкой коней, и под колесницей надпись: ANALYSE DES PROTUBERANCES SOLAIRES 18 AOUT 1868 (анализ солнечных выступов 18 августа 1868 года). СОЛНЕЧНОЕ ВЕЩЕСТВО Что же обнаружили Жансен и Локьер в спектре солнечных выступов? Прежде всего им обоим бросились в глаза яркие линии водорода: красная, зелено-голубая и синяя. Но, кроме этих трех линий, в спектре оказалась еще одна линия — желтая. Что значит эта линия, ни Жансен, ни Локьер никак не могли понять. Она расположена довольно близ- ко от того места спектра, где должна была бы лежать желтая линия натрия. Близко, но не совсем в том месте, — значит, это не натрий[6]. Откуда же эта линия? Ни одно из веществ, известных химикам того времени, не имело ее в своем спектре. Жансен и Локьер долго размышляли и наконец пришли к выводу, что неизвестная линия, которую они назвали линией D3, принадлежит какому-то особому небесному веществу. Очевидно, на Земле его нет, оно существует только на Солнце, за полтораста миллионов километров от нас. И поэтому Локьер решил назвать новое, найденное на Солнце вещество именем самого Солнца — «гелий». «Гелиос» — по-гречески это и значит Солнце. Вещество было названо, но о свойствах его пока еще не было известно ровно ничего. Астрономы высказывали только догадку, что гелий, вероятно, очень легкий газ. Ведь когда на солнечной поверхности происходят извержения, то восходящий поток газов захватывает и уносит на огромную высоту только самые легкие вещества. ВЕС БЛОХИ История гелия началась на небе, а через двадцать пять лет неожиданно спустилась на землю. В 1893 году английский физик Джон Уильям Рэлей предпринял точное измерение веса различных газов. В первую очередь стал он взвешивать те газы, с которыми наука раньше всего и больше всего имела дело: водород, кислород и азот. Для чего понадобилась эта работа? Разве водород, кислород и азот не были взвешены и до Рэлея? Да, вес этих газов был давно известен, но Рэлей захотел взвесить их точнее, чем взвешивали их прежде. В конце прошлого века физики уже не довольствовались грубыми приборами старинных лабораторий. Им потребовались точные цифры, точные знания о свойствах вещей. Новыми, более тонкими и чуткими приборами физики стали заново измерять плотности тел, температуры плавления и кипения, оптические, химические и электрические свойства. Джон Уильям Рэлей вооружился самыми точными весами, какие только были у него в лаборатории, и принялся за работу. Прежде всего он решил заново взвесить водород. Он взял большой стеклянный шар и тщательно измерил, сколько литров газа может в нем поместиться. Потом воздушным насосом выкачал из шара воздух и взвесил шар. Потом наполнил водородом и снова взвесил. Точные весы показали, что шар, наполненный водородом, на столько-то граммов и столько-то миллиграммов тяжелее, чем пустой. Оставалось только разделить граммы на литры. Так Рэлей измерил точный вес литра водорода. Покончив с водородом, он точно так же взвесил и кислород[7]. Потом дошла очередь и до азота. Рэлей взял несколько литров воздуха и очистил его от кислорода. Остался азот, и этим азотом Рэлей наполнил свой стеклянный шар. Взвесив шар на точных весах, он узнал, сколько весит литр азота. Но это было еще не все. Осторожный физик привык проверять каждый свой опыт различными способами. Рэлей снова добыл азот, на этот раз не из воздуха, а из другого газа — аммиака. Снова наполнил он азотом стеклянный шар, снова взвесил на точных весах. И тут обнаружилась странная вещь: литр азота, добытый из аммиака, оказался на 6 миллиграммов легче, чем литр азота, добытый из воздуха. На целых шесть миллиграммов! Шесть миллиграммов — вес небольшой. Это вес блохи.
Джон Уильям Рэлей Но один литр азота не должен быть легче другого литра азота даже и на сотую часть блошиного веса! Рэлей снова взвесил азот воздуха и азот аммиака, и его точные весы снова показали ту же разницу — шесть миллиграммов. Литр «воздушного» азота весил 1,2565 грамма.
Литр «аммиачного» азота — 1,2507 грамма. «Что за странность? — подумал Рэлей. — И то и другое — азот, но у «воздушного» азота один вес, у «аммиачного» — другой? А что, если для сравнения добыть азот не из воздуха и не из аммиака, а из какого-нибудь другого вещества?» Рэлей собрал целую коллекцию веществ, содержащих азот: окись азота, закись азота, азотистокислый аммоний, селитру, мочевину. Из всех этих веществ он извлекал азот и взвешивал на точных весах. И что же? Оказалось, что у азота, добытого из закиси, и у азота, добытого из окиси, и у азота из азотистокислого аммония, и у азота из селитры вес совершенно одинаковый: 1,2507 грамма на литр — точь-в-точь такой, как у азота, добытого из аммиака. Так почему же у азота, добытого из воздуха, вес больше? Почему «воздушный» азот — исключение? Уж не было ли какой ошибки в опыте с «воздушным» азотом? Рэлей решил взвесить «воздушный» азот еще раз. Он снова взял несколько литров воздуха и тщательно очистил их от кислорода. Оставшимся азотом он наполнил стеклянный шар и взвесил — теперь уже в третий раз. Упрямые весы продолжали показывать одно и то же. Литр «воздушного» азота весил не 1,2507, а 1,2565 грамма. Разница ничтожная. Начинается она всего только с тысячных долей, с третьей цифры после запятой. Но один литр азота ни в коем случае не должен весить больше другого литра азота даже и на тысячную долю! Значит, тут кроется какая-то тайна. НЕИЗВЕСТНАЯ ПРИМЕСЬ Рэлей написал письмо о своих опытах в лондонский научный журнал «Nature» (по-русски это значит «Природа»). Редакция журнала напечатала письмо Рэлея. «Азот, — писал Рэлей, — весит совершенно одинаково, откуда бы его ни добыть — из азотистокислого аммония, из аммиака, из мочевины, из селитры. Одно только есть исключение: азот, добытый из воздуха. Азот воздуха тяжелее, чем азот аммиака, мочевины, селитры. Значит, азот воздуха — это какой-то особенный азот. Не сумеет ли кто-нибудь из химиков объяснить аномалию (ненормальность) воздушного азота?» Журнал «Nature» — очень известный журнал. Не только в Англии, но и на всем земном шаре нет такого физика или химика, который не читал бы журнала «Nature». Физики и химики всего мира прочитали письмо Рэлея, но тщетно ждал он ответа. Никто не отозвался на его письмо, никто не сумел объяснить аномалию воздушного азота. Тогда Рэлей обратился за советом к своему приятелю, лондонскому профессору химии Уильяму Рамзаю. Он подробно рассказал Рамзаю о своих опытах и предложил ему вместе заняться расследованием вопроса о том, почему литр «воздушного» азота на целых 6 миллиграммов расходится в весе с литром всякого другого азота. Рэлей и Рамзай долго спорили о причинах непонятного расхождения в 6 миллиграммов. Наконец Рамзаю пришла в голову догадка: а что если азот, добытый из воздуха, — не чистый азот?
Уильям Рамзай Надо бы узнать, нет ли в нем какой-нибудь неожиданной примеси какого-нибудь тяжелого газа, который и дает эти лишние 6 миллиграммов. Что же это за газ? Рамзай еще ничего не знал о нем Одно только было несомненно: этот газ должен быть тяжелее азота. Если бы он был легче, то и азот, к которому подмешан какой-то процент этого газа, был бы легче, а не тяжелее стопроцентного азота. Ведь стакан чистого песка легче стакана, наполненного смесью песка и свинцовой дроби. Но если к азоту воздуха подмешан какой-то тяжелый газ, то как могло случиться, что химики его не заметили? Химики делали много опытов с воздухом, почему же они до сих пор не обнаружили, что в воздухе, если его очистить от пыли, водяных паров и углекислоты, есть, кроме кислорода и азота, еще какой-то третий газ? Рэлей и Рамзай стали рыться в книгах и журналах. Они перечитывали описания всех опытов с воздухом, когда-либо проделанных учеными. Но нигде не отыскали они ни единого слова, которое могло бы подтвердить их догадку о существовании третьего газа. И только в одной старинной книге, где описывались опыты с «мефитическим газом» (так химики XVIII столетия называли азот), Рэлей и Рамзай наткнулись на одно место, которое заставило их насторожиться. ЗАБЫТЫЙ ОПЫТ В конце XVIII века жил в Лондоне ученый химик, которого звали Генри Кавендиш. Это был нелюдимый и одинокий человек. Он появлялся на улицах с узловатой палкой, в длинном дедовском сюртуке и в широкополой шляпе. О его странностях и причудах по городу ходило множество слухов и басен. Передавали, будто нелюдимость его и суровость доходят до того, что иной раз за целый день он не произносит ни одного слова. Говорили еще, что он очень богат и все свое огромное состояние тратит на всякие опыты и на покупку научных машин и приборов. Об опытах своих и открытиях он никому не рассказывает: опытами и открытиями он занят для собственного удовольствия, и мнение других людей нисколько его не интересует[8].
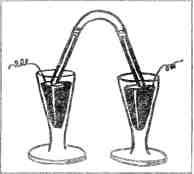
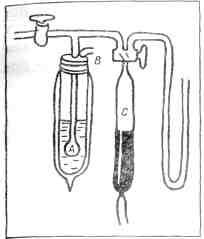
Генри Кавендиш Еще говорили, что Кавендиш устроил у себя в доме библиотеку научных книг и открыл в нее доступ всем, кто пожелает ею пользоваться. Каждый посетитель может унести к себе домой любую книгу, оставив хозяину расписку. Шутники утверждали, будто сам Кавендиш так строго и точно соблюдает установленные им в библиотеке порядки, что всякий раз, когда ему случается взять книгу из собственного книжного шкафа, он выдает себе расписку: «Такого-то числа такую-то книгу взял у Генри Кавендиша Генри Кавендиш». Чудак Кавендиш давно умер. Давно забыты его широкополая шляпа, его сюртук, его причуды. Но физики и химики помнят, что Генри Кавендиш первый открыл, из чего состоит вода, и первый вычислил, сколько весит земной шар. А в 1785 году, изучая свойства «мефитического газа» — азота, он проделал опыт, который через сто девять лет научил Рэлея и Рамзая, как разгадать тайну «воздушного» азота. Генри Кавендиш взял стеклянную трубку, изогнутую в виде латинской буквы U. Наполнив трубку смесью азота с кислородом, он вставил ее в рюмки со ртутью — одним концом в одну рюмку, другим в другую (рис. 5). А потом стал через смесь азота и кислорода гнать электрические искры. В наше время есть много усовершенствованных машин для добывания электрических искр — индукционная катушка Румкорфа, высоковольтные трансформаторы, генераторы высокого напряжения. Но во времена Генри
Рис. 5. Рюмки со ртутью Кавендиша всех этих машин еще не было. Ученые знали только один способ добывать электрическую искру: трение. Кавендиш получал электрические искры трением стекла о кожу. В машине, которая была у него в лаборатории, большое стеклянное колесо, вращаясь, терлось о кожаные подушки (рис. 6). Стекло и кожа заряжались электричеством, и это электричество Кавендиш отводил по проволокам в рюмки со ртутью — электричество стекла в одну рюмку, электричества кожи в другую. Когда электричества в рюмках скапливалось достаточно, электрические искры начинали скакать из одной рюмки в другую по изогнутой трубке, наполненной смесью азота с кислородом. Кавендишу это и было нужно. Он знал, что под действием электрических искр кислород вступает в химическое соединение с азотом. И в самом деле, как только посыпались искры, стеклянная трубка наполнялась оранжево-красным дымом. — Оранжево-красный дым — это окислы азота, соединение азота с кислородом.
Рис. 6. Электрическая машина Кавендиша Кавендиш набрал в пипетку раствор едкого натра и впустил несколько капель этой жидкости внутрь изогнутой трубки. Оранжевый дым сейчас же исчез. Он без остатка растворился в едком натре. Но Генри Кавендиш решил гнать искры через трубку до тех пор, пока весь кислород и весь азот, запертые в ней, не превратятся в окислы азота. Это была трудная задача. Искры получались у Кавендиша слабенькие, да и следовали они одна за другой не сразу, а через большие промежутки — не то, что в теперешних машинах, где искры сыплются непрерывным потоком. Целых три недели, днем и ночью, сменяя друг друга, Кавендиш и его слуга вращали стеклянное колесо электрической машины. Азот и кислород в трубке медленно соединялись друг с другом, превращаясь в оранжевый дым. Едкий натр уничтожал этот дым, впитывал его в себя. Все меньше и меньше азота с кислородом оставалось в трубке. А освободившееся место заполняла ртуть. И с каждым днем в обоих коленах трубки уровень ртути делался все выше и выше. Наконец, через три недели, работа была окончена. Ртуть заполнила оба колена трубки. Значит, весь азот, который был в трубке, соединился с кислородом и вместе с ним растворился в едком натре. Но, приглядевшись внимательнее, Кавендиш увидел над ртутью и едким натром крохотный пузырек газа. Кавендиш еще раз пропустил электрическую искру. Но пузырек не исчезал. Генри Кавендиш, по своему обыкновению, точно записал все подробности опыта. Не забыл он упомянуть и о крошечном пузырьке. «Пузырек, — писал Кавендиш, — это был остаток азота, который почему-то не удалось соединить с кислородом». «ОБРАТИ ВНИМАНИЕ!» Рамзай не в первый раз читал об этом опыте. Когда он еще не был профессором химии, а был всего только молодым студентом, он перелистывал однажды биографию Кавендиша. В книге были приведены отрывки из лабораторного журнала, в который Кавендиш день за днем вносил все подробности своих опытов. Упоминание о крохотном пузырьке, не пожелавшем соединяться с кислородом, удивило Рамзая. И на полях книги, как раз против строчек о таинственном пузырьке, Рамзай написал карандашом: «look into this» («обрати внимание»). Впоследствии Рамзай позабыл о пузырьке: у него нашлись задачи поинтереснее, чем проверка опытов, проделанных старым чудаком сто лет тому назад. Но теперь, когда он вместе с Рэлеем задумал объяснить аномалию воздушного азота, он сразу разгадал тайну пузырька. Ведь азот-то для своих опытов Кавендиш добывал не из аммиака, не из селитры, а из воздуха! И при этом азот, который он добыл из воздуха, не весь соединился с кислородом, сколько ни бился над ним старый Кавендиш. В изогнутой трубке, так писал сам Кавендиш, от всего азота остался лишь маленький пузырек, но пузырек этот был особенный, не похожий на обыкновенный азот: никакие искры не могли заставить его соединиться с кислородом. И вот у Рамзая мелькнула мысль: а что, если этот пузырек был вовсе не азот, а какой-то другой, не замеченный химиками газ, подмешанный к воздушному азоту? Верно, этот неизвестный газ — и есть та самая примесь, которая делает каждый литр воздушного азота на целых 6 миллиграммов тяжелее, чем литр азота из аммиака или селитры. Но как узнать, верно это или нет? Как проверить эту догадку? А вот как: если такой газ в самом деле существует, нужно во что бы то ни стало разлучить его с азотом. ПРИМЕСЬ НАЙДЕНА Физик Рэлей и химик Рамзай заперлись в своих лабораториях и стали порознь решать задачу: как извлечь из воздушного азота спрятанную в нем примесь? Они условились не выходить из лабораторий до тех пор, пока неизвестная примесь не будет выделена. А для того чтобы каждый знал, как идут дела у другого, они ежедневно обменивались через посыльного письмами и протоколами опытов. Рэлей решил попросту повторить опыт Кавендиша, но в гораздо больших размерах. Ему-то это было легко: ведь в его время физики располагали такими электрическими приборами, о которых Кавендиш, за сто лет перед тем, не смел и мечтать. Если к азоту и в самом деле подмешан какой-то неизвестный газ, не соединяющийся с кислородом, то теперь возможно добыть не крошечный пузырек этого газа, как сделал Кавендиш, а по крайней мере несколько кубических сантиметров. И тогда будет нетрудно изучить этот газ, узнать его химические свойства, взвесить его на точных весах. Рэлей взял стеклянный баллон и впаял в него две проволоки.
Рис. 7. Прибор Рэлея Внутри баллона между концами проволок оставалось расстояние в несколько сантиметров. Наружные концы проволок торчали из баллона. Рзлей соединил их с высоковольтным трансформатором (рис. 7). Когда будет включено электрическое напряжение, внутри баллона с кончика одной проволоки на кончик другой, через маленький промежуток в несколько сантиметров, поскачут электрические искры. Рзлей накачал в баллон несколько литров азота и кислорода, а потом стал вгонять туда насосом раствор едкого натра. Едкий натр фонтаном врывался в баллон и вытекал из него по особой стеклянной трубочке. В то же время Рэлей включил электрическое напряжение. Посыпались искры, и под действием этих искр азот стал вступать в химическое соединение с кислородом. Рэлею только этого и надо было: он знал, что, едва лишь азот соединится с кислородом, его можно будет выгнать из баллона с помощью едкого натра. Едкий натр (об этом писал и Кавендиш) поглощает соединение азота с кислородом. И в самом деле: через несколько часов весь азот, который был в баллоне, соединился с кислородом и ушел прочь из баллона вместе со струей едкого натра. Азот ушел из баллона, но баллон не совсем опустел. На это указывал манометр — прибор, которым измеряют давление газа на стенки сосуда. Значит, в баллоне остался какой-то газ — очевидно, тот самый подмешанный к азоту газ, который так упорно искали Рэлей и Рамзай. Этот газ не соединяется с кислородом, не растворяется в едком натре. Потому-то он и остался в баллоне. Рэлей тщательно просушил и профильтровал новый газ, продувая его через фарфоровую трубку с горячими медными опилками. Горячие медные опилки очистили газ и от того ничтожного количества кислорода, которое все еще в нем оставалось. Так Рэлей решил свою задачу — выделил неизвестный газ, подмешанный к азоту. А как решил ту же задачу Рамзай? Он поступил иначе. В его химической лаборатории не было высоковольтного трансформатора, какой был в лаборатории физика Рэлея. Но Рамзай был опытным химиком. Ему и без трансформатора удалось разлучить азот с неизвестным газом. Он достал трубочку из тугоплавкого стекла, насыпал в нее кусочки магния и засунул ее в электрическую печку. Когда печка нагрелась, кусочки магния раскалились докрасна. Тогда Рамзай взял насос и стал гонять взад и вперед по этой трубочке азот, добытый из воздуха. Раскаленный магний — это ловушка для азота: магний впитывает его в себя. Десять дней подряд гонял Рамзай по трубочке несколько литров азота. Наконец весь азот был поглощен раскаленным магнием. Но в трубочке остался газ, который ни за что не соглашался соединиться с магнием. Рэлей и Рамзай шли разными путями, но пришли к одной и той же цели. Неизвестный газ был пойман, выделен, очищен и заперт в стеклянный баллон. ЛЕНИВЫЙ ГАЗ Оба ученых сейчас же принялись изучать новооткрытый газ. Наконец-то им удалось взвесить его на весах в чистом виде и узнать, правильна ли догадка Рамзая, что новый газ тяжелее, чем азот. Да, тяжелее. Почти в полтора раза. Так было объяснено расхождение в весе между «воздушным» и «аммиачным» азотом. После этого Рэлей и Рамзай стали проделывать с новым газом всевозможные химические опыты. Они уже знали, что он не соединяется ни с кислородом, ни с магнием: ведь потому-то им и удалось извлечь его из азота. Но с какими же веществами он соединяется? Множество разных веществ испытали Рэлей и Рамзай. Они попробовали соединить новый газ с водородом, с хлором, с фтором, с металлами, с углем, с серой. Но все было напрасно: газ упорно отказывался вступать в химическое соединение. Не помогло ни сильное нагревание, ни сжатие, ни электрические искры, ни прикосновение губчатой платины — словом, ни один из многочисленных способов, которые применяют химики, чтобы заставлять вещества соединяться друг с другом. В конце концов Рэлей и Рамзай вынуждены были прийти к заключению, что нет на свете такого вещества, с которым мог бы соединиться открытый ими газ. Ученые еще никогда не встречали газа, обладающего таким странным свойством. Рэлей и Рамзай придумали для него название «аргон». По-гречески это значит «ленивый». ПОБЕДА ТОЧНОСТИ В августе 1894 года в старинном университетском городке Оксфорде состоялся съезд английских физиков, химиков, естествоиспытателей. На этом съезде Рэлей впервые рассказал о новом открытии. Его доклад вызвал удивление и недоверие. Еще бы! Каждый школь- ник знает, что воздух состоит из кислорода и азота. Так написано во всех учебниках. А Рэлей и Рамзай решаются утверждать, что в каждом литре воздуха, самого обыкновенного воздуха, того воздуха, которым мы дышим, есть еще девять кубических сантиметров нового, не замеченного химиками газа. Девять кубических сантиметров на литр — это не так уж мало. «В каждом кубометре воздуха, — утверждал в своем докладе Рэлей, — содержится около пятнадцати граммов аргона. В зале, в котором заседает съезд, по этому расчету должно содержаться несколько пудов аргона». С удивлением выслушали химики рассказ Рэлея. Но еще больше удивились они, когда Рэлей заявил, что берется доказать существование аргона при помощи... трубок для курения табака! Рэлей тут же взял восемь таких трубок — восемь прямых коротких трубок из обожженной глины, какие курят англичане, — и соединил их гуттаперчевыми креплениями. Получилась одна прямая и длинная труба. Он вставил ее в стеклянный сосуд, соединенный с воздушным насосом: труба входила в сосуд через отверстие в крышке, а выходила через отверстие в дне. Все щели прибора Рэлей тщательно залил сургучом. Потом он принялся гнать по трубе добытый из воздуха азот. Азот втекал в один конец трубы, а из другого вытекал в газометр. Но вытекал не весь — большая часть его терялась по дороге. Ведь обожженная глина — это пористый материал со множеством микроскопических трещинок и лазеек. Через эти-то лазейки азот и просачивался наружу в сосуд. А для того чтобы он просачивался еще быстрее, из сосуда все время выкачивали воздух. Лишь ничтожным остаткам азота удавалось пройти через трубу от одного конца до другого и попасть в газометр. Рэлей взял из газометра кубический сантиметр газа и на глазах у химиков взвесил его. Оказалось, что он был на целых двенадцать — пятнадцать процентов тяжелее, чем кубический сантиметр обыкновенного азота. И вот Рэлей предложил съезду вопрос: как объяснить этот удивительный опыт? Почему азот, пройдя по глиняной трубке, сделался более тяжелым газом? Неужели же простая глиняная трубка отличается какими-то особыми волшебными свойствами? Есть только одно объяснение: по глиняной трубке проходил не азот, а смесь азота с каким-то более тяжелым газом. Оба газа терялись по дороге, просачиваясь сквозь глину в стеклянный сосуд. Но терялись они не одинаково: легкий газ просачивался быстрее, а тяжелый медленнее[9]. И вот потому-то в газометре оказалось больше тяжелого газа, чем легкого. Это была уже не смесь азота с аргоном, а почти чистый аргон.
Рис. 8. Весы Другого объяснения нет и не может быть. Опыт с восемью курительными трубками наглядно доказал существование нового газа. Для большей убедительности Рэлей и Рамзай продемонстрировали оксфордскому съезду и чистый аргон, добытый в опыте с электрическими искрами и в опыте с раскаленным магнием. Съезду пришлось поверить в аргон. Новый газ, не соединяющийся ни с какими другими веществами, получил в августе 1894 года полное признание. Вслед за английскими химиками его признали и химики во всех других странах. История аргона началась с разницы в числах — 1,2507 и 1,2565. Разница очень ничтожная: какие-то тысячные доли, третья цифра после запятой. Но эта третья цифра выдала аргон с головой. Если бы старый Кавендиш обнаружил эту третью цифру после запятой, он понял бы, что значил его крошечный пузырек газа. Он держал аргон в руках, но аргон остался неоткрытым. У Кавендиша не было тех чувствительных и тонких приборов, которыми взвешивали тысячные доли грамма Рэлей и Рамзай. У Кавендиша не было точных весов (рис. 8). Открытие аргона в конце XIX века — это была победа точности, победа третьей цифры после запятой. Это была победа весов. Однажды утром в феврале 1895 года Рамзай получил письмо от лондонского химика Генри Майерса. Майерс писал, что в одном из старых номеров американского геологического журнала была помещена интересная статья, на которую теперь, после открытия аргона, следовало бы обратить внимание. Автор статьи — геолог Хильдебранд — утверждал, что некоторые очень редкие минералы обладают замечательным свойством. Если их кипятить в серной кислоте, они выделяют какой-то газ, который не поддерживает горения и сам не горит — по мнению Хильдебранда, азот. Один из минералов, выделяющих такой негорючий газ, — это клевеит. Он был найден в Норвегии знаменитым полярным путешественником Норденшельдом, который обнаружил черные зернышки и прожилки клевеита в некоторых горных породах. «Быть может, — писал Майерс, — газ, полученный из клевеита, совсем не азот, а новый газ аргон?» Рамзай сперва не заинтересовался сообщением Майерса. В то время он был занят важным делом — точным измерением плотности и теплоемкости аргона. Он прочел письмо и отложил его в сторону. Но через несколько недель, когда измерения были закончены, он вспомнил о Майерсе, перечел письмо и сразу взялся за дело. Он позвал мальчика, прислуживавшего в лаборатории, и велел ему достать как можно больше клевеита. Мальчик обошел все химические магазины Лондона и к полудню принес Рамзаю один грамм клевеита. Это стоило 3 шиллинга и 6 пенсов. Рамзай и его ассистент Мэтьюз приступили к опыту. Они стали прогревать кусочек клевеита в пробирке с серной кислотой и уже к вечеру того же дня извлекли несколько кубических сантиметров газа. Четыре дня ушло на то, чтобы очистить газ от тех примесей, которые легко соединяются с другими веществами. Примесей было немного — большая часть газа ни с чем не хотела соединяться.
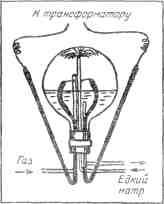
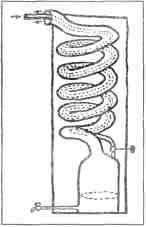
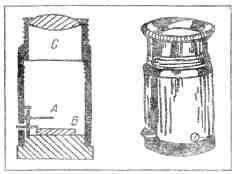
Рис. 9. Стеклянная трубочка с газом для наблюдения спектра Очищенный от примесей газ Рамзай ввел в стеклянную трубочку для наблюдения спектра (рис. 9). Эта трубочка посередине очень узка, а у концов пошире. С обоих концов в нее впаяны платиновые проволочки. Когда нужно изучить спектр какого-нибудь газа, этим газом наполняют трубочку и запаивают ее. Затем по платиновым проволочкам через трубочку пропускают электрический ток. Под действием тока в самом узком месте трубочки газ начинает ярко светиться, и тогда с помощью спектроскопа можно рассмотреть его спектр. Рамзай прекрасно знал, какой у аргона спектр. В этом спектре должны ярко светиться оранжевые и зеленые линии. Но у газа, который вышел из клевеита при нагревании, линии оказались иные: желтая линия и несколько слабых линий других цветов. В первую минуту Рамзай был готов подумать, что эту желтую линию дает натрий. Уж не попала ли каким-нибудь образом в спектроскопическую трубочку пылинка натрия? Может быть, к платиновым проволочкам пристала какая-то грязь, в которой был натрий? Но ведь спектроскопическую трубочку Рамзай приготовил собственными руками, а у него не было привычки брать для работы грязные платиновые проволочки. А может быть, дело тут не в посторонней примеси, а в самом спектроскопе? Может быть, желтая линия, которую увидел Рамзай в спектре, была не настоящей линией, а «привидением»? (Спектроскописты называют «привидениями» и «духами» те линии, которые появляются в спектре из-за неисправности спектроскопа.) Рамзай разобрал свой спектроскоп, протер замшевой тряпочкой призму, проверил щель. Все было в полном порядке. И все-таки, когда он вновь собрал спектроскоп, желтая линия загорелась на прежнем месте. Она не хотела уходить. Она не была привидением. Как же в конце концов проверить — совпадает ли эта желтая линия с желтой линией натрия? Рамзай нарочно ввел в трубочку немножко натрия, снова запаял ее и принялся рассматривать спектр. Прежняя желтая линия осталась на месте, но рядом с ней появилась другая, на этот раз настоящая линия натрия. Теперь уж больше не оставалось ни малейших сомнений в том, что первая желтая линия принадлежит не натрию, а какому-то другому веществу. Но какому же? Рамзай перебрал в памяти спектры всех известных ему веществ. Ничего подходящего он не мог припомнить. Наконец после долгих размышлений он вспомнил о той желтой линии D3, которую открыли Жансен и Локьер тридцать лет назад. По своему расположению в спектре она как будто совпадает с загадочной желтой линией, которую нашел Рамзай. А если это так, то газ, выходящий из клевеита, не азот, не аргон, а солнечный газ — гелий. У Рамзая не было приборов, чтобы точно определять положение линий в спектре. Поэтому он послал спектроскопическую трубочку с новым газом лондонскому физику Уильяму Круксу — одному из лучших тогдашних специалистов по спектроскопии. Осторожный в своих научных выводах, Рамзай утаил от Крукса свое предположение, что найденный им газ — это гелий. Он написал только, что нашел какой-то новый газ, который предлагает назвать «криптоном», и просит Крукса тщательно определить положение всех линий в спектре нового газа. Крукс пропустил через криптон электрический ток. И вот в спектроскопе вспыхнула та самая желтая линия гелия, которую Жансен и Локьер нашли в спектре солнечных выступов. Значит, в присланной от Рамзая трубочке находится то самое таинственное вещество, которого не держал в руках ни один человек на земле. Крукс послал Рамзаю городскую телеграмму. В ней было всего несколько слов: Crypton is Helium. Come and see it. Crookes По-русски это означает: «Криптон — это гелий. Приезжайте — увидите. Крукс». Так был найден на Земле гелий, найденный на Солнце за двадцать семь лет перед тем. Рамзай немедленно приехал в лабораторию Крукса, и они вместе занялись подробным изучением спектра гелия. Кроме желтой линии D3, они обнаружили в спектре гелия еще пять линий: две красные, одну зеленую, одну синюю и одну фиолетовую. Эти линии не были замечены астрономами потому, что в спектре солнечных выступов они горят недостаточно ярко. Гелий, найденный на Земле, дал ученым возможность полнее и подробнее рассмотреть его спектр. После измерений Крукса уже нельзя было сомневаться в том, что найденный Рамзаем газ есть действительно гелий[10]. В тот же день — 23 марта 1895 года — Рамзай решился опубликовать свое открытие. Он послал короткое сообщение Лондонскому Королевскому обществу (так называется высшее научное учреждение в Англии) и одновременно написал письмо известному французскому химику академику Вертело с просьбой сообщить Парижской академии наук об открытии гелия на Земле. В истории открытий бывают странные совпадения. Через две недели после Рамзая другой химик, швед Ланглей, тоже добыл гелий, тоже из клевеита, и сообщил о своем открытии тому же академику Вертело. Письмо его было помечено 8 апреля 1895 года. НОВАЯ ЗАДАЧА Как только Рамзай добыл из клевеита гелий, он сейчас же стал проделывать с ним разнообразные опыты. Ведь он был первый химик на свете, которому посчастливилось держать в руках солнечное вещество. Гелий, открытый на Солнце, нельзя было взвешивать. Астрономы только догадывались, что это один из легчайших газов. Рамзай впервые взвесил гелий. Он убедился, что астрономы были правы: гелий и в самом деле оказался очень легким газом. Изо всех газов один только водород легче гелия, а все другие тяжелее. Воздух тяжелее гелия почти в семь раз. Потом Рамзай решил испытать, может ли гелий химически соединяться с другими веществами. Он перепробовал множество веществ, но ни с одним из них гелий не захотел соединяться. Значит, гелий тоже ленивый газ, как и аргон. А если так, то не поискать ли его в воздухе? Ведь газ, который не желает соединяться с другими веществами, непременно уйдет в воздух. Даже если он находится в недрах земли, в горных породах, то и тогда проберется он в атмосферу по трещинкам и порам. Как же узнать, есть ли в атмосфере гелий? Как добыть гелий не из редкого минерала клевеита, а из самого обыкновенного воздуха? Если правда, что гелий растворен в воздухе, то есть только один способ извлечь его оттуда. Нужно удалить из воздуха все другие газы — убрать кислород, убрать азот, убрать аргон. То, что останется, это, верно, и будет гелий. Но как же это сделать? Как удалить из воздуха кислород, азот и аргон? Кислород удалить нетрудно. Рамзай знал, что раскаленная медь поглощает кислород, присоединяет его к себе. Батарея фарфоровых трубок, наполненных раскаленными медными опилками, — вот прибор для удаления кислорода из воздуха. Насосы гонят воздух по трубкам — из одной в другую, — и по дороге кислород застревает в раскаленных опилках. И вот из батареи в закрытый сосуд, в газометр, течет уже не воздух, а воздух минус кислород, воздух, освобожденный от кислорода. После кислорода легко убрать и азот. Тут уж не медь нужна, а другой металл — магний. Нужно взять такие же фарфоровые трубки, но наполнить их не раскаленной медью, а раскаленным магнием. Из второй батареи в газометр будет вытекать не воздух, а воздух минус кислород и минус азот. Ну а как быть с аргоном? Ведь аргон ленивый газ: он не соединится ни с магнием, ни с медью. Нет такого раскаленного металла, который мог бы впитать в себя аргон. Он пройдет через обе батареи и не застрянет в пути. И гелий тоже ленив, он тоже не застрянет в раскаленных опилках. Вместе с аргоном он проскочит через обе батареи. Как же отделить гелий от аргона? Как из смеси аргона с гелием добыть чистый гелий? Рамзай долго ломал себе голову над этой задачей. Если бы можно было найти такое вещество, которое соединяется с аргоном, но не с гелием, — тогда задача была бы решена. Аргон застрял бы в этом веществе, как раньше застряли кислород и азот, и в газометре остался бы чистый гелий. Но ведь в том-то и беда, что такого вещества в природе нет. Ни одно вещество не соединяется с ленивым газом аргоном. Значит, аргон нельзя удалить тем же способом, каким были удалены кислород и азот. Задача казалась неразрешимой. КЛЮЧ К РЕШЕНИЮ Только после долгого раздумья Рамзай понял, что ему делать. Он вспомнил, как поступают химики, когда из смеси спирта с водой нужно добыть чистый спирт. Спирт испаряется быстрее, чем вода. Этим-то и пользуются химики. Они нагревают смесь. Первые порции пара, поднимающиеся над жидкостью, — это пары чистого спирта. Следующие порции — это смесь паров воды и паров спирта. А последним идет уже чистый водяной пар. С первыми порциями пара дела немного. Стоит охладить этот пар, и он сразу превратится в чистый спирт. А вот со следующими порциями, со смесью паров, возни больше. Их тоже собирают, тоже охлаждают, но в холодильник теперь уже течет не чистый спирт, а смесь воды и спирта. Эту смесь снова пускают в перегонный аппарат, снова нагревают, и вот опять поднимаются пары — сперва пары чистого спирта, а за ними и смесь, которую еще раз пускают в перегонку. И вся эта история повторяется до тех пор, пока не удается окончательно разлучить воду со спиртом. Этот хлопотливый, но верный способ отделения одной жидкости от другой называется у химиков дробной перегонкой. На этот раз Рамзай решил отделить дробной перегонкой гелий от аргона. Но разве это возможно? Ведь дробной перегонкой химики разлучают жидкости, а гелий и аргон — газы. Рамзай доказал, что это возможно. Нужно только превратить воздух в жидкость, а потом дать ему испариться. При перегонке составные части воздуха будут уходить из него не все сразу, а по очереди: сперва уйдет та, которая легче всего испаряется, а за ней и другие, которые испаряются медленнее. Так дробная перегонка поможет отделить гелий от аргона. Значит, остановка только за тем, чтобы сделать воздух жидким. Для этого нужен очень большой холод: при 192 градусах ниже нуля воздух превращается в жидкость. Нигде на Земле такого мороза не бывает. Но люди научились создавать его сами. Мороз в -192 градуса производят особые холодильные машины. Почти в каждой хорошо оборудованной лаборатории вы найдете в наше время холодильную машину. Но в те времена, когда Рамзай занимался поисками гелия в воздухе, в целом мире существовали всего лишь три-четыре лаборатории, в которых сложными и громоздкими способами добывался жидкий воздух. Рамзай был в большом затруднении. Для задуманной работы требовалось много жидкого воздуха. А он был редкостью. Но тут Рамзаю неожиданно повезло. На его счастье, как раз в ту пору, когда жидкий воздух был ему необходим, а достать его было негде, — в эти самые дни, как будто нарочно для него, изобрели холодильную машину, такую простую и удобную, что ее можно было завести в каждой лаборатории. Два человека изобрели ее в одно и то же время. Они жили в разных странах и работали порознь. Но изобретенные ими машины устроены совершенно одинаково. ИЗГОТОВЛЕНИЕ ХОЛОДА Если воздух сильно сжать, а затем дать ему быстро расшириться, он сразу охладится. На этом физическом законе и основано устройство холодильной машины (рис. 10). В машину подают воздух. Мощные насосы сжимают его в узкой трубе, а затем выгоняют в просторную камеру. Тут он сразу расширяется и становится холоднее. Этим охлажденным воздухом охлаждают новую порцию сжатого воздуха, поступившую в машину. А расширившись, она становится еще холоднее. Второй порцией охлаждают третью, третьей четвертую, и наконец в машине наступает мороз в -192 градуса. Воздух так охлажден, что превратился в жидкость. Теперь вся задача в том, чтоб он остался жидкостью, а не испарился вновь. Нужно защитить его от наружного тепла. Недостаточно держать его в обыкновенном леднике. Для него и ледник — баня. Он будет кипеть на льду как на горячих угольях, кипеть самым настоящим образом — булькать, шипеть, плеваться и уходить паром в воздух. Выставьте его на пятидесяти-, шестидесяти-, восьмидесятиградусный мороз, отвезите его на Северный полюс — он и там выкипит в одну минуту. Как же держать его в лаборатории, в комнатном тепле? Есть такой стеклянный сосуд с двойными посеребренными стенками (рис. 11). Между внутренней и наружной стенкой — пустота: оттуда выкачан воздух.
Рис. 10. Машина для превращения воздуха в жидкость. Сжатый воздух втекает в машину по внутренней трубке, обозначенной на рисунке штрихом. Попав в камеру, воздух расширяется, делается холоднее и возвращается по наружной трубе. Поднимаясь по наружной трубе, он охлаждает новую порцию сжатого воздуха, которая в это время опускается в камеру по внутренней трубке. В конце концов воздух превращается в жидкость и каплями стекает в камеру. Открыв кран, можно выпустить из машины жидкий воздух, как кипяток из самовара Пустота — это лучшая преграда для тепла. Тепло почти не проникает внутрь сосуда, и жидкий воздух часами остается у нас в плену. Такие сосуды называются дьюарами. Их изобрел английский физик Дьюар.
Рис. 11. Сосуды Дьюара Дьюар сам приготовлял у себя в лаборатории жидкий воздух, но его способ превращения воздуха в жидкость был сложен и труден, а к тому же изобретатель хранил его в секрете. Практичные и доступные холодильные машины были изобретены другими учеными — немцем Линде и англичанином Хэмпсоном. Хэмпсон жил в том же городе, что и Рамзай, — в Лондоне. Он знал, что Рамзаю нужен жидкий воздух. Первые сто кубических сантиметров, добытых новой холодильной машиной, Хэмпсон налил в дьюар и послал Рамзаю. НЕЧАЯННАЯ НАХОДКА Молодые химики, работавшие в лаборатории Рамзая, оставили свои склянки, тигли и весы и побежали взглянуть на невиданное вещество — жидкий воздух. Каждому хотелось посмотреть, как будет Рамзай извлекать из жидкого воздуха гелий. Но прежде чем заняться поисками гелия, Рамзай показал своим ученикам несколько удивительных опытов. Он опустил в жидкий воздух резиновый мячик, а потом вынул его и бросил об пол. Мячик не подпрыгнул, а разлетелся вдребезги: резина при температуре жидкого воздуха потеряла свою упругость и сделалась хрупкой, как стекло. Потом Рамзай опустил в жидкий воздух флакончик со ртутью. Ртуть сейчас же замерзла и стала крепче железа. Тут же, на глазах у своих учеников, Рамзай сделал из замерзшей ртути молоток и вбил им в стенку гвоздь. Потом он погрузил в жидкий воздух кусок хлеба, а через минуту вынул его оттуда и приказал завесить все окна в лаборатории плотными шторами. В комнате стало темно, и все увидели, что обыкновенный белый хлеб, побывавший в жидком воздухе, светится голубым сиянием. Много еще других опытов проделал Рамзай. Все знакомые вещи чудесно менялись, погружаясь в кипящую без огня жидкость. Молодые химики стояли вокруг и следили за каждым движением Рамзая. Одно только было им непонятно: почему он все откладывает поиски гелия и тратит время на фокусы? А между тем драгоценная жидкость испаряется в открытом сосуде, и с каждой минутой ее становится все меньше и меньше. Еще сильнее удивились химики, когда Рамзай, прекратив свои опыты, оставил дьюар на столе и спокойно отправился обедать. Вернулся он только через полтора часа. В дьюаре кипели ничтожные остатки жидкого воздуха — несколько кубических сантиметров. Но Рамзая это нисколько не смутило. Он с умыслом оттягивал время. «Гелий, — думал он, — как и большинство газов, по всей вероятности, улетучивается медленнее, чем кислород и азот. Поэтому пусть жидкий воздух испаряется: из него уйдет почти весь кислород с азотом, а гелий во всяком случае останется в дьюаре». Когда жидкого воздуха осталось немного, всего только два-три кубических сантиметра, Рамзай перелил его в закрытый сосуд — газометр, — чтобы пар, богатый гелием, не растекался больше по комнате. В газометре жидкость продолжала кипеть, но пары оставались взаперти. Рамзай полагал, что в этих-то парах и содержится гелий. Чтобы окончательно очистить пары от кислорода и азота, Рамзай стал продувать их через батарею фарфоровых трубок — сперва с раскаленной медью, а потом с раскаленным магнием. В первой батарее газ начисто избавился от кислорода, а во второй — от азота. Наконец-то у Рамзая было несколько пузырьков газа, проскочившего через обе батареи. Он ввел их в спектроскопическую трубочку и включил электрический ток. Запертые в трубочке газы засветились, и Рамзай начал изучать их спектр. Он увидел спектральные линии аргона — оранжевые и зеленые. Они горели точь-в-точь на тех местах, где Рамзай привык их видеть в аргоновом спектре. Но линий гелия в спектре не было. Видно, гелий улетучился прежде, чем жидкий воздух был перелит из дьюара в газометр. Значит, Рамзай ошибся в своих расчетах. Одно из двух: либо гелия в воздухе нет, либо он испаряется с той же быстротой, что кислород и азот, а может, еще быстрее. Но Рамзаю не пришлось жалеть о своей ошибке. Внимательно рассмотрев спектр, он обнаружил в нем, кроме линий аргона, еще какие-то две яркие спектральные линии, которых он никогда прежде не видал, — одну желтую, другую зеленую. Ни та, ни другая не совпадала со спектральными линиями известных раньше веществ. Значит, вместе с аргоном в спектроскопической трубочке оказался какой-то новый газ. Рамзай решил назвать этот газ криптоном. Криптон — по-гречески значит «скрытый». Когда-то Рамзай собирался назвать криптоном гелий, но так. как у гелия уже было имя, которое дал ему астроном Локьер, — имя «криптон» пригодилось для нового газа. Криптона в воздухе очень мало, но он улетучивался из дьюара медленно — гораздо медленнее, чем кислород и азот. Вот потому-то последние остатки жидкого воздуха, перелитые в газометр, оказались богатыми криптоном. И чувствительный спектроскоп явственно обнаружил рядом с зелеными и оранжевыми линиями аргона желтую и зеленую линию криптона. Так Рамзай искал в воздухе гелий, а нашел криптон. ГЕЛИЙ ОТКРЫТ В ТРЕТИЙ РАЗ Через два дня Хэмпсон снова прислал Рамзаю жидкий воздух, на этот раз уже несколько литров. Рамзай решил возобновить охоту за гелием. Неудача прежней попытки не смущала его. Теперь он уже знал, как поступить.
Рис. 12. Прибор Рамзая для сжижения аргона. В газометре С находится ртуть, а над нею аргон. Если открыть кран, аргон потечет по трубке в стеклянный шар А, погруженный в дьюар с жидким воздухом. Трубка В устроена для того, чтобы жидкий воздух, испаряясь и превращаясь в газообразный, свободно уходил в атмосферу. (Если бы трубки В не было, то при испарении жидкого воздуха давление в дьюаре возрастало бы непрестанно и в конце концов дьюар разорвался бы на куски) Гелий — если только в воздухе он есть — испаряется быстрее, чем кислород, азот и аргон. Значит, нужно искать его не в последних остатках испаряющегося жидкого воздуха или жидкого аргона, а в первых пузырьках уходящего пара. Рамзай взял 15 литров аргона, запер их в стеклянный баллон, а баллон погрузил в полученный от Хзмпсона жидкий воздух. Аргон сильно охладился и тоже стал жидким (рис. 12). Тогда Рамзай принялся медленно выпаривать его. Первые пузырьки пара он перевел в спектроскопическую трубочку и пропустил через нее ток. Газ в трубочке загорелся оранжево-красным огнем. Когда Рамзай стал смотреть в спектроскоп, он увидел множество ярких оранжевых линий. Эти линии лежали в спектре на тех местах, где не горят линии ни одного из веществ, известных химикам раньше. Значит, Рамзаю опять удалось найти какой-то, до той поры неведомый газ. Рамзай сразу же придумал для нового газа имя. Он решил назвать его неоном. Неон — по-гречески значит «новый». Но в спектре были не только незнакомые линии нового газа неона. Рядом с ними горела и желтая линия. Она была тусклой, но все же Рамзай ее заметил. Он точно измерил ее положение в спектре. Сомнений у него больше не оставалось. Это была желтая линия D3, спектральная линия гелия. Значит, все-таки Рамзай оказался прав. Гелий — таинственный солнечный газ — и в самом деле содержится в воздухе. Вместе с воздухом он окружает нас со всех сторон и входит в наши легкие. Через несколько лет Рамзаю как-то пришлось читать публичную лекцию. Излагая историю своего открытия, он сказал: — Поиски гелия напоминают мне поиски очков, которые старый профессор ищет на ковре, на столе, под газетами и находит наконец у себя на носу. Гелий очень долго искали. А он был в воздухе! КОМПАНИЯ ЛЕНТЯЕВ Целых три года изучал Рамзай новооткрытые газы. Помощник Рамзая, Трэверс, построил машину, способную производить еще больший холод, чем машина Хэмпсона. Хэмпсон добился мороза в —192° С, а в машине, построенной Траверсом, стоял двухсотпятидесятитрехградусный мороз. У Хэмпсона в жидкость превращался воздух, а у Трэверса не только воздух, но и водород. Аргон у Хэмпсона был жидким как вода, а у Трэверса он замерзал и становился твердым как лед. Рамзай и Трэверс стали выпаривать твердый аргон и собирать первые порции пара отдельно от последующих. Первым всегда уходил гелий. А когда мороз делался слабее, начинал улетучиваться и неон. За ним испарялись аргон и криптон. А в самых последних пузырьках пара Рамзай и Трэверс отыскали еще один неизвестный газ. Его они назвали ксеноном. По-гречески это значит «чуждый». Каждый новый газ они очищали и взвешивали на точных весах. Наконец работа была закончена. Когда-то, до Рэлея и Рамзая, ученые были уверены, что воздух состоит только из кислорода и азота. Потом был открыт аргон. А Рамзай и Трэверс доказали, что к каждому литру воздуха подмешано, кроме аргона, 18 кубических миллиметров неона, 5 кубических миллиметров гелия, 1 кубический миллиметр криптона, одна десятая кубического миллиметра ксенона. Добыв из воздуха эти газы, Рамзай принялся проделывать с ними всевозможные опыты. Он хотел узнать, вступают ли они в какие-нибудь химические соединения. Оказалось, что не вступают. Не только аргон и гелий, но и неон, криптон и ксенон не захотели соединяться ни с одним веществом. Гелий, аргон, неон, криптон, ксенон — все они оказались инертными — ленивыми газами. Целая компания лентяев! И всех их Рамзай выделил из воздуха, очистил и изучил. Он изучил их спектры, измерил их плотности, температуры замерзания и кипения[11]. Первое время эти ленивые газы были большой редкостью в лабораториях. Очень немногие химики могли похвастаться тем, что держали в руках хотя бы крохотный пузырек неона или гелия. А криптон и ксенон еще и в наше время редко можно найти в химической лаборатории, несмотря на то что после их открытия прошло уже немало лет. И это понятно: на литр воздуха приходится криптона всего только 1 кубический миллиметр, а ксенона еще того меньше. И добыть их из воздуха очень трудно. Только аргон и неон давно перестали быть редкостью. Их добывают из воздуха на химических заводах. В Москве на заводе «Сжатый газ» есть машина, выпускающая 2 1/2 тысячи литров аргона в час. Скоро станут добывать на заводах и криптон и ксенон. В 1934 году Парижская академия наук напечатала статью французского химика Клода. Клод пишет, что его ассистент Гомонэ построил машину для добывания криптона и ксенона. В свою машину он наливает жидкий воздух. Сквозь этот жидкий воздух насосы гонят струю обыкновенного — газообразного — воздуха. Из этой струи капельками выпадают криптон и ксенон и оседают в жидком воздухе. Чем дольше работает машина, тем богаче криптоном и ксеноном становится жидкость. Машина Гомонэ извлекает из воздуха пол-литра криптона в час. Это не очень много. Но Клод и Гомонэ уже начали строить машину, которая будет добывать каждый час 100 литров криптона и 10 литров ксенона[12]. А для чего нужны эти ленивые газы? Стоит ли их добывать? Стоит. Они нужны электротехникам. Электротехники наполняют ими электрические лампочки. Лампочка накаливания, наполненная аргоном или неоном, горит ярче обыкновенной, дольше служит и расходует меньше энергии. А если ее наполнить криптоном или ксеноном, то она будет еще ярче, еще долговечней. Обыкновенная лампочка, рассчитанная на 110 вольт, мгновенно перегорает, если пустить в нее ток с напряжением 200 вольт. А лампочка, наполненная криптоном, выдерживает такую перегрузку много часов и не портится. Всем, кто бывал в большом городе, случалось видеть электрическую рекламу. В окнах больших магазинов, на вывесках кинематографов горят узоры и надписи, составленные из стеклянных светящихся трубок. Знаете ли вы, что светится в этих трубках? Трубка, горящая синим светом, наполнена разреженным аргоном; трубка, дающая красновато-оранжевый свет, — неоном. Это те самые газы, которые добыл из воздуха профессор Рамзай. Светятся они потому, что через них проходит электрический ток. Вглядитесь в трубку, наполненную неоном, когда она светится. Многие говорят, что этот свет неприятен, что он режет глаза. Но у него есть чудесное свойство: он далеко виден даже в тумане. В лондонском предместье Кройдон стоит маяк для самолетов и дирижаблей. Это железная башня, на которой укреплены шестнадцать стеклянных трубок. Каждая трубка длиной в 6 метров. Все они наполнены неоном. В туманные ночи, когда не видно ни луны, ни звезд, ярко светятся неоновые трубки, указывая дорогу воздушным кораблям. ПОИСКИ ВО ВСЕХ НАПРАВЛЕНИЯХ Солнечный газ гелий был найден трижды: сначала в солнечных выступах, потом в клевеите и наконец — вместе с другими ленивыми газами — в воздухе. Но ученые на этом не остановились. Если ленивые газы растворены в воздухе, то почему бы им не быть растворенными также и в воде? Химики принялись искать ленивые газы и в дождевой воде, и в речной, и в морской, и в ключевой, и в водопроводной. И действительно они их там обнаружили, но в ничтожном количестве: вода содержит еще меньше ленивых газов, чем воздух. Одно только нашлось исключение — минеральная вода. В некоторых минеральных источниках было обнаружено довольно много гелия. Немецкий физик Кайзер нашел гелий в воде одного источника в горах Шварцвальда, Рамзай отыскал гелий в целебном источнике Котрэ в Пиренейских горах, а Рэлей — в водах, бьющих из-под земли в известном английском курорте Бат. Нет такого вещества, в котором химики не искали бы гелия, аргона и других ленивых газов. Они исследовали и вулканическую лаву, и всевозможные руды, и падающие с неба метеориты. Одному химику даже пришла в голову мысль поискать эти газы в растениях и животных. Он растолок горох и подверг исследованию его химический состав, чтобы узнать, нет ли в горохе гелия. Потом он захлороформировал двух мышей, а когда они умерли — высушил их тела в электрической печке, тоже растолок и занялся изучением порошка: нет ли в мышах гелия? Но самый тщательный химический анализ не мог обнаружить в мышах ни гелия, ни аргона[13]. А вот во многих минералах действительно удалось найти гелий. Гелий давно уже был найден в клевеите — почему бы не поискать его и в других минералах? Рамзай и Трэверс принялись за работу. И вскоре гелий был найден в уранините, фергусоните, самарските, колумбите, монаците. Но больше всего гелия оказалось в одном минерале, который добывают на острове Цейлон. Называется этот минерал торианит. Если килограмм торианита раскалить докрасна, то он отдаст около десяти литров гелия. Много минералов изучил Рамзай, ища в них гелий. Из своих наблюдений он вывел странное правило: гелий всегда оказывается в тех минералах, которые содержат металлы уран и торий. Если в состав минерала входит металл уран или металл торий, то в кем наверняка можно рассчитывать найти и гелий. А если в минерале нет ни урана, ни тория, то из него не удастся выжать ни одного пузырька гелия. Долго думал Рамзай о том, что бы это могло означать. Гелий не соединяется ни с ураном, ни с торием: ведь он ленивый газ. Так почему же он всегда встречается там, где встречаются уран и торий? Что общего у него с ними? Но как Рамзай ни старался, как ни ломал себе голову, ему не удалось разрешить эту загадку. Загадку разрешили другие — физик Резерфорд и химик. Содди. НЕВИДИМЫЕ ЛУЧИ Металл уран был известен химикам давно — еще с XVIII века. Химики изучили и чистый уран и разнообразнейшие соединения урана с другими веществами. Но никому из них не приходило в голову, что в уране есть что-то необыкновенное. И в самом деле, на первый взгляд ничего необыкновенного в уране нет. По виду он похож на серебро, по тяжести на платину, а химические свойства у него почти такие же, как у металла вольфрама.
Эрнст Резерфорд Химики были твердо убеждены, что уран — заурядный металл, металл, каких много. Но в марте 1896 года парижский химик Беккерель[14] неожиданно обнаружил, что этот заурядный металл имеет странное свойство: он испускает лучи. Прошло несколько месяцев, и другой химик, Шмидт, заметил, что такие же лучи испускает другой металл — торий. Потом в Париже двое ученых — Пьер Кюри и его жена Мария Кюри — открыли в урановой руде примесь третьего металла, испускающего лучи, — металла радия.
Фредерик Содди А в Канаде, в городе Монреаль, два молодых человека — физик Резерфорд и химик Содди — нашли еще одно вещество, испускающее лучи. На этот раз вещество оказалось не металлом, а газом. В металле радии были обнаружены крохотные пузырьки нового газа, испускающего лучи Резерфорд и Содди собрали пузырьки и изучили их. Оказалось, что это ленивый газ, такой же, как аргон, гелий, неон, криптон, ксенон. Резерфорд и Содди дали новому ленивому газу имя нитон. По-гречески это значит «сияющий»[15].
Рис. 13. Фотография, снятая лучами радия. Фредерик Содди сделал такой опыт: он взял стеклянную трубочку, в которой было немного радия, и фотографическую пластинку, запертую в кассету, в которую не проникает ни один луч света Содди стал водить трубочкой, как карандашом по кассете. Лучи, испускаемые радием, прошли через кассету, и на пластинке отпечатались те самые слова — Radium writing («писание радием»), — которые Содди вывел на кассете своей трубочкой. После этого Содди проявил пластинку, отфиксировал ее и приготовил позитив Уран, торий, радий, нитон — четыре вещества, испускающие лучи. Из них первые два — уран и торий — были известны уже целое столетие. Почему же так долго никто не замечал, что они испускают лучи? Почему это было открыто только в конце XIX века? Да потому, что эти лучи — невидимые. Раскаленный уголь, раскаленное железо, расплавленная платина испускают лучи, которые можно увидеть глазами. А торий, уран, радий, нитон испускают лучи, которые увидеть невозможно. А если так, то каким же образом физики все-таки заметили эти лучи? Лучей урана, тория, нитона, радия не видит человеческий глаз. Но их видит фотографическая пластинка. Пластинка чернеет, когда на нее падают невидимые лучи (рис. 13). Но есть и еще способ заметить их безо всякой фотографической пластинки.
Рис. 14. Справа — прибор Крукса для наблюдения вспышек на сернистом цинке. Слева — схема прибора (А — пылинка радия на кончике иглы, В — сернистый цинк, С — лупа) Существует такое вещества: сернистый цинк. Когда на сернистый цинк падают невидимые лучи, он начинает светиться. Английский физик Крукс, тот самый Крукс, который когда-то телеграфировал Рамзаю, что «криптон — это гелий», захотел узнать, что происходит с сернистым цинком, когда на него падают невидимые лучи. Он взял маленький медный стаканчик (рис. 14). Дно стаканчика он обмазал сернистым цинком. А внутри на высоте нескольких миллиметров над дном, он прикрепил к стенке иголочку. На острие иголочки была насажена крохотная невидимая пылинка радия. Потом он пошел в темную комнату и принялся смотреть на дно стаканчика сквозь увеличительное стекло. Сперва он не видел ничего, но потом, когда его глаза привыкли к темноте, он обнаружил удивительное явление. На дне стаканчика вспыхивали искорки. Вспыхивали и сейчас же угасали. Искорок было много. Они загорались то здесь, то там. Все дно стаканчика было усыпано ими — совсем как уголок ночного неба, густо усыпанный звездами. С одной только разницей. На глазах у астронома звезды не гаснут. Не одна сотня тысячелетий пройдет перед тем, как изменится привычный рисунок созвездий, распадется Большая Медведица, распустится Пояс Ориона. А звездочки, которые видел Крукс, загорались и гасли каждое мгновение. Каждое мгновение распадались одни созвездия и вспыхивали другие. Это светился сернистый цинк, на который падали невидимые лучи, испускаемые радием. Глядя на вспышки, Крукс сделал важный вывод о природе таинственных лучей. Если бы радий испускал свои лучи непрерывно, как солнце испускает свои, то дно стаканчика светилось бы равномерным блеском. Но на поверхности сернистого цинка появлялись только отдельные вспышки, а потом они исчезали, и вместо них появлялись новые. Значит, радий испускает свои лучи не сплошным потоком, а отдельными взрывами, отдельными комочками, отдельными частичками. Лучи, испускаемые радием, — это поток каких-то частиц, которые вылетают из него, как пули из пулемета. И то, что видел Крукс, — это была бомбардировка сернистого цинка таинственными микроскопическими снарядами, которые вылетали из крошечной пылинки радия на кончике иглы[16]. РОЖДЕНИЕ ГЕЛИЯ Известие об опыте Крукса дошло до лаборатории Резерфорда и Содди в далеком Монреале. И это известие неожиданно натолкнуло молодых ученых на решение вопроса, над которым безуспешно бился Рамзай. Резерфорд и Содди сопоставили два факта. Факт № 1: гелий, как установил Рамзай, всегда обнаруживается в минералах вместе с веществами, испускающими невидимые лучи, — с торием и ураном. Факт № 2: невидимые лучи, как установил Крукс, это поток каких-то частиц. Между этими фактами, рассуждали Резерфорд и Содди, должна существовать какая-то связь. Какая же? Резерфорд и Содди решились на смелую догадку: Частицы, вылетающие из урана, тория, радия, нитона, — это частицы гелия. В уране, тории, радии, нитоне непрерывно рождается гелий. Вот почему в минералах, где есть уран и торий, всегда оказывается и гелий. ПРОВЕРКА ОПЫТОМ Высказать догадку — этого мало. Нужно суметь доказать, что она правильна. А для этого есть только одно средство — опыт. Весной 1903 года Фредерик Содди приехал в Англию. В Лондоне он увиделся со знаменитым Рамзаем. Они решили проверить на опыте, верно ли, что частицы, которые наблюдал Крукс, это частицы гелия. Рамзай и Содди наполнили спектроскопическую трубочку нитоном. Через трубочку пустили электрический ток, и нитон засветился голубоватым огнем. Тогда Рамзай и Содди взяли спектроскоп и стали рассматривать спектр. Они увидели три яркие линии: оранжевую, желтую, зеленую. Это были спектральные линии нитона. Никаких других линий в спектре не было видно. Рамзай и Содди оставили нитон в спектроскопической трубочке и ушли. А через два дня они вернулись в лабораторию, снова включили ток и снова рассмотрели спектр запертого в трубочке газа. И что же? Спектральные линии нитона горели на своих местах в оранжевом, желтом и зеленом участке спектра, но они стали гораздо слабее, чем за два дня перед тем. А рядом с ними горели новые линии, которых два дня назад не было. Рамзай и Содди сразу узнали их: это были спектральные линии гелия. Извне гелий не мог попасть в спектроскопическую трубочку. Значит, он возник в самой трубочке, возник из нитона. Прошло еще два дня, и Рамзай и Содди снова пропустили через свою трубочку ток. Трубочка зажглась, и сразу же стало видно, что с запертым газом произошла еще большая перемена. Четыре дня назад трубочка светилась голубоватым огнем. А теперь огонь был желто-белый — точь-в-точь такой, каким светятся трубки, наполненные гелием. Теперь можно было и без спектроскопа увидеть, что в трубочке гелий. А когда Рамзай и Содди все-таки заглянули в спектроскоп, то у них исчезли и последние сомнения. Спектральные линии нитона еще светились в спектре, но так слабо, что были еле видны. А спектральные линии гелия горели ярким блеском. Так на глазах у Рамзая и Содди родился гелий. Рождение гелия из нитона было доказано. СКОЛЬКО ЛЕТ КЛЕВЕИТУ? Нитон превращается в гелий. А как же уран и торий? Ведь химики уже очень давно имели дело с этими металлами, и никто не заметил, что они превращаются в гелий. А если так, то нет ли какой-нибудь ошибки в утверждениях Резерфорда и Содди о том, что гелий рождается не только в нитоне, но и в уране и в тории? Резерфорд и Содди продолжали настаивать: никакой ошибки нет. Разница между ураном и нитоном та, что нитон превращается в гелий быстро — в течение нескольких дней, а уран очень медленно. Потому-то никто до сих пор и не заметил превращения урана в гелий. Содди взял большую колбу, наполнил ее веществами, содержащими уран, и тщательно удалил все газы, которые были растворены в этих веществах. Затем он закрыл колбу — так, чтобы никакие газы не могли проникнуть туда извне. А через год он снова исследовал содержимое колбы и обнаружил, что в ней появился гелий, которого раньше не было. Правда, гелия было очень мало — всего лишь одна десятая часть кубического миллиметра, — но для чувствительного спектроскопа и этого оказалось довольно. Содди явственно увидел желтую спектральную линию гелия. Значит, из урана тоже рождается гелий. В колбе у Содди была тысяча граммов урана. А извлек он из колбы всего только десятую часть кубического миллиметра гелия. Крохотный пузырек гелия — это все, что получилось из килограмма урана за год. Весит этот пузырек всего лишь одну пятидесятимиллионную долю грамма. Вот как медленно превращается уран в гелий: из каждой тонны урана ежегодно образуется всего лишь две сотых миллиграмма гелия! Нет ничего удивительного в том, что химики до Содди не смогли заметить превращения урана в гелий. Содди заметил гелий только потому, что он его искал. Но если уран превращается в гелий так медленно, то почему же в минералах, содержащих уран, находят иногда большое количество гелия? Ответ ясен: потому, что эти минералы лежат в земной коре очень давно — миллионы, а то и сотни миллионов лет. Гелий, найденный Рамзаем в клевеите, это гелий, возникший из урана. А гелий, который извлекают из торианита, это гелий, возникший из тория и из урана (в торианите есть и торий, и уран). Сколько же лет пролежали в земле клевеит, торианит, фергусонит, монацит, прежде чем попали в руки человека? Геологи не могли ответить на этот вопрос. За них ответили физики после того, как узнали тайну рождения гелия. ФИЗИКА УЗНАЕТ ВОЗРАСТ ЗЕМЛИ Английский физик Стретт[17] взял кусок минерала гематита. Минерал был добыт из пластов земной коры, хорошо исследованных геологами. По окаменелым остаткам животных и растений геологи давно изучили эпоху, в которую возникли эти пласты. В Европе тогда было жарко, как теперь в тропиках. Всю Европу покрывали леса, но не такие леса, какие бывают в тропических странах в наше время, а совсем другие.
Рис. 15. Так выглядела Земля в каменноугольную эпоху Вместо лиственных деревьев в них возвышались гигантские хвощи и папоротники (рис. 15). В лесах было множество скорпионов, пауков и всяческих насекомых, но нельзя было бы отыскать ни одной птицы, ни одного млекопитающего. А о человеке и говорить нечего: на всем земном шаре тогда еще не было ни одного человека. Эту далекую эпоху геологи прозвали «каменноугольной ». У них не было сомнений в том, что каменноугольная эпоха была очень давно. Но как давно? Сто тысяч лет тому назад, или миллиард лет тому назад, или триллион лет тому назад? На это геологи не могли дать ответа. Ведь людей в каменноугольную эпоху не было — значит, некому было отмечать время. Столетия и тысячелетия шли, никем не считанные. Как же сосчитать их теперь, когда они уже давно прошли? Стретт сумел их сосчитать. Для него это была простая арифметическая задача. Взяв кусок гематита, выкопанный из пластов, которые возникли в каменноугольную эпоху, он исследовал его состав. Оказалось, что на каждый грамм урана в гематите приходится около двадцати кубических сантиметров гелия. А мы знаем, что в каждом грамме урана рождается в год одна десятимиллионная доля кубического сантиметра гелия. Весь этот гелий полностью должен был остаться в гематите, потому что в гематите нет трещинок и пор, по которым гелий мог бы пробраться наружу. Сколько же нужно было лет, чтобы гелия накопилось двадцать кубических сантиметров, если каждый год накопляется одна десятимиллионная часть кубического сантиметра? Ясно, что двести миллионов лет. Следовательно, каменноугольная эпоха была двести миллионов лет тому назад. Стретт измерил количество гелия не только в гематите, но в разных других минералах, оставшихся от всевозможных геологических эпох. И каждое такое измерение открывало ему новую дату истории Земли. Он вычислил, что юрская эпоха — так называется та эпоха, когда млекопитающих еще не было, а по воздуху летали крылатые ящеры и зубастые птицы, — была сто миллионов лет тому назад, а самая древняя эпоха — архейская, — когда на Земле еще совсем не существовало животных, — была около миллиарда лет тому назад. Миллионы и миллиарды лет гематит, уранинит, клевеит, торианит, фергусонит, монацит копили в себе гелий. Измерив количество гелия, ученые установили хронологию Земли. Минералы, содержащие уран и торий, стали хронометрами, по которым физики и геологи отсчитали не секунды, не минуты и не часы, а тысячелетия и миллионы лет. ГЕЛИЙ НА ВОЙНЕ Осенью 1914 года в северной Франции шли ожесточенные бои. Французы, англичане и бельгийцы медленно отступали под напором германских армий. Однажды на рассвете английские сторожевые самолеты заметили в небе германский цеппелин[18], который плыл прямо на них, очевидно, направляясь к Парижу. О появлении цеппелина летчики немедленно донесли в штаб, и английская зенитная артиллерия встретила неприятельский воздушный корабль зажигательными снарядами. Зажигательные снаряды — это самое верное средство истребления дирижаблей. Как только такой снаряд попадает в оболочку дирижабля, водород, которым наполнена оболочка, мгновенно вспыхивает, и дирижабль сгорает, как солома. Из ста двадцати трех цеппелинов, построенных в Германии во время мировой войны, сорок погибло от зажигательных снарядов. Но на этот раз цеппелин не сгорел. Снаряд пробил прорезиненную ткань оболочки, и раненый дирижабль, медленно истекая газом, поплыл обратно. Англичане недоумевали. Водород — горючий газ, водород воспламеняется от малейшей искры. Что же произошло? Отчего водород не вспыхнул? Военные специалисты долго обсуждали удивительное происшествие, но никто не мог догадаться, в чем дело. Загадка оставалась загадкой. Наконец британское адмиралтейство получило письмо от химика Ричарда Трелфолла, которому удалось найти решение этой головоломки. «Я полагаю, — писал Трелфолл, — что немцы изобрели какой-то способ добывать в большом количестве гелий и на этот раз наполнили оболочку своего цеппелина не водородом, как обычно, а гелием. Гелий очень легкий газ, всего лишь в два раза тяжелее водорода. Значит, дирижабль, наполненный гелием, мало чем уступит в подъемной силе дирижаблю, наполненному водородом[19]. А в других отношениях гелий имеет огромные преимущества перед водородом. Ведь водород охотно присоединяет к себе кислород; потому-то он и воспламеняется так легко. Гелий же не соединяется ни с чем. Невозможно заставить его соединиться с кислородом, — на то он и ленивый газ. Если немецкий цеппелин в самом деле был наполнен гелием, то нет ничего удивительного в том, что зажигательные снаряды не причинили ему большого вреда». Доводы Трелфолла звучали убедительно. Но у всех, кто прочел его письмо, оставалось одно сомнение. Гелий — очень редкий газ, а на цеппелин требуется его не меньше чем пять-шесть тысяч кубических метров. Откуда же немецкие инженеры достали его так много? Может быть, они извлекли гелий из минералов, как когда-то извлек его Рамзай? Но минералы, содержащие гелий, не дешевы. Неужели же немцы раздобыли десятки тысяч тонн монацита или торианита? Да в Германии и нет таких минералов. Монацитовый песок им пришлось бы ввозить из Бразилии, торианит с Цейлона, а время военное. Не нагружать же броненосцы бразильским песком! Правда, существует другой источник гелия: воздух. Воздух, разумеется, есть и в Германии, его не надо привозить из чужих краев. Но зато в воздухе гелия очень мало. Холодильная машина системы Линде может в течение одного часа превратить несколько сот кубических метров воздуха в жидкость. Из этого жидкого воздуха можно извлечь два-три литра гелия. Два-три литра гелия в час, сколько же это составит в год? Не очень много: кубометров двадцать — двадцать пять. Чтобы наполнить небольшой цеппелин, холодильная машина Линде должна была бы работать несколько сот лет без перерыва. Можно, конечно, построить несколько сот холодильных машин и заставить их работать всего только год. Но и это не очень выгодно. Ведь машины дорого стоят; не дешево обойдется и топливо, которое нужно затратить, чтобы приводить в движение насосы, качающие в машину воздух. Добыча гелия для одного цеппелина обошлась бы в огромную сумму денег. Вряд ли во время войны, когда на счету каждая копейка, немцы могли решиться на такой большой расход. Ясно, что немцы добыли гелий как-то иначе. Значит, в природе существуют какие-то другие источники гелия, более богатые, чем воздух и минералы. Что же это за источники? ОПЯТЬ ИЩУТ ГЕЛИЙ Британское адмиралтейство созвало совещание специалистов. Были тут и химики, и физики, и геологи. Долго обсуждали они вопрос о том, какие существуют в природе источники гелия. Наконец кто-то из них вспомнил об одной статье, которую написали в 1907 году американские химики Кэди и Макфарланд. Кэди и Макфарланд произвели химический анализ природных газов, которые были найдены искателями нефти вблизи городка Декстер в штате Канзас. Природными газами называются газы, бьющие из трещин земной коры. Газовые фонтаны — явление довольно обычное в тех местах, где в земле есть нефть. Большей частью это горючие газы: их можно употреблять на освещение и отопление, а можно и добывать из них разные ценные вещества — фенол, бензол, нафталин, антрацен и другие. Кэди и Макфарланд изучили присланный им из Декстера газ. Опыты показали, что полтора процента в нем — гелий. С тех пор и во многих других местах, богатых нефтью, химики не раз находили гелий в бьющих из-под земли природных газах. Долгие годы никому не приходило в голову использовать гелий для практических надобностей, и потому люди не уделяли достаточного внимания газам, содержащим гелий. Но в 1914 году английские химики указали адмиралтейству, что из таких газов извлекать гелий дешевле и проще, чем из монацитовых песков и из воздуха. Быть может, немцы добыли гелий для своего цеппелина не из природных газов, а как-нибудь иначе — установить это с полной достоверностью было нельзя, — но самая мысль о возможности добывать гелий из природных газов заинтересовала английское командование. Адмиралтейство обратилось к химикам и геологам Англии и английских владений — Канады, Австралии, Новой Зеландии — с предложением немедленно приступить к самым тщательным поискам гелия в природных газах. Гелий приобрел неожиданную ценность. За гелием стали охотиться. Наконец канадскому физику Макленнану, исследовавшему различные нефтяные газы в Канаде, посчастливилось найти в них гелий. В 1918 году по поручению британского адмиралтейства он построил небольшой опытный завод вблизи города Гамильтон (Онтарио, Канада) для добычи гелия из при- родных газов. Несколько тысяч кубических метров гелия уже были готовы к отправке в Европу, когда война неожиданно прекратилась и весь этот добытый гелий оказался ненужным. ЛУЧШИЙ ГАЗ ДЛЯ ДИРИЖАБЛЕЙ Только в 1930 году англичане впервые наполнили дирижабль гелием. Это был огромный дирижабль «R-100». Он вылетел из Англии в Канаду наполненный водородом, а вернулся оттуда наполненный гелием. А как обстояло дело с драгоценным газом в других странах? Японцы пробовали было добывать гелий из монацитовых песков в провинциях Секидамеи и Исикава, но скоро оставили эту невыгодную затею. В японском монацитовом песке оказалось очень мало гелия, — так мало, что для наполнения гелием большого современного дирижабля надо было переработать больше миллиона тонн этого песка[20]. Немцы во время войны, как об этом правильно догадался английский химик, в самом деле добывали гелий. Но не из природных газов — газов, богатых гелием, в Германии нет. Чтобы достать гелий, немцы пустились на хитрость: в течение нескольких лет перед войной все немецкие пароходы, возившие товары в Индию и в Бразилию, возвращались оттуда, груженные вместо обычного балласта монацитовым песком. В Германии скопилось 5 тысяч тонн монацитового песка. Из этого песка немецкие химики добыли несколько тысяч кубометров гелия. Кроме того, они нашли гелий в воде минерального источника в курорте Наухейм. Из этого источника немцы ежедневно добывали 70 кубических метров гелия. Это составляет всего 25 тысяч кубометров в год. А на большой дирижабль требовалось не меньше 100 тысяч кубометров. Гелия для военных дирижаблей не хватало. А к концу войны и наухеймский источник иссяк. Единственное в мире государство, обильное природными источниками гелия, это Соединенные Штаты Америки. Но добывать этот гелий для наполнения дирижаблей американцы принялись лишь после того, как вступили в войну с Германией. Еще в 1916 году во всех американских лабораториях, вместе взятых, не было даже и одной десятой части кубического метра гелия. Гелий можно было купить только в самых ничтожных количествах, да и то по баснословной цене: двести тысяч золотых рублей за кубический метр.
Рис. 16. Дирижабль «Шенандоа» Только в 1917 году, после вступления Америки в войну, был построен завод для добычи гелия в городе Форт-Уорс в штате Канзас. Но война очень скоро прекратилась. Американцы, как и англичане, не успели воспользоваться гелием для военных целей. И все-таки они продолжали добывать его. А в сентябре 1923 года им, наконец, удалось накопить несколько десятков тысяч кубометров гелия. Этим гелием американцы наполнили дирижабль «Шенандоа» (рис. 16). Дирижабль «Шенандоа» некоторое время был единственным в мире гелиевым воздушным судном. Но он просуществовал недолго. В сентябре 1925 года, всего лишь через два года после того как его впервые наполнили гелием, дирижабль «Шенандоа» был уничтожен бурей. И вместе с ним погиб весь накопленный гелий. 55 тысяч кубических метров драгоценного газа бесследно растеклись по воздуху. Почти весь запас гелия, добытый к этому временя людьми на всем земном шаре, погиб во время бури, продолжавшейся полчаса. Гибель «Шенандоа» — второго по величине дирижабля в то время — не остановила американцев. Они продолжали строить большие дирижабли, продолжали наполнять их гелием. Завод в Форт-Уорсе был расширен, и вскоре добыча гелия дошла до нескольких десятков тысяч кубометров в месяц. А в 1929 году в штате Техас, в окрестностях городка Амарильо, были найдены новые, бьющие из-под земли природные газы, еще более богатые гелием, чем в Канзасе. И конгресс США постановил устроить в Амарильо второй правительственный гелиевый завод. Химики, геологи, инженеры съехались в Амарильо, чтобы изловить гелий, растекающийся по воздуху, собрать его, не позволить ему пропадать зря. Они проложили в земле газопровод длиной 18 километров и через эту стальную трубу начали выкачивать насосами газовые струи, бьющие из-под земли. Они построили заводские здания и поставили в них сложные аппараты, которые очищали гелий от примесей, сжимали его до давления в полтораста атмосфер и загоняли в прочные стальные баллоны специальных вагонов-цистерн. Через несколько месяцев в огромный воздушный порт Лейкхерст в штате Нью-Джерси стали прибывать транспорты гелия, добытые на Дальнем Западе, в новой «гелиевой столице мира» — Амарильо.
Рис. 17. Дирижабль «Акрона» К высокой причальной мачте лейкхерстского эллинга слетелись воздушные суда. В теле мачты был проложен трубопровод, по которому снизу подавался гелий. Дирижабли жесткой системы, дирижабли мягкой системы, мелкие и крупные, военные и коммерческие, отяжелев после долгого плавания по воздуху, летели к лейкхерстской мачте, чтобы набрать гелия и стать легкими и подвижными, как раньше. Даже «Акрона» (рис. 17) и «Мэкон», самые большие дирижабли в мире[21], вместимостью 185 тысяч кубических метров, не раз вынуждены были восстанавливать свои силы гелием из лейкхерстской мачты. Не наполнять же оболочки гигантских дирижаблей старомодным водородом! Водород ненадежен: он может вспыхнуть от случайного удара молнии. Никакая страховая компания не согласилась бы застраховать такой дирижабль, как «Акрона» или «Мэкон», если бы он был наполнен водородом. Да и пассажиров нельзя было бы уговорить полететь на таком дирижабле. Не очень-то приятно путешествовать, когда над головой висят сотни пудов легко воспламеняющегося газа. Другое дело — гелий. Он безопасен, он не хочет соединяться с кислородом, а потому не взрывается, не горит и даже не тлеет. Есть из-за чего отправлять геологические экспедиции, строить машины для добычи благородного газа![22] СУДЬБА СОЛНЕЧНОГО ВЕЩЕСТВА У гелия была судьба необыкновенная, не похожая на судьбу других веществ. Другие вещества люди находили у себя на планете — в горных породах, в рудах, в минералах, в почве, в воде, и воздухе. Химики очищали добытые вещества от примесей, взвешивали на весах, запирали в свои реторты и колбы. Всякое новое вещество, попавшее к ним в руки, химики тщательно исследовали, чтобы убедиться, в самом ли деле оно отличается от других, прежде известных веществ. И только у гелия была судьба иная. Гелий открыли и начали изучать задолго до того, как химикам удалось залучить его к себе в лабораторию, подержать в руках, подвергнуть опытам. Гелий был открыт не на Земле, а на Солнце. Вряд ли кто-нибудь из пассажиров большого удобного дирижабля, наполненного безопасным газом гелием, помнил имя человека, который когда-то отправился на корабле в далекую Индию и был счастлив, впервые разглядев гелий в трубу спектроскопа на расстоянии 150 миллионов километров от Земли. Этому человеку поверили не сразу. На свете есть много людей, для которых существует только то, что можно потрогать руками, взвесить на весах, оценить в рублях и в копейках. — А может быть, никакого гелия вовсе и нет на свете? — говорили скептики. — Может быть, спектроскоп ошибся, и новое вещество — это только выдумка фантазера-астронома? Прошли годы. Гелий оказался не выдумкой. Великий химик Рамзай нашел его и на Земле — в минерале клевеите и в атмосферном, воздухе. Гелий уже стало возможно держать в руках, испытывать и взвешивать. Кто же открыл гелий и его замечательные свойства? Астрономы Жансен и Локьер, химик Рамзай, физик Крукс или, может быть, Кирхгоф и Бунзен, построившие первый прибор для изучения состава небесных светил? Или, может быть, великий физик Ньютон, впервые разложивший солнечный луч на семь цветов радуги? Или Генри Кавендиш, обнаруживший в азоте таинственный пузырек — еще не разгаданную смесь аргона, неона, криптона и гелия? Да, все они вместе, помогая друг другу, завоевали солнечное вещество. И не они одни. Разве возможно было бы завоевание гелия без инженеров и физиков, которые изобрели машину для превращения воздуха в жидкость? Без геологов, которые научились добывать солнечное вещество из недр земли? И, наконец, без тех многочисленных механиков и оптиков, которые вооружили физику точнейшими измерительными приборами? Открытие гелия — это победа четырех наук: физики, астрономии, химии и геологии. Примечания:1 Напомним, что книга эта впервые вышла в свет в 1936 году. — Примеч. сост. 2 Фраунгофер заметил, что на сплошной полосе солнечного спектра имеются отдельные темные линии, и обозначил их буквами. Желтая линия натрия называется линией D, потому что она расположена как раз в том самом месте, где в солнечном спектре лежит фраунгоферова линия D. — Примеч. сост. 3 Внимательно изучив эту желтую линию, физики обнаружили, что на самом деле она двойная: она состоит из двух очень близко расположенных друг к другу желтых линий. Эти линии получили у физиков особое название: их называют линиями D1 и D2 . 4 Сами названия новым элементам были даны по цветам наиболее ярких линий в их спектрах: rubidus по-латыни означает «темно-красный», caesius — «голубой». — Примеч. сост. 5 Каждое вещество по-своему поглощает лучи разного цвета, и спектр поглощения столь же точно характеризует вещество, как и спектр испускания. — Примеч. сост. 6 При сопоставлении спектра солнечного выступа (протуберанца) со спектрами натрия и водорода отчетливо видно, что красная, зелено-голубая, синяя и фиолетовая линии в спектре солнечного выступа совпадают с линиями водорода. А желтая линия в спектре выступа не совпадает с желтой линией натрия; она лежит правее, ближе к фиолетовому концу спектра. — Примеч. сост. 7 Когда физики говорят о том, сколько весит литр какого-нибудь газа, они подразумевают, что этот газ берется при температуре О" С при нормальном давлении (нормальное — это такое давление, при котором барометр показывает 760 мм рт. ст.). Рэлей наполнял свой шар газом этого давления и этой температуры. 8 В этих рассказах есть доля правды. Многие открытия Кавендиша остались при его жизни неопубликованными. И только через несколько десятилетий после его смерти английский физик Максвелл разыскал его рукописи и напечатал их. В рукописях, изданных Максвеллом, действительно оказалось описание нескольких важных открытий, о которых Кавендиш никому не рассказывал. Из этих открытий самое важное — открытие закона отталкивания и притяжения электрических зарядов; Кавендиш открыл этот закон, но не счел нужным опубликовать его. А через несколько лет, еще при жизни Кавендиша, то же самое открытие сделал французский физик Кулон. Кавендиш даже и тогда не заявил о своем первенстве. Закон взаимодействия электрических зарядов физики с тех пор называют законом Кулона, хотя мы и знаем, что опыты Кавендиша были сделаны раньше, чем опыты Кулона, и были гораздо точнее. Рэлей и Рамзай знали о работах Кавендиша по книге, опубликованной Максвеллом. 9 Чем тяжелее газ, тем медленнее он просачивается через обожженную глину. Этот физический закон открыл английский физик Грэм. Закон Грэма оправдывается и на примере азота с аргоном. 10 Был ли Рамзай первым человеком, увидевшим на Земле вещество, которое испускает линию D3? В 1881 году итальянец Пальмиери напечатал статью, в которой утверждал, что ему удалось наблюдать желтую линию гелия в спектре лавы вулкана Везувия. Поэтому многие думают, что не Рамзай открыл гелий на Земле, а Пальмиери — за четырнадцать лет до Рамзая. Но вернее всего, что Пальмиери попросту ошибся. В наше время химики доказали, что гелия в лаве очень мало — так мало, что Пальмиери не мог наблюдать линию гелия в тех условиях, в которых он работал. Желтая линия, которую он видел, принадлежала, вероятно, натрию. 11 С одним лишь исключением: измерить температуру замерзания и кипения гелия Рамзаю не удалось. Для этого нужно было бы превратить гелий в жидкость и затем узнать, при какой температуре жидкий гелий кипит, а при какой замерзает. Но холод, который создавала построенная Трэверсом машина, был недостаточно силен. Гелий в этой машине не хотел делаться жидким. Превратить гелий в жидкость удалось впервые не Рамзаю, а другому ученому — голландцу Каммерлинг-Оннесу. Произошло это в 1908 году. Для превращения гелия в жидкость понадобилось создать мороз в —269 градусов. 12 Опыты по извлечению больших количеств криптона и ксенона из жидкого воздуха стоили жизни сотруднику Клода — Рибо: во время одного опыта он погиб. Однако работы Клода, Гомонэ, Линде и их сотрудников привели к тому, что в распоряжении ученых оказались большие количества криптона и скоро в Западной Европе вошли в употребление криптоновые лампы. В 1936 году Академии наук СССР еще приходилось обращаться за ксеноном и криптоном в лабораторию Клода, но с 1938 года промышленность СССР сама стала производить эти газы. — Примеч. сост. 13 Эти опыты делал химик Макдональд. Другие химики подтвердили вывод Макдокальда: в животных и растениях нет ленивых газов. Но два немецких химика — Шлезинг и Рихард — сделали другой вывод. Им пришла в голову фантазия — добыть воздух из плавательного пузыря рыб и посмотреть, много ли там аргона и других ленивых газов. Как и следовало ожидать, оказалось, что у всех пород рыб в плавательном пузыре содержится самый обыкновенный воздух: в нем ровно столько же аргона, как и в воздухе, взятом из атмосферы. И только у одной породы рыб — у хищных рыб мурен, которые водятся в Средиземном море, — воздух плавательного пузыря почему-то оказался в полтора раза богаче аргоном, чем обыкновенный воздух. До сих пор никто не знает, почему мурены имеют такую странную особенность. Но может быть, что Шлезинг и Рихард просто ошиблись. Это очень вероятно, потому что их опытов никто не проверял. 14 Антуан Анри Беккерель (отец и дед которого тоже были известными учеными) занимался и химией, но самые знаменитые его открытия относятся к физике. — Примеч. сост. 15 Название «нитон» не удержалось. Чаще называли этот газ другим именем: «эманация радия». А потом ему дали еще и третье имя — «радон». — Примеч. сост. 16 Вспышки, которые наблюдал Крукс, называются сцинтилляциями. И в наши дни это явление помогает изучать процессы микромира. — Примеч. сост. 17 Роберт Стретт — старший сын уже известного нам Джона Уильяма Рэлея — после смерти отца унаследовал его дворянский титул и стал именоваться четвертым бароном Рэлеем (первым был его прадед). — Примеч. сост. 18 Цеппелин, или дирижабль, — летательный аппарат легче воздуха с корпусом, наполненным легким газом. — Примеч. сост. 19 Многие читатели, вероятно, сочтут это рассуждение неправильным. Может ли быть, что подъемная сила гелия всего на несколько процентов меньше подъемной силы водорода? Ведь гелий тяжелее водорода в два раза! Но проделаем математический расчет. Известно, что водород в четырнадцать с половиной раз легче воздуха. Предположим, что мы наполнили оболочку дирижабля водородом такого же давления и такой же температуры, как окружающий воздух. Примем вес этого количества водорода за единицу. Это значит, что тяжесть тянет водород к Земле с силой, равной 1. А окружающий воздух, по закону Архимеда, будет выталкивать тот же самый водород вверх с силой, равной 14 1/2 (весу вытесненного воздуха). Останется в результате подъемная сила 14 1/2 - 1 = 13 1/2. Если же наполнить эту оболочку не водородом, а гелием, то вес его будет равен не 1, а 2. А сила, с которой окружающий воздух стремится вытолкнуть дирижабль вверх, по-прежнему равна 14 1/2. Значит, подъемная сила будет равна 14 1/2 - 2 = 12 1/2, то есть на 1 меньше, чем 13 1/2. А единица составляет всего только 8 % от 13 1/2 Поэтому и подъемная сила гелия как раз на 8 % меньше подъемной силы водорода. 20 Японские профессора химии Танака и Нагаи, отчаявшись в возможности достать для японских дирижаблей гелий, пошли по совершенно другому пути. Они стали думать, нельзя ли прибавить к водороду такую примесь, чтобы он сделался невоспламеняемым. С помощью примесей им действительно удалось сфабриковать несгораемый водород. Но оказалось, что подъемная сила несгораемого водорода на несколько процентов меньше, чем подъемная сила гелия. Поэтому такой несгораемый водород (химики называют его «флегматизованным») мало пригоден для дирижаблей. 21 Оба дирижабля погибли во время бури. Построенная в 1932 году «Акрона» была уничтожена бурей в апреле 1933 года. Построенный в 1933 году «Мэкон» утонул в море в феврале 1935 года. 22 После того как в 30-е годы погибло несколько крупнейших дирижаблей, строительство аэростатических летательных аппаратов (таково их научное название) надолго прекратилось. Однако нынешний уровень техники возродил интерес к дирижаблям. Очень уж велики преимущества этого вида транспорта — почти неограниченная грузоподъемность и вертикальный взлет. В 1987 году в США начались пассажирские полеты дирижабля нового поколения. И несущим газом по-прежнему служит гелий. Помимо воздухоплавания у солнечного вещества за прошедшие десятилетия появились новые, более земные, но не менее интересные применения. Гелий, который так трудно было «заморозить», при низких температурах проявил фантастическое свойство сверхтекучести — течение без всякого трения. С помощью жидкого гелия было открыто родственное сверхсвойство — сверхпроводимость, протекание тока без всякого сопротивления. И все же недаром гелий нашли впервые на Солнце. О главных «неземных» событиях в биографии солнечного вещества см. послесловие «50 лет спустя» на с. 111. — Примеч. сост. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||