|
||||
|
|
ЛЕКЦИЯ № 8. Физико-химический анализ 1. Суть физико-химического анализа Задача физико-химического анализа состоит в установлении зависимости свойств равновесной системы от параметров состояния. Под параметрами состояния обычно понимают: состав, давление, температуру. Зависимости выражаются в виде различных диаграмм «параметр состояния – свойство». На практике большое значение имеет диаграмма «состав – свойство». Анализ именно такой диаграммы позволяет получать сведения о характере взаимодействия компонентов, о давлении и концентрации компонентов, о составе и устойчивости образующихся в системе химических соединений. Совокупность зависимостей всех свойств равновесной системы от параметров состояния позволяет изобразить в виде графика фазовую диаграмму – диаграмму состояния. Чтобы рассмотреть каждую диаграмму состояния систем, пользуются понятиями: фаза, система, степень свободы, компонент, составляющее вещество, термодинамическое равновесие. Раскроем суть этих понятий. Компонент – химически индивидуальные вещества, наименьшего числа которых достаточно для образования всех фаз, т. е. гомогенных частей данной системы. Система – совокупность тел, находящихся во взаимодействии между собой и отделенных от окружающей среды. Различают физическую и химическую системы. Если составные части системы не вступают друг с другом в химические реакции, то такая система называется физической. Если составные части системы реагируют друг с другом, то она называется химической. Составляющее вещество – вещество, которое может быть выделено из системы и существовать вне ее. Степень свободы (вариантность) – число независимых параметров системы, которые можно произвольно менять в некотором интервале без изменения вида и числа фаз системы. Термодинамическое равновесие – состояние, к которому самопроизвольно стремится система. Она находится в состоянии термодинамического равновесия в том случае, когда изменение свободной энергии Гиббса равно нулю. Фаза – гомогенная часть гетерогенной системы, ограниченная поверхностью раздела от других частей. Раскрыв суть важнейших понятий физико-химического анализа, рассмотрим правила и принципы, лежащие в его основе. Правило фаз – число степеней свободы равновесной системы, на которую из внешних факторов влияют только давление и температура, равно числу независимых компонентов системы плюс два минус число фаз, т. е. F = k + 2 – z, где F – число степеней свободы; k – число компонентов; z – число фаз; число 2 – два независимых параметра системы: давление и температура. Применим правило фаз к однокомпонентной системе: F = 1 + 2 – z. Итак, в этой системе максимальное число фаз, одновременно находящихся в равновесии, равно трем. Состояние равновесия однокомпонентной системы определяется ее объемом, температурой, давлением: f(P, T, V ) = 0. Рассмотрим возможные состояния однокомпонентной системы, сведенные в таблицу 5. Таблица 5 Фазовые состояния однокомпонентной системы 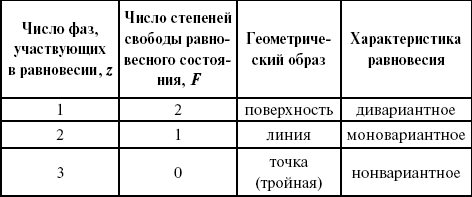 Рассмотрим зависимость между числом фаз и числом степеней свободы в двухкомпонентной системе. F = 2 + 2 – z. Из этого видно, что максимальное число фаз, находящихся одновременно в равновесии, равно четырем. Состояние равновесия двухкомпонентной системы определяется давлением, температурой и концентрацией компонентов. В некоторых случаях возможны и другие состояния (табл. 6). Таблица 6 Фазовые состояния двухкомпонентной системы 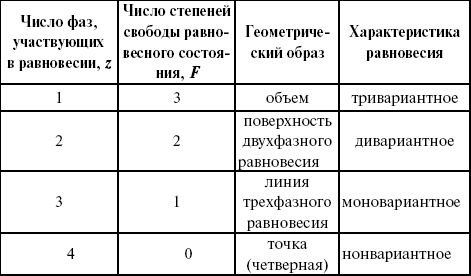 Из этого можно сделать вывод, что в двухкомпонентных системах число независимых переменных достигает пяти: температура, давление, мольный объем, концентрация первого компонента, концентрация второго компонента, т. е. уравнение состояния будет: f(P, T, V, XA, XB) = 0. Из пяти параметров независимы только три, потому что мольный объем является функцией температуры и давления, и при заданной концентрации одного компонента XA концентрация другого будет 1 – XA. Итак, для характеристики двухкомпонентной системы нужны: давление, температура, концентрация одного из компонентов. Изменение состояния системы, при котором давление, температура и состав фаз остаются постоянными, а масса одних фаз увеличивается за счет массы других фаз, носит название фазовой реакции. Фазовое превращение или фазовый переход – переход вещества из одной фазы в другую. Итак, правило фаз Гиббса имеет большое значение в гетерогенных системах, в учении о равновесии, является теоретической основой для физико-химического анализа, который проанализировав его задачи, понятия и принципы заключается в следующем: измеряют любое физическое свойство расплава или раствора (плотность, температуру плавления, давление пара и т. п.) и, изменяя состав, получают числовые данные свойства и сводят в таблицу, а затем строят диаграмму «состав – свойство», анализируют зависимость между геометрическими особенностями диаграммы и природой раствора. Плавное изменение, минимум или максимум на кривых, излом и другое, т. е. любая геометрическая форма кривой и диаграммы в целом, характеризует взаимодействия между компонентами раствора. Эти диаграммы решают задачи об установлении числа, химической природы и границах существования фаз. С помощью метода физико-химического анализа изучают сплавы, минералы и т. п. Огромная заслуга в этом принадлежит И. С. Курнакову, Х. В. Розебому, Г. Г. Тамману и др. 2. Однокомпонентные системы Пример такой системы – диаграмма состояния воды. В такой системе тройную точку О, координаты которой определяют условия сосуществования трех фаз: лед, вода, пар, – можно рассматривать как геометрический образ с нулевым числом измерений. Число степеней свободы этой системы равно нулю. Если изменить хотя бы один из параметров (давление или температуру), то сразу же изменится число сосуществующих фаз. Кривые, описывающие условия равновесия двух фаз (лед – пар, лед – вода, вода – пар), имеют число степеней свободы, равное единице. Можно менять как угодно любой параметр, сохраняя равновесие двух фаз, но величина второго будет строго определенна. Итак, линия двухфазного равновесия – это функция одного параметра, зависящая от другого: P = f(T ) или I = z(P). Тройная точка в этой системе представляет собой нонвариантное равновесие. 3. Физико-химические методы анализа состава сплавов Различают термический и рентгеноструктурный анализ. Физико-химический анализ – область химии, изучающая посредством сочетания физических и геометрических методов превращения, происходящие в равновесных системах. Рентгеноструктурный анализ – метод исследования строения тел, использующий явление дифракции рентгеновских лучей. Дифракция рентгеновских лучей – один из видов рассеяния рентгеновский лучей. Рентгеноструктурный анализ является основным методом определения структуры кристалла. Исследуемый образец помещают на пути рентгеновских лучей и регистрируют дифракционную картину, возникающую в результате взаимодействия лучей с веществом. Задача физико-химического анализа – установить зависимость свойств равновесной системы от параметров состояния (Т, P, состава). Термический анализ позволяет исследовать всевозможные превращения простых и сложных систем по тепловым эффектам. Термический анализ проводится с визуальным наблюдением за температурой появления и исчезновением кристаллов. Наблюдения за исчезновением и появлением кристаллической фазы при нагревании и охлаждении расплава проводят до получения близких по значению температурных данных. Термический анализ применим, если сплав прозрачен. Хронопотенциометрия в некоторых расплавах. Особенность – постоянная скорость подачи титранта в анализируемый расплав и непрерывная запись показателей рН-метра в процессе титрования. О количестве вещества судят по соответствующей длине диаграммной ленты самописца. Применение хронопотенциометрии для физико-химического исследования расплавов Определение коэффициента диффузии в расплавах: 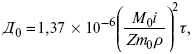 где m0 – концентрация ионов % масс; М0 – молекулярная масса, г/моль; ?– плотность электролита, г/см3. Определение толщины диффузного слоя В условиях принудительного перемешивания у поверхности электрода существует ограниченный диффузный слой. Для определения толщины используется уравнение хронопотенциограммы: 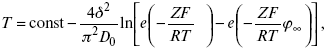 где ??– величина установившегося потенциала при заданном токе. По наклону прямой, выражающей зависимость (1), находят величину 4?2/? 2D0.Отношение D0 / ?определяют из значения установившегося потенциала 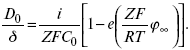 По величинам 4?2/? 2D0и D0 / ?легко найти ?и D0. Определение растворимости Н2, Cl2, O2 в расплаве. Электродные процессы в расплавах с участием Н2, Cl2, O2 привлекают внимание исследователей в связи с развитием электрохимии топливных элементов. Растворимость газообразных веществ в расплавах находят по уравнению Сэнда. Величина произведения i x ?1/2 однозначно связана с величиной растворимости Н2, Cl2, O2 в расплаве, если между газами и компонентами расплава отсутствует какое-либо химическое взаимодействие. В двойной эвтектике CuCN и Cd(CN)2 растворимость Н2 подчиняется закону Генри. Для оценки абсолютного значения растворимости газов необходимо знать величину коэффициента диффузии. Если в исходном расплаве содержатся ионы О2-, то между i x ?1/2 и концентрацией ионов О2- наблюдается линейная зависимость, на основании которой можно судить о содержании О2- . |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||
