|
||||
|
|
ЛЕКЦИЯ № 14. Применение теоретической и прикладной электрохимии 1. Прикладная электрохимия Прикладная электрохимия – часть электрохимии, которая рассматривает электрохимические реакции с точки зрения применения их для практических целей – получения электрической энергии, нанесения металлических покрытий или получения целевых продуктов. По современным прогнозам, электрохимия должна играть важную роль в энергетике будущего. После овладения управляемой термоядерной реакцией возникает проблема разумного использования получаемой энергии, в связи с этим большое значение отводится водородной энергетике. Энергия термоядерных электростанций будет, в основном, расходоваться на разложение Н2О. Получаемый таким путем Н2 может быть использован как экологически чистый теплоноситель для отопления городов, для приведения в движение автомобилей. Электрохимический метод используют для очистки сточных вод с выделением Cu, Zn, Ag и других, процесс электродиализа – для опреснения вод. 2. Электрохимия углерода В настоящее время углерод, благодаря своей слоистой структуре в виде графита, широко используется для синтеза соединения внедрения графита, который, в свою очередь, нашел применение в литиевом источнике тока (аккумуляторе), используется в науке, технике. Наряду с Сгр и его производными, в последние годы ученые и техники занялись разработкой и получением фуллерена (С60, С70). С60 – имеет шарообразную полую структуру, С70 – эллипсообразную. Они построены из гексогональных и пентагональных ячеек. Эти соединения способны поглощать щелочные, редкоземельные металлы, фторопроизводные. Эти вещества исследуются сейчас во всех отраслях науки и техники, оказывают активирующее действие. 3. Биоэлектрохимия Изучает структуру и свойства мембран живых клеток, механизм переноса ионов через мембрану, природу скачка потенциала на мембране живой клетки, механизм передачи потенциала вдоль нервного волокна. Знания механизма работы клеточной мембраны позволят разработать различные приборы, работающие по принципу работы живой клетки. В настоящее время известны различные искусственные органы. Электрические угри – микроэлектростанции со скоростью, большей в 1000 раз (чтобы заменить атомные электростанции), бионика (особенности безошибочных перелетов птиц, сверхчувствительного слухового, зрительного нерва). 4. Стохастические процессы и самоорганизующиеся системы Стохастические процессы и самоорганизующиеся системы являются предметом изучения электрохимической синергетики. Такие процессы имеют место во всех областях: переход от ламинарного к турбулентному процессу, электроосаждение металлов, колебательное явление с пассивацией металла. В основе синергетики лежат законы неравновесной термодинамики, так как колебательные явления обнаруживаются все больше. 5. Исследование явления высокотемпературной сверхпроводимости в оксидах сложного состава В настоящее время наиболее изучены оксиды на основе Cu и Bi, в состав оксидов, помимо Cu, Bi, входят щелочно-земельные металлы – B a, C a, Sr, р.з.м. (редкоземельные) – лантаниды, Ir, известны соединения, содержащие Tl, (Cu, Bi, Tl, Pb) – металлы, способные проявлять переменную валентность. Переход этих металлов из одного валентного состояния в другое в структуре оксидов может привести к тому, что при некоторой критической температуре, близкой к температуре жидкого азота, вещества подобного типа теряют способность сопротивляться пропусканию электрического тока. Электрический ток может мгновенно возрастать в тысячи и десятки тысяч раз. Это явление получено в настоящее время при изготовлении проводов для высоковольтных передач, на транспорте. Широкое практическое использование явления сверхпроводимости затруднено в связи с тем, что эти вещества гигроскопичны и легко теряют свое свойство при поглощении воды. В связи с этим ведутся поиски новых технологий получения этих веществ. Открытие ВТСП послужило началом для развития нового направления низкотемпературной электрохимии – криоэлектрохимии. 6. Моделирование электрохимических процессов Моделирование электрохимических процессов состоит в следующем. На основе системы уравнений, лежащих в основании какого-либо электрохимического металлического исследования, составляется программа для исследуемого электрохимического процесса с учетом предполагаемого механизма этого процесса и лимитирующих стадий. Задаются исходные параметры (i, потенциал, t, c, ?, коэффициент переноса заряда) и с помощью компьютера проводится расчет. 7. Метод гальваностатических кривых В этом методе анализируется зависимость Е, t при заданной i. 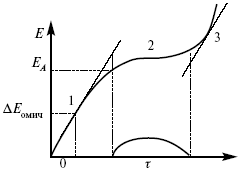 Рис. 15.1, 3 – резкое изменение потенциала, где наступает заряжение ДЭС (изменение заряда поверхности); ?E/?t– угловой коэффициент наклона, по нему можно рассчитать емкость ДЭС. Для этого необходимо кривую записывать с помощью осцилирования, так как заряжение ДЭС происходит в течение тысячных долей секунды. В обычных условиях прибора КСП-4 кривую можно зарегистрировать с точностью до 0,1 с, определяемую по угловому коэффициенту; емкость является поляризационной емкостью (псевдоемкость). Она характеризует количество адсорбированных частиц на электроде, которые вступают в электрохимическую реакцию. Потенциал начала реакции, где первая дуга переходит во вторую – Еa. Участок 2 характеризует время протекания электрохимической реакции. Из точек пересечения касательных опускаем перпендикуляр и находим отрезок, ? – переходное время процесса, i x ? = Q– количество образовавшегося продукта. Можно на основе определения переходного времени процесса при различных плотностях тока анализировать зависимость ? от i. Для замедленной стадии диффузии, лимитирующей скорость суммарного электрохимического процесса, зависимость между переходным временем и плотностью тока: 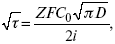 F – число Фарадея; С0 – объемная концентрация ионов в растворе; D – коэффициент диффузии. В случае замедленной диффузии 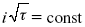 (зависит только от концентрации раствора) по угловому коэффициенту наклона прямой можно рассчитать коэффициент диффузии. 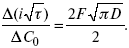 Знание зависимости переходного времени от i позволяет определить const скорости химической стадии и Кр; если электрохимическая реакция лимитируется замедленной предшествующей химической стадией то например: при катодном выделении Н2 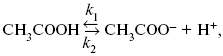 k2 – const молизации, kр = k1/k2. 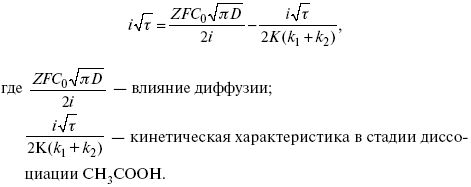 ? в химической стадии будет меньше ?? на величину, определяемую const скорости замедленной химической стадии. 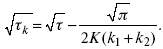 Кроме того, определение переходного времени позволяет графически находить адсорбцию веществ, участвующих в процессе. Количество электричества, определяемое длиной задержки на Е, t кривых, складывается из количества электричества, которое идет на протекание электрохимической реакции и может быть определено через долю ?, связанную с диффузией вещества к поверхности элект-рода и с адсорбцией вещества на электроде i? = i?д+ i?адс. При высоких плотностях тока доля электричества, которое тратится на электрохимическое превращение диффундирующих частиц, > 0. i? ? i?адс, i?адс = Г где Г – величина адсорбции. Существует несколько механизмов протекания электрохимических реакций с участием адсорбированных частиц: 1) сначала в реакцию вступают частицы, адсорбированные на поверхности электрода, а потом те, которые подходят к поверхности за счет диффузии – «сначала адсорбат»; 2) «адсорбат потом» – сначала электрохимическому превращению подвергаются диффузионные частицы, а затем те, которые адсорбируются на поверхности; 3) выполняется в тех случаях, когда поверхностная концентрация реагирующих частиц и их концентрация у поверхности подчиняется уравнению линейной изотермы адсорбции; 4) когда соотношения скоростей восстановления адсорбированных частиц и частиц диффундирующих из объема раствора, их концентрация не зависит от времени: 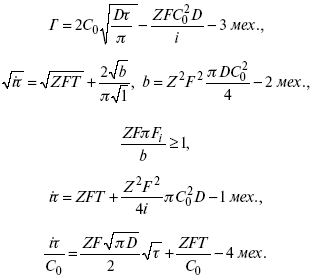  ЛЕКЦИЯ № 15. Третий закон термодинамики Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует какое-то химическое сродство. 1-е предположение – мерой химического сродства была скорость реакции. 2-е предположение – М. Бертло и Х. Томсон высказали, что мерой химического сродства является тепловой эффект. 3-е предположение – max А (Вант-Гофф). Если max А > 0, то химическое сродство между веществами существует, и реакция протекает слева направо. Если Аmax< 0 >, то химического сродства между веществами нет, и реакция протекает справа налево. Если Аmax= 0, то реакция протекает и туда, и обратно. На основе этого создавался третий закон термодинамики; М. Бертло и Х. Томсон, изучая поведение термодинамических систем при низких температурах, в 1906 г. обнаружили, что при низких температурах между веществами существует так называемое химическое сродство, которое они определили как тепловой эффект, ими было установ-лено, что тепловой эффект Qv – Аmax в конденсированных системах при низких температурах, где Аmax – максимальная работа. 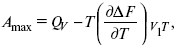 но на самом деле это не max, если исходить из уравнения Гельмгольца. Для того, чтобы работа была max, она должна равняться тепловому эффекту Amax = Qv, надо вычислить: 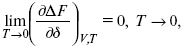 ?F = Qv. Аналитические выражения третьего закона термодинамики: 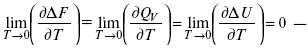 это изохорно-изотермические условия. Если Аmax = QP, ?G, Qp, ?H – функции 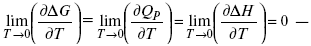 это изобарно-изотермические условия. Тепловая теорема Нернста (третий закон термодинамики)(рис. 16) 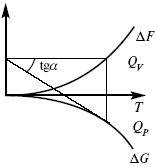 Рис. 16 Энергии (?U, ?H, QV, QP, ?F, ?G), tg?угла наклона прямой – дает температурный коэффициент любой функции. Для реакций, протекающих в конденсированных системах при приближении температуры к абсолютному нулю, кривые max работы и теплового эффекта соединяются и имеют одну большую касательную, параллельную оси температур. Следствия из третьего закона термодинамики: 1. Свойства энтропии вблизи абсолютного нуля – постулат Планка: ?F = ?U – T?S. 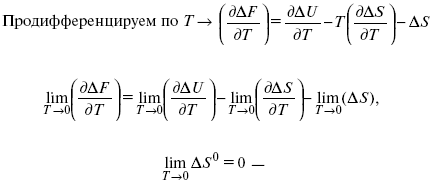 абсолютная энтропия. 2. Теплоемкость Сp, Сv 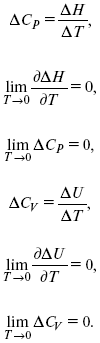 3. Коэффициент термического расширения тела и термического давления. 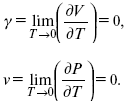 Идеальные газы не подчиняются третьему закону термодинамики, так как газ вблизи абсолютного нуля называется вырожденным. CP – CV ? R вблизи абсолютного нуля – уравнение Майера не работает. 4. О невозможности достижения абсолютного нуля. Третий закон термодинамики – приближенный закон. Используется для совершенного кристалла любого вещества. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||
