|
||||
|
|
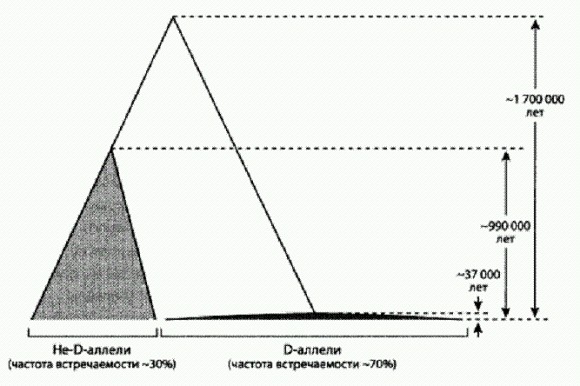
ГЛАВА 4. МЫ И НАШИ ГЕНЫВ прошлой главе мы вступили в тот период человеческой истории, изучение которого сегодня уже не может обойтись без данных генетики. Нам пора немного отдохнуть от камней и костей и совершить экскурсию в мир генов. Мы уже вкратце познакомились с тем, как изучение генетического разнообразия современных людей помогает восстановить популяционную историю и пути древних миграций наших предков. Но это далеко не единственный способ использования генетики в изучении антропогенеза. Не менее важные результаты дает другой подход, основанный на сравнении человеческого генома с геномами наших невымерших родичей — шимпанзе и других нечеловеческих обезьян. Двигаясь этим путем, ученые находят все больше генетических особенностей, отличающих нас от ближайших родственников. К сожалению, функциональное значение большинства выявленных отличий пока не установлено и даже сколько-нибудь обоснованные гипотезы удается выдвинуть лишь в немногих случаях. То и дело мелькающие в средствах массовой информации броские заголовки, сообщающие об обнаружении очередного "ключевого гена, сделавшего нас людьми", явно опережают события. Но ведь они наверняка есть, эти пресловутые "ключевые гены". Хотя этологи и зоопсихологи в последние годы превзошли самих себя в отыскании у других животных особенностей мышления и поведения, считавшихся ранее чисто человеческими (об этом мы поговорим в главе "В поисках душевной грани", кн. 2), кое-какие важные отличия все же имеются. Пусть не качественные, а хотя бы количественные. В конце концов, мы умнее! Наш мозг по объему втрое превосходит мозг шимпанзе, а это что-нибудь да значит. Неудивительно, что генетики, изучающие геном человека, изо всех сил пытаются найти те генетические особенности, которые обусловили увеличение мозга и, возможно, его более эффективную работу. Особые надежды при этом возлагаются на сравнение человеческого генома с геномом шимпанзе. Это позволяет сразу исключить из рассмотрения те примерно 98—99 % генома (в зависимости от способа подсчета), которые идентичны у наших видов. Где-то там, в оставшихся одном или двух процентах (что соответствует 30—60 млн нуклеотидов), зашифрована тайна человеческой уникальности. Осталось понять, где именно и каким образом. Сразу после прочтения генома шимпанзе (это радостное событие произошло в 2005 году) генетики дружными рядами бросились штурмовать "извечную тайну" уникальности человека, и мощь их натиска внушает уважение. Публикации, посвященные выявлению уникальных генетических особенностей Homo sapiens, появляются все чаще, и порой создается впечатление, что еще немного — и что-то очень важное откроется нам. Что же реально удалось узнать о тех изменениях, которые произошли в нашем геноме после того, как 6—7 млн лет назад разошлись эволюционные пути человека и шимпанзе? Изменения белковТе участки генома, которые кодируют белки, изменились на удивление мало. Различия в аминокислотных последовательностях белков у человека и шимпанзе составляют значительно менее 1 %, да и из этих немногочисленных различий большая часть либо не имеет функционального значения, либо это значение остается неизвестным. Лишь в отдельных случаях удалось выдвинуть обоснованные гипотезы о возможной функциональной роли произошедших изменений. Один из самых известных примеров связан с геном FOXP2, получившим (несколько преждевременно) броское прозвище "ген речи". У млекопитающих этот ген крайне консервативен. Например, у мыши белок, кодируемый геном FOXP2 (белок называется FOXP2 — прямым шрифтом, а не курсивом), отличается от обезьяньего аналога всего одной аминокислотной заменой. Столь высокий консерватизм означает, что возникающие в результате мутаций изменения аминокислотной последовательности этого белка почему-то почти всегда оказываются вредными дня млекопитающих и отсеиваются отбором. Однако человеческая версия FOXP2 отличается от шимпанзиного аналога целыми двумя аминокислотными заменами! Определенно, тут произошло что-то важное. При этом известно, что мутации в гене FOXP2 приводят к серьезным нарушениям членораздельной речи. Чтобы нормально разговаривать, человеку необходима нормальная (не испорченная мутацией) версия этого гена. У других животных этот ген, возможно, выполняет сходные функции. Например, недавно было показано, что активность гена FOXP2 у певчих птиц резко снижается во время пения, причем именно в том отделе мозга, который отвечает за пение (Teramitsu, White, 2006). Напрашивается предположение, что замена двух аминокислот в человеческой эволюционной линии была связана с развитием способности к произнесению членораздельных звуков (Подобные высказывания важно понимать правильно. Значит ли это, что наши предки молчали-молчали, а потом появилась мутантная особь с измененным FOXP2 и стала произносить членораздельные звуки, это дало ей репродуктивное преимущество, и мутация стала распространяться в популяции? Вряд ли. Скорее было так. Наши предки, имевшие еще "обезьянью" версию гена, активно использовали звуковую коммуникацию. Им было трудно издавать членораздельные, четко отличающиеся друг от друга разнообразные звуки, но они очень старались. Те особи, которым это удавалось лучше, оставляли в среднем больше потомков — например, потому, что им легче было что-то втолковать своим соплеменникам (неважно, что сами соплеменники говорили хуже — ведь и собаку можно научить различать и по-своему понимать десятки слов). Когда в такой популяции у какой-нибудь особи появлялась мутация, позволяющая говорить четче, она поддерживалась отбором и распространялась. Принятая в социуме культурная традиция — обычай общаться при помощи звуков — делала эти мутации полезными. Внимательные читатели, конечно, догадались, что речь идет об эффекте Болдуина (см. главу "Генетика души", кн. 2)) (Vernes et al., 2006). Но какую именно функцию выполняет FOXP2 в мозге? Вплоть до недавнего времени о нем было известно лишь то, что он является транскрипционным фактором, то есть белком, регулирующим экспрессию (интенсивность работы, уровень активности) каких-то генов. Если бы с высшими приматами можно было проводить генно-инженерные эксперименты, вопрос был бы решен быстро. Пересадили бы шимпанзе человеческий FOXP2 и посмотрели бы, не удастся ли научить генно-модифицированную обезьяну разговаривать (шимпанзе можно научить разговаривать на уровне двух- или даже трехлетнего ребенка, но не голосом, а жестами или специальными значками-символами, см.: Зорина, Смирнова, 2006). А еще пересадили бы человеку шимпанзиный FOXP2 и тоже посмотрели бы, что получится. Но с высшими приматами, слава гуманизму, такие опыты проводить нельзя. Остаются мыши. Вольфганг Энард и его коллеги из Института Макса Планка (Лейпциг, Германия) вывели трансгенных мышей с человеческим геном FOXP2. Трансгенные мыши выросли вполне здоровыми, хотя некоторыми чертами отличались от нормальных мышей. В числе отличий авторы называют удлинение дендритов (входных, принимающих сигналы отростков нейронов) и увеличение синаптической пластичности (Синаптическая пластичность — способность межнейронных контактов (синапсов) менять свою "проводимость". Это базовое свойство нейронных сетей, лежащее в основе памяти и обучения. Мы поговорим об этом подробнее в главе "Душевная механика", кн. 2) в полосатом теле, или стриатуме. Это как раз та часть мозга, работа которой меняется у людей с мутантным геном FOXP2. У мышей также снизилась исследовательская активность и общий уровень дофамина в мозге. Самое забавное, что у них к тому же изменились голосовые сигналы — характерные мышиные ультразвуковые вокализации (Enard et al., 2009). Эти результаты показывают, что изменения гена FOXP2, произошедшие в человеческой эволюционной линии, вероятно, оказали комплексное влияние на работу мозга. В другом недавнем исследовании, выполненном американскими генетиками, многообразие функций FOXP2 было продемонстрировано с еще большей ясностью (Konopka et al., 2009). Работа была основана на множестве биохимических и генетических методов, которые в совокупности позволили выявить различия в составе генов и белков, связанных с экспрессией гена FOXP2 у человека и шимпанзе. Во-первых, трансгенным путем были выведены культуры предшественников нервных клеток человека, у которых вместо человеческого FOXP2 работал шимпанзиный аналог с соответствующими двумя аминокислотными заменами. Далее сравнили экспрессию всех остальных генов в нормальных и трансгенных клетках. Ясно, что разница в экспрессии генов в двух культурах в данном случае должна быть отнесена на счет различий в гене FOXP2 (естественно, исследователи имели в распоряжении несколько трансгенных и контрольных линий для статистики). Выяснилось, что шимпанзиный FOXP2 производится активнее, то есть в клетках его больше, чем человеческого. Кроме того, в культурах с шимпанзиным и человеческим FOXP2 различается активность 116 генов: в человеческом варианте 61 ген демонстрирует повышенную экспрессию, а 55 генов — пониженную. Некоторые из этих генов являются прямыми генами-мишенями FOXP2, то есть FOXP2 связывается непосредственно с регуляторными участками этих генов, чтобы регулировать их активность. Для других FOXP2 является косвенным регулятором, действуя опосредованно через другие гены. Действительно, оказалось, что регуляторные участки некоторых генов из этого массива по-разному (с разной частотой или вероятностью) связывались с человеческим и шимпанзиным FOXP2. В итоге ученым удалось получить схему генно-регуляторной сети, "завязанной" на FOXP2. В схему были включены гены, которые изменяют свою работу в зависимости от модификации FOXP2. Раньше было показано, что гены DLX5 и SYT4 — а они являются важными узлами на этой схеме — регулируют развитие и нормальную работу мозга. Теперь понятно, что эти гены представляют часть сложной регуляторной сети. В ее составе оказались и некоторые гены, мутации в которых вызывают тяжелые наследственные заболевания. К ним относится, например, ген PPP1R1B, дефекты которого приводят к расстройству речи. Также в этой схеме присутствуют гены, для которых, как и для FOXP2, доказано действие положительного (движущего) отбора (Существует ряд признаков, по которым можно определить, что на ген действовал положительный отбор, то есть в нем возникли и были поддержаны отбором какие-то полезные мутации. В случае человеческого гена FOXP2 очевидным признаком является наличие двух несинонимичных (значимых) нуклеотидных замен (которые привели к замене двух аминокислот в молекуле белка FOXP2), при том что у остальных млекопитающих FOXP2 крайне консервативен. О других признаках см. ниже) в человеческой линии. К таким генам относится ген АМТ. Отличия нуклеотидных последовательностей этого гена от обезьяньих аналогов весьма значительны. Можно предположить, что имела место сопряженная ускоренная эволюция части регуляторного каскада, приведшая к важным "человеческим" изменениям в работе мозга. Все эти результаты были получены на культурах зародышевых предшественников нервных клеток, но не сформированных клеток взрослых индивидуумов. Понятно, что во "взрослых" нервных клетках, которые, собственно, работают у человека говорящего, все может быть несколько иначе. Ученые, предвидя это возражение, провели дополнительное исследование. Они оценили экспрессию генов в тканях различных участков мозга у взрослых людей и шимпанзе и сравнили с результатами, полученными для соответствующих клеточных культур (клеточные культуры с геном шимпанзе сравнивали с мозгом взрослого шимпанзе, а культуры с человеческим геном — с человеческим мозгом). Выяснилось, что картина экспрессии генов в культурах клеток практически такая же, как и в тканях взрослого мозга. Сходство оказалось высоким и для человеческих клеток, и для клеток с геном шимпанзе. Эта работа, как и целый ряд других, показала, что различия между человеком и нечеловеческими обезьянами нельзя объяснить только различиями в белок-кодирующих последовательностях. Огромную роль играют изменения в регуляторных участках генов, от которых зависит, какими белками будет регулироваться активность данного гена, в каких тканях и при каких условиях ген будет работать активнее или слабее. Самые важные человеческие признаки, в том числе связанные с работой мозга, формируются за счет изменения регуляции и количественных различий в экспрессии генов. Ген FOXP2 оказался важнейшим регуляторным фактором, влияющим на экспрессию целого комплекса генов, участвующих в развитии и работе мозга. Среди множества отдаленных (опосредованных) эффектов этого гена-регулятора находится и контроль работы мышц, участвующих в формировании речи. Но, несмотря на закрепившуюся репутацию руководителя речи, ген FOXP2 выполняет и другие важные функции в клетках мозга. В результате проведенных исследований сегодня мы можем уверенно утверждать, что человеческий вариант FOXP2 с его двумя значимыми нуклеотидными заменами — один из важных "генов человечности", изменения которого сыграли существенную роль в становлении человека. Крайне интересно, что у неандертальца ген FOXP2, как недавно выяснилось, был точно такой же, как у современного человека. Это можно рассматривать как серьезный аргумент в пользу того, что неандертальцы, а также общие предки неандертальцев и сапиенсов — гейдельбергские люди, носители позднеашельской культуры, — владели речью. Помимо изучения отдельных генов и белков генетики часто используют более глобальный подход, анализируя сразу большие группы генов, объединенных каким-то общим свойством. Например, сравнивают человеческие и шимпанзиные варианты генов, так или иначе связанных с онкологией (это важно, чтобы понять, почему шимпанзе, в отличие от людей, почти не болеют раком). Аналогичным образом сравнивались и гены, связанные с развитием мозга. При этом удалось показать, что у приматов в целом эволюция этих генов идет заметно быстрее, чем, к примеру, у грызунов. Подобные исследования разом выявляют десятки и сотни генетических различий между человеком и его ближайшими родственниками. Особенно "перспективными" считаются те гены, в которых удается обнаружить следы действия положительного (движущего) отбора. Такие следы свидетельствуют о том, что изменения, произошедшие в данном гене, были действительно важны для наших предков, повышали их репродуктивный успех и поддерживались отбором. Одним из надежных признаков действия положительного отбора является повышенная доля значимых нуклеотидных замен по отношению к незначимым, или синонимичным (напомню, что значимые нуклеотидные замены — те, что приводят к замене аминокислоты в кодируемом белке). Еще один признак — пониженный нейтральный полиморфизм в окрестностях того участка ДНК, на который действовал положительный отбор. Это требует объяснений. Представьте для начала, что данный участок ДНК не подвергается действию положительного отбора. Допустим, на него действует отрицательный (очищающий) отбор — отбраковка всех возникающих значимых замен. Тогда в этом участке и рядом с ним будут свободно накапливаться нейтральные, то есть не влияющие на фенотип замены (синонимичные замены — это подмножество нейтральных). В результате в генофонде популяции будет накапливаться нейтральный полиморфизм (разнообразие). Генотипы разных особей будут отличаться друг от друга по нейтральным заменам в окрестностях интересующего нас участка. Теперь предположим, что у одной из особей в этом участке возникла полезная значимая замена. Раз мутация полезная, значит, ее будет поддерживать отбор. Эта особь и те из ее потомков, которые унаследуют эту мутацию, будут размножаться быстрее остальных. В результате полезная мутация начнет распространяться (повышать свою частоту) в генофонде популяции. Фокус тут в том, что вместе с полезной мутацией автоматически будут распространяться и те нейтральные замены, которые находились в ее окрестностях у той особи, у которой полезная мутация впервые возникла. Чем ближе находится нейтральная замена к полезной, поддерживаемой отбором, тем теснее она с ней "сцеплена", пользуясь языком генетиков. В результате одни нейтральные замены — те, которым повезло оказаться рядом с полезной — начнут вытеснять из генофонда все остальные нейтральные замены, встречающиеся в этом участке ДНК. Как следствие, в масштабе популяции нейтральный полиморфизм в этом участке снизится. Заметив в каком-то участке хромосомы пониженный уровень нейтрального полиморфизма, генетик имеет полное право заподозрить, что где-то в этом участке не очень давно возникла полезная мутация, распространившаяся под действием положительного отбора. "Не очень давно" — потому что после того, как положительный отбор прекратит свое действие (например, потому, что полезная мутация уже достигла 100 %-й частоты), в этом участке ДНК снова начнется свободное накопление нейтрального полиморфизма. Через какое-то время признаки действия положительного отбора могут быть полностью стерты. Раскрытие биологического смысла обнаруженных генетических различий между человеком и шимпанзе и следов действия положительного отбора — отдельная, очень сложная задача, как видно из рассмотренного примера с FOXP2. Обычно ее решение откладывается на потом. Когда наступит это "потом", сказать трудно. К сожалению, науке еще далеко до четкого понимания связей между генотипом и фенотипом. Как правило, мы не знаем, как те или иные генетические различия сказываются на развитии и строении взрослого организма, а выяснять это долго, трудно и дорого. Поэтому сейчас многие генетики предпочитают заниматься масштабными "скринингами", во время которых генетические отличия человека от шимпанзе вылавливаются сотнями, но не осмысливаются, а только приблизительно сортируются по степени "перспективности". К числу "особо перспективных" генов, выловленных таким способом, относятся ASPM и microcephalin. В них обнаружены явные следы действия отбора, а их связь с развитием мозга подтверждается тем, что мутации в них приводят к микроцефалии. Показано, что белок ASPM замедляет превращение эмбриональных стволовых нейроэпителиальных клеток в нейроны. Иными словами, клетки — предшественники нейронов в присутствии ASPM успевают поделиться большее число раз, прежде чем превратятся в нейроны, которые уже не могут делиться. Ген microcephalin указывает на древнюю гибридизацию сапиенсов с другими видами людей Как мы помним, люди современного типа (Homo sapiens) появились в Африке не позднее 195 тыс. лет назад. Впоследствии часть их вышла из Африки (о датировке этого исхода мы поговорим в главе "Великое расселение сапиенсов"). Сапиенсы заселили сначала Южную Азию, затем Австралию, Европу и, наконец, Америку. Расселялись они не по безлюдным местам — в Евразии жили представители других человеческих популяций, потомков более древних волн расселения из африканской прародины. Мы уже упоминали об острой дискуссии по поводу того, имела ли место гибридизация между сапиенсами, вышедшими из Африки, и древним евразийским населением. В течение почти 20 лет преобладала точка зрения об отсутствии гибридизации, однако начиная с середины 2000-х годов чаша весов начала склоняться в противоположную сторону. Один из весомых аргументов в пользу того, что наши предки все-таки скрещивались с представителями коренного населения Евразии, получил американский генетик Брюс Лан с коллегами из Чикагского университета. Исследователи в течение ряда лет изучали человеческий ген microcephalin, мутации которого приводят к микроцефалии. Этот ген привлек к себе пристальное внимание, поскольку выяснилось, что он быстро эволюционировал у человеческих предков после того, как они обособились от предков шимпанзе. Сочетание двух этих особенностей (связь с ростом мозга и быстрая эволюция в человеческой линии) сделало ген microcephalin одним из самых популярных объектов у генетиков, занимающихся поиском генетических основ человеческой уникальности. В сентябре 2005 года Лан и его коллеги опубликовали в журнале Science первые результаты своих исследований (Evans et al., 2005). Они показали, что самая распространенная группа близкородственных вариантов (аллелей) гена microcephalin появилась в человеческой популяции всего 37 тыс. лет назад и очень быстро распространилась — очевидно, под действием положительного отбора. Ученые сделали вывод, что эта группа вариантов (которую они назвали группой D от слова derived, "производный") давала какое-то важное преимущество своим носителям, что и обусловило ее быстрое распространение. Сначала ученые предполагали, что группа D появилась в результате мутаций одного из более древних вариантов гена, встречавшихся у сапиенсов. Это видно, в частности, по названию derived. Однако дальнейшие исследования показали, что происхождение D-аллелей было, вероятно, куда более драматическим (Evans et al., 2006). Ученые определили последовательность нуклеотидов большого фрагмента гена microcephalin у 89 человек из разных регионов мира, получив таким образом 178 последовательностей (мы ведь помним, что большинство генов у каждого человека присутствует в виде двух копий, одна из которых получена от матери, другая — от отца). Оказалось, что в этой выборке имеется 86 различающихся аллелей. 124 из 178 последовательностей (70%) относятся к группе D. "Время схождения" всех вариантов, входящих в группу D, составляет около 37000 лет. Иными словами, все эти варианты происходят от одного предкового аллеля, который был частью генома какого-то нашего пращура, жившего 37 тыс. лет назад. Попарное сравнение D-аллелей с другими (не-D-аллелями), а также не-D-аллелей между собой дало удивительные результаты. Между D- и не-D-аллелями обнаружились глубокие различия. Оказалось, что общий предок всех носителей не-D-аллелей жил около миллиона лет назад, а общий предок носителей D- и не-D-аллелей — примерно 1,7 млн лет назад (см. рисунок). Получилась парадоксальная картина: с одной стороны, D-аллели появились и стали быстро распространяться в человеческой популяции лишь 37 тыс. лет назад, с другой, разделение эволюционных линий D- и не-D-аллелей произошло 1,7 млн лет назад. Если бы D-аллели появились в результате мутаций внутри популяции Н. sapiens, следовало бы ожидать, что время разделения D- и не-D-аллелей окажется сопоставимым с временем начала дивергенции (расхождения) D-аллелей (около 37 тыс. лет). При помощи статистических тестов и моделирования авторы показали, что наблюдаемая картина не может быть объяснена на основе гипотезы о единстве предковых популяций — носителей D- и не-D-аллелей. Эти популяции, несомненно, долгое время существовали изолированно друг от друга. По приблизительной оценке, изоляция скорее всего возникла около 1,1 млн лет назад, но не позднее, чем 530 тыс. лет назад. В одной из изолированных популяций закрепились D-аллели, в другой — не-D-аллели, а потом произошло смешение популяций. Теоретически здесь возможны два альтернативных сценария: либо две популяции просто объединились и смешались, либо популяция Homo sapiens 37 тыс. лет назад получила от какой-то другой популяции, с которой ранее не было генетического обмена, полезный аллель D в результате эпизодического скрещивания, и этот аллель благодаря своей полезности быстро распространился. В первом случае в человеческом геноме должно быть множество генов с такой же генеалогией, как у гена microcephalin. Авторы проверили это предположение, проанализировав базы данных по полиморфизму человеческих генов, и пришли к выводу, что ничего подобного не наблюдается.
Реконструированная генеалогия аллелей гена microcephalin. По рисунку из Evans et al., 2006. Таким образом, по мнению авторов, возможно только одно правдоподобное объяснение наблюдаемой картины. Популяция Homo sapiens 37 тыс. лет назад получила D-аллель гена microcephalin в результате скрещивания с представителем какой-то другой популяции гоминид, с которой до этого не было активного обмена генами в течение полумиллиона лет или более. Аллель оказался полезным и быстро распространился. Кто были эти другие гоминиды? Возможно, неандертальцы, с которыми наши прямые предки в то время проживали на одной территории в Европе. Вычисленное авторами время возникновения изоляции между нашими предками и "носителями D-аллелей" (530 тыс. лет или более) примерно совпадает с предполагаемым временем расхождения сапиенсов и неандертальцев. Забегая вперед, скажу, что в прочтенном недавно неандертальском геноме D-аллель не обнаружен (но, может быть, он встречался не у всех, а только у некоторых неандертальцев — ведь и у современных людей он есть не у каждого). Авторы отмечают, что вышедшие из Африки сапиенсы были чужаками в Евразии, заселенной древними представителями рода Homo. Эти последние наверняка были в чем-то лучше приспособлены к местным условиям. Да и по каким-то аспектам умственного развития они тоже могли опережать африканцев. И сапиенсы, скрещиваясь с аборигенами, вполне могли позаимствовать у них кое-какие полезные гены. Авторы предположили, что D-аллель микроцефалинового гена, скорее всего, не единственный случай такого рода. Должны найтись и другие гены, полученные нашими предками от других видов Homo. Это предположение блестяще подтвердилось в результате прочтения полных ядерных геномов неандертальцев и денисовцев, о чем будет сказано ниже. Ходят слухи, что дальнейшее расследование детективной истории с микроцефалиновым геном сейчас приостановлено. Почему? Возможно, в связи с неполиткорректными выводами, которые начали намечаться. Частота встречаемости D-аллелей гена microcephalin у коренного населения разных регионов мира оказалась разной. Иначе и не могло быть, если эти аллели были получены в результате эпизодического скрещивания в период, когда сапиенсы уже активно расселялись по Старому Свету. Максимальная встречаемость отмечена у американских индейцев, минимальная — у некоторых африканских народов, таких как пигмеи (средняя частота по всему человечеству — около 70 %). Если журналисты раздули бы эту историю (вкупе с недоказанным пока предположением, что D-аллели положительно влияют на интеллект), пигмеи могли бы обидеться, а индейцы — возгордиться. Конечно, жаль, что подобные проблемы до сих пор могут притормаживать развитие некоторых научных направлений. Но, возможно, и вправду лучше кое-что отложить до тех пор, пока расизм и национализм не станут для нас такими же давно забытыми, допотопными "ужастиками", как гастрономический каннибализм наших далеких предков. Надеюсь, ждать придется не очень долго. Изменения активности геновЭволюция животных в целом и приматов в частности протекает не столько за счет изменения структуры белок-кодирующих генов, сколько за счет изменения их активности. Небольшое изменение в верхних этажах иерархически организованных генно-регуляторных контуров может приводить к радикальным изменениям в строении организма. При этом количество измененных нуклеотидов в геноме может быть очень небольшим (Колчанов, 2004; Колчанов, Суслов, 2006). Активность генов регулируется множеством способов, но самой универсальной у высших организмов является регуляция при помощи специальных белков — транскрипционных факторов (ТФ). Эти белки находят специфические короткие последовательности нуклеотидов (сайты связывания ТФ), расположенные обычно перед началом регулируемых генов (в так называемой регуляторной области), прикрепляются в этом месте к ДНК и либо подавляют, либо активизируют работу гена. Один и тот же ТФ может регулировать множество генов. Гены, кодирующие ТФ, в свою очередь регулируются другими ТФ, и так далее — в несколько этажей. Понятно, что изменение даже одного-двух нуклеотидов в регуляторной или кодирующей области гена какого-нибудь ТФ высокого уровня может иметь далеко идущие последствия. "Выловить" такие генетические изменения очень трудно, зато легко заметить результат: изменение активности различных генов. Экспрессию генов измеряют при помощи микрочипов — пластинок с нанесенными на них кусочками ДНК — фрагментами изучаемых генов. Из клеток выделяют РНК и наносят на микрочип. Чем активнее работает ген, тем больше синтезируется в клетке молекул РНК с характерной для данного гена последовательностью нуклеотидов (они синтезируются в ходе первичного "прочтения" генов — транскрипции). Если на чипе имеются кусочки ДНК с такой же или очень похожей последовательностью нуклеотидов, молекулы РНК прилипают к ним. По количеству прилипших молекул РНК судят об уровне активности гена. В 2006 году группа молекулярных биологов из США и Австралии сравнила уровень активности генов у человека, шимпанзе, орангутана и макаки-резуса (Gilad et al., 2006). Активность генов измерялась в клетках печени пяти взрослых самцов каждого вида. Специально для этого исследования был разработан "многовидовой" микрочип, который с одинаковым успехом "ловит" РНК всех четырех видов приматов, невзирая на небольшие различия в нуклеотидных последовательностях. Раньше для подобных исследований использовались "человеческие" микрочипы, а к ним РНК других обезьян прилипают чуть хуже, и поэтому активность генов недооценивается. Прежде всего ученые выявили гены, уровень активности которых одинаков у всех четырех видов и к тому же мало варьирует у разных особей в пределах вида. Как и следовало ожидать, среди них оказалось много генов, отвечающих за базовые физиологические процессы, происходящие в клетке (их называют также "генами домашнего хозяйства"), — изменение их активности обычно вредит организму. В данном случае ничего неожиданного не обнаружилось, что лишь подтвердило корректность методики. Ученые выявили также 110 генов, активность которых достоверно различается у человека и шимпанзе (55 генов активнее у людей и ровно столько же — у наших ближайших родственников). Похожие результаты получали ранее и другие исследователи, однако на этот раз благодаря наличию данных по макакам и орангутанам удалось продвинуться значительно дальше — появилась возможность выяснить, какие из выявленных различий (между человеком и шимпанзе) возникли в человеческой, а какие — в шимпанзиной линиях после их разделения 6—7 млн лет назад. Например, если у макак и орангутанов уровень активности данного гена такой же, как у шимпанзе, а у человека он выше, значит, скорее всего, рост активности гена произошел в человеческой линии после ее отделения от линии шимпанзе. Если же у макак и орангутанов активность гена совпадает с человеческой, следовательно, все дело в уменьшении активности этого гена в линии шимпанзе. Так было выявлено 49 генов, активность которых изменилась именно в человеческой линии (30 генов увеличили свою активность, 19 — понизили). Интересно, что среди 30 генов с повышенной активностью оказалось целых девять генов транскрипционных факторов (30 %), тогда как в целом в изучавшейся выборке из 907 генов гены транскрипционных факторов составляют лишь 10 %. Среди генов с пониженной активностью генов транскрипционных факторов вообще не оказалось. По-видимому, это говорит о каких-то существенных переменах в работе генно-регуляторных сетей. Ясно, что эти гены — лишь вершина айсберга, поскольку в печени взрослой обезьяны экспрессируется лишь небольшая часть генов транскрипционных факторов, имеющихся в геноме. Многие транскрипционные факторы включаются ненадолго, лишь в определенные моменты эмбрионального развития, управляя сложнейшим процессом формирования организма. Работа именно этих транскрипционных факторов наверняка и определяет важнейшие отличия человека от других обезьян, но их поиск — дело будущего. Самое интересное, что у шимпанзе все оказалось по-другому. Среди генов, активность которых изменилась в эволюционной линии шимпанзе после ее отделения от человеческой, транскрипционных факторов оказалось всего 9 причем у половины из них активность повысилась, а у половины — понизилась. Между прочим, аналогичные исследования, проведенные на близких видах мух-дрозофил, тоже, как и в случае с шимпанзе, не показали особо сильных изменений в активности транскрипционных факторов. Похоже, усиленная экспрессия многих регуляторных генов — специфическая особенность эволюции именно человеческой линии. В других исследованиях было показано, что особенно сильные изменения активности генов у человека по сравнению с шимпанзе наблюдаются в клетках мозга. Когда таким же способом сравнили шимпанзе с другими приматами, картина получилась иная: активность генов в мозге у разных обезьян различалась не сильнее, чем в других органах. Любопытно, что почти все гены, чья активность в клетках мозга сильно различается у человека и шимпанзе, у человека работают активнее. Что бы это значило? Еще один метод поиска "перспективных" районов человеческого генома основан на выявлении таких участков ДНК, которые у шимпанзе и других животных сходны между собой, а у человека сильно отличаются. Таким способом было выявлено несколько участков генома, в которых у наших предков произошли радикальные изменения уже после того, как разошлись эволюционные линии шимпанзе и человека. Попытки найти в этих 49 участках что-нибудь осмысленное привели к открытию гена HAR1F. Этот ген кодирует не белок, а маленькую регуляторную РНК, которая активно синтезируется в мозге эмбриона как раз в тот период, когда закладывается структура коры больших полушарий (на седьмой — девятнадцатой неделе). Этот ген, как выяснилось, есть не только у всех млекопитающих, но и у птиц. Однако человеческий HAR1F имеет 18 отличий от шимпанзиного, а шимпанзиный от куриного — только два. Почти наверняка HAR1F — важный "ген человечности". Осталось понять, какие гены регулирует эта маленькая регуляторная РНК, как она это делает и зачем. Предки человека заимствовали полезные гены у вирусов Я уже говорил в предисловии, что в геноме человека и других животных присутствует множество так называемых эндогенных ретровирусов (ЭРВ) — встроенных вирусных геномов. Обычные, то есть "дикие", или экзогенные, ретровирусы хранят свой наследственный материал в виде молекул РНК, упакованных в белковую оболочку. Клетка, зараженная ретровирусом, синтезирует вирусные белки на основе инструкций, записанных в вирусной РНК. Один из этих белков — фермент обратная транскриптаза — использует вирусную РНК в качестве матрицы для синтеза ДНК. Затем другой вирусный фермент — интеграза — встраивает эту ДНК в геном хозяйской клетки. В результате вирусный геном становится частью генома клетки и начинает размножаться вместе с ним. Такой встроенный вирусный геном называют "провирусом". Молекулы РНК, "считанные" клеткой с провируса, становятся основой для формирования новых вирусных частиц. До тех пор пока все это происходит в соматических (неполовых) клетках, вирусная инфекция не становится наследственной. Но если ретровирусу удается проникнуть в половые клетки, у него появляется шанс стать неотъемлемой частью хозяйского генома на долгие времена. Такие ретровирусы, встроившиеся когда-то в геном половых клеток и устойчиво передающиеся от родителей к потомкам, и называют эндогенными ретровирусами. В большинстве случаев эти генно-инженерные эксперименты, проводимые вирусами над своими хозяевами, не приносят последним никакой пользы. Если в череде поколений возникает мутация, портящая один из генов ЭРВ, то хозяин от этого либо выигрывает, либо по крайней мере ничего не теряет. Поэтому отбор не отсеивает такие мутации, что приводит к постепенной деградации ЭРВ под грузом мутаций. В результате большинство ЭРВ в геномах животных — это неактивные вирусные геномы, находящиеся на той или иной стадии разрушения. Такие ЭРВ, очевидно, представляют собой бесполезный генетический "мусор". Иногда перед тем, как потерять активность, ЭРВ успевают размножиться внутри генома, то есть встроить множество своих копий (до нескольких сотен) в разные места хозяйских хромосом. Потом в них накапливаются разные мутации, и возникают целые "семейства" похожих друг на друга ЭРВ. В геноме человека большинство ЭРВ — довольно старые, они встроились в геном наших предков свыше 25 млн лет назад, еще до отделения эволюционной линии человекообразных от других обезьян Старого Света. Но есть и молодые ЭРВ, полученные нами уже после разделения линий шимпанзе и человека. Среди человеческих ЭРВ пока не обнаружено ни одного активного. Все они (возможно, за немногими исключениями) уже утратили способность вести себя как настоящие вирусы, то есть заражать другие организмы. По-видимому, они не могут уже и размножаться внутри клетки и встраиваться в другие места того же генома, то есть вести себя как "мобильные генетические элементы". Этим человек отличается от мыши, кошки и свиньи — в геномах этих животных есть молодые ЭРВ, сохранившие в той или иной мере свою вирусную активность. Впрочем, генетики уже умеют искусственно "воскрешать" инактивированные человеческие ЭРВ (см. ниже). Те из читателей, кто знаком с моей предыдущей книгой "Рождение сложности", знают, что фрагменты мобильных генетических элементов в ходе эволюции иногда могут начать выполнять полезные функции в организме хозяина. Это называют "молекулярным одомашниванием". Поддаются ли "одомашниванию" эндогенные ретровирусы? Результаты недавних исследований позволяют ответить на этот вопрос утвердительно. Генетики из Орхусского университета (Дания) показали, что вирусные гены не раз подвергались "одомашниванию", в том числе и в эволюции наших предков (Kjeldbjerg et al., 2008). Ранее было показано, что несколько генов ЭРВ человека, а именно гены белков вирусной оболочки, экспрессируются в клетках некоторых тканей, в том числе в плаценте. В отличие от других фрагментов ЭРВ эти гены не разрушаются под грузом мутаций. Это значит, что они находятся под действием очищающего отбора: мутации портящие эти гены, снижают приспособленность (речь идет, конечно, о приспособленности людей, а не вирусов) и потому отсеиваются отбором. Для трех человеческих генов вирусного происхождения (syncytin 1, syncytin 2, EnvPb1) недавно была экспериментально показана способность инициировать слияние клеток. Белки вирусной оболочки помимо прочего обеспечивают проникновение вируса в клетку. Способность этих белков нарушать целостность клеточных мембран может в некоторых случаях оказаться полезной организму — например, в ходе развития наружного слоя плаценты (синцитиотрофобласта), который образуется путем слияния множества клеток в единое многоядерное целое. Датские генетики обнаружили и изучили еще один яркий случай "одомашнивания" двух вирусных генов, которые изначально кодировали белки вирусной оболочки. Открытие было сделано в ходе целенаправленного поиска неиспорченных вирусных генов в геноме человека. Исследователи нашли два очень похожих друг на друга ретровирусных гена (их назвали ENW1 и ENW2), которые, по всей видимости, находятся в рабочем состоянии. Это типичные гены белков оболочки ретровируса. Каждый из них входит в состав своего ЭРВ, причем все остальные части этих ЭРВ давно выведены из строя многочисленными мутациями и вставками мобильных генетических элементов — транспозонов. Авторы нашли гены ENW1 и ENW2 и в геномах других приматов: у человекообразных (шимпанзе, орангутана), других обезьян Старого Света (макаки-резуса, зеленой мартышки), а также у обезьян Нового Света — мармозетки и беличьей обезьяны, или саймири. Однако у наших более отдаленных родственников — лемуров — этих генов нет. Сопоставив данные по нуклеотидным последовательностям генов ENW1 и ENW2 у разных обезьян, исследователи смогли реконструировать эволюционную историю этих генов. Исходный ретровирус проник в геном наших предков и "прижился" там между 77 и 43 млн лет назад: уже после того, как разделились линии обезьян и лемуров, но до того, как разошлись обезьяны Старого и Нового Света. Новый ЭРВ вскоре подвергся двум последовательным дупликациям, и в результате получилось три одинаковых ЭРВ, расположенных по соседству на одной хромосоме. Все участки этих ЭРВ, кроме генов белков оболочки (ENW1, ENW2 и ENW3), стали постепенно дегенерировать. Ген ENW2 приобрел в результате мутаций какое-то полезное для хозяина свойство и стал бережно сохраняться отбором. Об этом свидетельствует, в частности, резкое преобладание незначимых (синонимичных) нуклеотидных замен над значимыми в этом гене у всех обезьян. Гены ENW1 и ENW3, по-видимому, тоже приобрели полезные функции (возможно, это произошло еще до утроения исходного ЭРВ), но эти гены оказались не столь незаменимыми, как ENW2. Поэтому в некоторых эволюционных линиях обезьян эти гены были либо утрачены, либо выведены мутациями из строя. В частности, общий предок человека и шимпанзе потерял ген ENW3. У их ближайшего родственника орангутана этот ген есть, хотя и в нерабочем состоянии Ген ENW1 у орангутана есть, но не работает; у человека и шимпанзе он в полном порядке. Авторы также выяснили, что между генами ENW1 и ENW2 в разных эволюционных линиях неоднократно происходил обмен участками. В результате ген ENW2 мог передать гену ENW1 свои полезные свойства — полностью или частично. Интересно, что у обоих видов, у которых это удалось проверить, а именно у человека и павиана, гены ENW1 и ENW2 работают в плаценте. Установить экспериментально, какую именно функцию они там выполняют, технически очень сложно, и авторы пока этого не сделали. Но на основе анализа структуры белков, кодируемых этими генами, можно заключить, что возможных функций три: 1. управление слиянием клеток в ходе формирования наружного слоя плаценты — синцитиотрофобласта (об этом способе применения вирусных белков говорилось выше); 2. защита эмбриона от иммунной системы матери (у обоих белков есть участок, обладающий иммуносупрессивным действием — это вполне понятно, если вспомнить, что изначально они входили в состав вирусной оболочки); 3. защита эмбриона от "диких" ретровирусов. У ENW1 и ENW2 сохранились участки, связывающиеся с теми поверхностными белками клетки, к которым прикрепляются ретровирусы, чтобы проникнуть в клетку. Если к такому поверхностному белку уже прицепился белок ENW1 и ENW2, дикий ретровирус не может использовать его для проникновения в клетку. Таким образом, генетические модификации, которым ретровирусы подвергали наших предков, впоследствии иногда оказывались весьма полезными. Новые гены?Активность генов может меняться в ходе эволюции не только путем изменений сайтов связывания ТФ, работы самих ТФ или регуляторных РНК, но и в результате дупликации генов. При прочих равных два одинаковых гена произведут больше продукта (то есть информационной РНК, которая затем "транслируется" в белок), чем один. Дупликация генов, так же как и их потеря, — весьма обычное явление в эволюции. В человеческой эволюционной линии (после ее обособления) произошло как минимум 134 генных дупликации. Удваивались не только гены, но и все то, что находится между ними — всевозможные некодирующие участки ДНК, функция которых в большинстве случаев неизвестна. Иногда происходило удвоение отдельных фрагментов генов. Некоторые гены дуплицируются многократно. Например, ген MGC8902 у человека присутствует в 49 копиях (у шимпанзе десять, у макак четыре). Ген к тому же несет следы действия положительного отбора и активно работает в клетках мозга. Удвоение генов часто становится первым шагом к возникновению принципиально новых генов. Одна из двух копий гена, оказавшись в ином генетическом "контексте" (окружении), может начать по-другому регулироваться, работать в других тканях или на иных этапах развития организма и в конце концов может приобрести новую функцию и структуру. Но это долгий путь. В какой степени он был реализован в эволюции человека, пока неясно, да и определить, в какой момент ген перестает быть просто дубликатом старого гена и начинает быть новым геном, не легче, чем провести грань между нечеловеческими гоминидами и людьми. Новые гены могут возникать и быстрее — путем перетасовки частей имеющихся генов. Один такой случай зарегистрирован у человека. Ген SIGLEC-11 дуплицировался примерно 15 млн лет назад, еще до расхождения линий человека и шимпанзе. Его вторая копия в какой-то момент выключилась, перестала работать, и в ней накопились мутации. У шимпанзе эта отключенная копия так и осталась невостребованной, а у человека ее фрагмент заместил собой часть исходного гена SIGLEC-11. В результате получился почти совсем новый, чисто человеческий ген. Он кодирует рецепторный белок, относящийся к надсемейству иммуноглобулинов и присутствующий на мембранах лимфоцитов и некоторых клеток мозга. По-видимому, он выполняет нейропротекторную функцию — защищает нервные клетки от каких-то токсинов. Рассмотрим один хорошо изученный пример появления нового гена путем дупликации и смены функции. Правда, на этот раз речь пойдет о гене, который появился не в гоминидной линии, а раньше — у общего предка человекообразных обезьян. Этот случай детально исследован бельгийскими и швейцарскими биологами в 2008 году (Rosso et al., 2008). Для начала необходимо напомнить, что существует два основных механизма удвоения генов: "обычная" дупликация фрагментов ДНК и ретродупликация. Последнее означает дупликацию в результате деятельности ферментов — обратных транскриптаз. Гены обратных транскриптаз входят в состав мобильных генетических элементов — ретротранспозонов, которых в геноме любого млекопитающего насчитываются тысячи. Ретротранспозоны размножаются так: сначала клетка осуществляет транскрипцию (прямую, а не обратную) ретротранспозона, то есть синтезирует на матрице ДНК молекулу РНК. Затем эта РНК используется для синтеза закодированного в ней белка — обратной транскриптазы. Последняя в свою очередь может синтезировать на матрице РНК комплементарный ей фрагмент ДНК и встроить его в хозяйскую хромосому (подробнее об этом рассказано в книге "Рождение сложности"). Время от времени обратные транскриптазы переписывают в ДНК хозяина информацию не только со "своих" молекул РНК, создавая новые копии ретротранспозонов, но и с "хозяйских" РНК, создавая тем самым "лишние" копии хозяйских генов. Отличить такие ретродуплицированные гены от обычных можно по отсутствию в них некодирующих вставок — интронов. Дело в том, что после транскрипции интроны из молекулы РНК вырезаются (это называется сплайсингом). В результате получаются "зрелые матричные РНК", которые используются, с одной стороны, клеткой для синтеза белка, с другой — обратными транкриптазами для создания ретрокопий. В зависимости от того, в какой генетический контекст попадет ретрокопия, она может оказаться либо работающей (тогда ее называют ретрогеном), либо, чаще, она работать не будет, и тогда ее называют ретропсевдогеном. В эволюции приматов, в том числе человекообразных, ретрогены появлялись довольно часто. Ген CDC14Bretro появился 18—25 млн лет назад у общих предков человекообразных обезьян (гиббонов, орангутанов, горилл, шимпанзе и людей) в результате ретродупликации. Его "родителем" был очень древний ген CDC14B, первые варианты которого появились еще у одноклеточных. Функция этого гена (точнее, кодируемого им белка) состоит в регуляции некоторых стадий клеточного деления. Ген весьма консервативен, то есть мало меняется в ходе эволюции, что говорит о важности выполняемой им функции. Варианты CDC14B настолько похожи у разных организмов, что если у дрожжей удалить этот жизненно необходимый ген и вместо него вставить человеческий аналог, то дрожжевые клетки совершенно нормально живут и делятся. Как же сложилась судьба ретрокопии этого гена, которая появилась у древних человекообразных? Здесь необходимо еще одно пояснение. Исходный ген CDC14B у приматов подвергается альтернативному сплайсингу, то есть из незрелой матричной РНК, считанной с этого гена, может быть "нарезана" не одна, а несколько — в данном случае четыре — разных зрелых матричных РНК (которые используются затем для синтеза четырех различающихся вариантов белка). Подробнее о явлении альтернативного сплайсинга рассказано в книге "Рождение сложности". Предком CDC14Bretro является один из четырех сплайс-вариантов, который исследователи обозначили как CDC14Bpar {от parent — "родитель"). Остальные варианты получили названия CDC14B1, CDC14B2 и CDC14B3. Затем авторы проверили, в каких тканях производятся соответствующие молекулы РНК. Картина получилась любопытная. Оказалось, что все четыре сплайс-варианта исходного гена CDC14B производятся во всех тканях человеческого организма, однако его ретрокопия CDC14Bretro работает (экспрессируется) только в мозге и семенниках. Особенно интересно, что ретроген активно работает во время раннего эмбрионального развития в переднем мозге эмбриона, в той области, из которой впоследствии развивается кора больших полушарий. Похоже на то, что пока "родительский" ген продолжал заниматься своей старинной работой — регуляцией клеточных делений во всех тканях, — его ретрокопия занялась чем-то более специфическим в мозге и в семенниках. Эта смена тканевой локализации, по-видимому, произошла еще до отделения предков гиббонов от предков остальных человекообразных, то есть вскоре после дупликации, 18—25 млн лет назад. Это подтверждается тем, что у гиббонов, шимпанзе и людей ретроген экспрессируется в одних и тех же тканях — в семенниках и в мозге (горилл и орангутанов пока не проверяли). Интересные результаты дал также анализ изменений нуклеотидной последовательности ретрогена в ходе эволюции. Сопоставив последовательности гена CDC14Bretro разных человекообразных обезьян с эволюционным деревом этой группы, авторы реконструировали "ископаемые" варианты этого гена, которые имелись у вымерших предков, а также установили, какие нуклеотидные замены и в каком количестве произошли в каждой отдельной веточке. Как известно, нуклеотидные замены делятся на синонимичные, не ведущие к изменению структуры кодируемого белка, и несинонимичные, или значимые. Первые находятся вне сферы внимания естественного отбора и могут накапливаться свободно. Вторые влияют на фенотип и поэтому либо отсеиваются отбором (если они вредны), либо, наоборот, распространяются в популяции и в конце концов фиксируются (если они полезны). Поэтому по соотношению синонимичных и значимых замен можно судить о том, находился ли данный ген под действием одного из двух вариантов отбора. Если синонимичных замен много, а значимых мало, то ген находился под действием отрицательного (очищающего) отбора, который отбраковывал большинство значимых замен. Если доля значимых замен повышена, то ген находился под действием положительного отбора, который способствовал фиксации полезных изменений. Так вот, оказалось, что ген CDC14Bretro в ходе эволюции гоминоидов почти всегда находился под действием очищающего отбора, и только однажды он подвергся кратковременному, но сильному действию положительного отбора. Этот период соответствует веточке дерева, которая соединяет общего предка орангутанов и африканских человекообразных обезьян (= горилла + шимпанзе + человек) с общим предком последних. Движущий отбор действовал на данный ген только в промежутке от 14 до 7 млн лет назад и только в одной эволюционной линии, которая соответствует общим предкам африканских человекообразных обезьян (после отделения от этой линии предков орангутанов и до разделения ее на линии, ведущие к горилле и к предку шимпанзе и человека). За этот период в гене зафиксировалось 12 значимых замен и ни одной синонимичной. Большинство значимых замен, зафиксировавшихся у предков африканских человекообразных, расположены в концевых участках гена, от которых зависит, в какие части клетки будет доставляться белок. Поэтому авторы решили проверить, в каких частях клетки работают белки, кодируемые четырьмя сплайс-вариантами CDC14B и ретрогеном CDC14Bretro. Оказалось, что два из четырех сплайс-вариантов скапливаются в клеточном ядре, а два другие, в том числе "предковый" вариант CDC14Bpar, локализуются в цитоплазме и прикрепляются к микротрубочкам — особым внутриклеточным структурам, играющим важную роль в клеточном делении. Белки, кодируемые ретрогеном CDC14Bretro, у гиббона и орангутана ведут себя так же, как их молекулярный предок — сплайс-вариант CDC14Bpar, то есть прикрепляются к микротрубочкам. Однако белки, кодируемые тем же ретрогеном у гориллы, шимпанзе и человека, ведут себя иначе: они игнорируют микротрубочки и вместо этого прикрепляются к мембранам эндоплазматической сети (системы внутриклеточных каналов, служащей для синтеза и транспорта различных веществ). Авторы не поленились изготовить "ископаемые" белки по реконструированным последовательностям генов, которые имелись у (1) общего предка орангутана и африканских человекообразных и (2) общего предка африканских человекообразных. Таким образом, были воссозданы белки, существовавшие до и после периода интенсивного положительного отбора. Эти белки затем внедрили в живые клетки. Оказалось, что первый (более древний) воскрешенный белок липнет к микротрубочкам, как у орангутана и гиббона, а второй — к эндоплазматической сети, как у гориллы, шимпанзе и человека. Дополнительные эксперименты подтвердили, что основной "смысл" тех двенадцати значимых замен, которые зафиксировались в период действия положительного отбора, состоял именно в том, чтобы изменить внутриклеточную локализацию белка — направить его от микротрубочек к эндоплазматической сети. Кроме того, три из этих замен должны были немного изменить свойства активного центра белка — так называемого фосфатазного домена. К сожалению, конкретная биохимическая функция всех этих родственных белков неизвестна, но определенно можно сказать следующее. "Изначальный" вариант белка, кодируемый сплайс-вариантом CDC14Bpar; занимался отрезанием фосфатных групп у какого-то вещества в окрестностях микротрубочек и тем самым управлял клеточным делением. Примерно то же самое поначалу делал и белок, кодируемый вновь образовавшимся ретрогеном CDC14Bretro, но уже не во всех тканях, а только в мозге и семенниках (почему произошло изменение тканевой специфичности, пока неясно). У гиббонов и орангутанов он продолжает этим заниматься до сих пор. Затем 14—7 млн лет назад у предков африканских человекообразных обезьян ретроген попал под действие положительного отбора и быстро накопил 12 значимых замен, которые привели к смене внутриклеточной локализации и функции белка. Теперь белок стал присоединяться к мембранам эндоплазматической сети и отрезать фосфатные группы у какого-то другого вещества (об этом свидетельствует изменение активного центра). Скорее всего, все началось с какой-то одной случайной замены, которая чуть-чуть изменила свойства белка, так что это изменение оказалось полезным и создало "зацепку" для отбора — возникло слабое полезное отклонение в "удачном" направлении. После этого отбор быстро оптимизировал структуру гена для выполнения новой функции, закрепив еще и мутаций. Разобранный пример показывает, как в результате дупликации генов и последующей игры случайности (мутаций) и необходимости (отбора) может возникнуть — а может и не возникнуть! — белок с новыми свойствами и функциями. Гены, которые мы потерялиЭволюция гоминид сопровождалась не только приобретениями, но и потерями. Некоторые гены, которые у шимпанзе и других обезьян нормально работают, у человека выключились, превратились в молчащие псевдогены. В 1999 году Мэйнард Олсон из Вашингтонского Университета (Сиэтл, США) предложил гипотезу, известную под названием less is more ("меньше значит больше"), согласно которой утрата генов может открывать путь для прогрессивных преобразований. Например, выключение гена MYH16, по всей видимости, привело к уменьшению жевательной мускулатуры у предков рода Homo, а это, в свою очередь, стало одной из предпосылок увеличения мозга (известно, что в эволюции млекопитающих две функции головы — жевательная и думательная — находятся в извечном конфликте). Многие гены, выключившиеся у предков человека, связаны с обонянием и иммунитетом (Wang et al., 2006). Обонятельные гены в принципе могли отключиться просто "за ненадобностью". В борьбе за выживание хороший нюх едва ли давал нашим предкам большое преимущество, и естественный отбор не выбраковывал особей со слабым обонянием. Но как естественный отбор мог допустить потерю генов иммунной защиты? Возможно, это объясняется изменением условий жизни наших предков, а также тем, что иммунная система иногда может вредить организму излишней бдительностью. Неумеренная агрессивность иммунной системы порой ведет к опасным "аутоиммунным" заболеваниям, таким как рассеянный склероз. У мышей с искусственно выключенным иммунным геном Mbh реже развивается сепсис, так что отключение этого гена в определенных условиях может повышать выживаемость. Человеческий ген Mbl1, как выяснилось, выключен у 100 % лиц внеафриканского происхождения и у 89 % африканцев. "Испортившая" его мутация возникла, по-видимому, незадолго до выхода сапиенсов из африканской прародины. Носители мутации явно получили какое-то важное преимущество, потому что мутация начала быстро распространяться. Об этом говорит анализ изменчивости прилегающих участков ДНК. Как и следовало ожидать, исходя из гипотезы о положительном отборе, вариабельность этих участков оказалась ниже у лиц с выключенным геном по сравнению с носителями исходного "рабочего" варианта (Это, как уже говорилось, еще один характерный признак действия положительного отбора. Полезная мутация, распространяясь в популяции, "тащит" за собой и прилегающие к ней участки ДНК. Мутация изначально возникает у кого-то одного, поэтому и все копии этих прилегающих участков поначалу одинаковы (пока в них не накопятся нейтральные изменения)). Для остальных отключенных генов доказать прямое действие отбора сложнее: они замолчали раньше, и следы отбора уже стерлись. Но и одного примера достаточно, чтобы показать, что утрата генов могла быть выгодна нашим предкам. Повышенный уровень отключения (псевдогенизации) среди обонятельных и иммунных генов может иметь и иное объяснение. Дело в том, что между обонятельной и иммунной системами существует глубокая и не до конца еще понятая связь. По-видимому, обе эти системы играют важную роль в регуляции социальных отношений и выборе брачных партнеров. Запах партнера может играть решающую роль при возникновении влечения. Компоненты иммунной системы, по-видимому, играют ключевую роль в производстве и восприятии персональных запахов у позвоночных животных (Куликов, Марков, 2009). Возможно, отключение соответствующих генов в ходе эволюции гоминид было связано с растущей ролью разумной, сознательной регуляции общественных отношений, для которой более архаичные механизмы контроля социального и полового поведения могли быть помехой. В частности, снижение остроты обоняния у ранних гоминид могло способствовать становлению нового типа общественных отношений, основанных на моногамии и низком уровне внутригрупповой агрессии (см. главу "Двуногие обезьяны"). Древняя вирусная инфекция сделала людей беззащитными перед ВИЧ Эндогенные ретровирусы представляют собой нечто вроде археологической летописи древних вирусных инфекций, с которыми приходилось когда-то сталкиваться данному виду животных или его предкам. Поразительные факты обнаружили молекулярные биологи из нескольких научных учреждений Сиэтла (США, штат Вашингтон) в ходе изучения эндогенного ретровируса PtERV1 (Pan troglodytes endogenous retrovirus), сотни копий которого присутствуют в геномах шимпанзе и гориллы (Kaiser et al., 2007). В человеческом геноме этого ретровируса нет. При этом, однако, у человека есть защитный антивирусный белок TRIM5a (компонент системы врожденного иммунитета), который эффективно защищает нас от не опасного для человека ретровируса, отдаленно напоминающего PtERV1, — вируса лейкемии мышей N-MLV. Интерес к белку TRIM5a — одному из сотен бойцов противовирусного фронта — связан с тем, что у многих приматов (например, у тех же горилл) этот белок обеспечивает эффективную защиту от ВИЧ, а у человека, к несчастью, он совершенно бессилен против этой смертельной инфекции. Эволюция TRIM5a у приматов протекала очень интенсивно. Этот белок распознает белки оболочки (капсида) ретровируса, прикрепляется к ним и способствует разрушению вирусной частицы. Та часть белка TRIM5a, которая отвечает за узнавание капсидных белков, чаще других попадала под действие отбора и претерпевала быстрые эволюционные изменения (это видно по высокой доле значимых нуклеотидных замен по сравнению с синонимичными). Как минимум один раз это произошло и в человеческой эволюционной линии после ее отделения от линии шимпанзе. Картина, в общем, ясная: время от времени разные виды приматов сталкивались с какой-нибудь новой опасной ретровирусной инфекцией, и в результате отбирались те варианты TRIM5a, которые обеспечивали наиболее эффективную защиту отданного ретровируса. Ученые предположили, что человеческий вариант TRIM5a был адаптирован для борьбы с древним вирусом PtERV1, который 3—4 млн лет назад поразил предков шимпанзе и горилл. Почти наверняка он представлял угрозу и для наших предков австралопитеков ("Почти наверняка" — потому что шимпанзе ближе к австралопитекам, чем к гориллам). Возраст вируса (3—4 млн лет) был установлен по числу различий, накопившихся между разными копиями PtERV1, сохранившимися в геномах шимпанзе и горилл. Сопоставление этих копий также позволило реконструировать исходную нуклеотидную последовательность вирусного генома, а заодно и доказать, что все копии действительно происходят от единого общего предка, которым когда-то заразились гориллы и шимпанзе. После этого ученые частично воскресили ископаемый вирус. За основу был взят вирус мышиной лейкемии, часть генома которого была заменена реконструированными последовательностями PtERV1. В частности, заменили ген, кодирующий капсидный белок — тот самый, который распознается защитным белком TRIM5a. Получившийся химерный вирус оказался вполне жизнеспособным (в дальнейшем будем называть его просто вирусом PtERV1, поскольку те части его генома, которые остались от вируса мышиной лейкемии, в контексте данного исследования ни на что не влияют). Ученые проверяли инфекционность вирусов и эффективность защитных белков на лабораторной культуре почечных фибробластов кошки. Эти клетки не имеют никаких средств защиты от известных ретровирусов. В них, однако, можно внедрять чужеродные гены(например, ген человеческого белка TRIM5a), и тогда клетки могут приобрести устойчивость к тем или иным вирусным инфекциям.
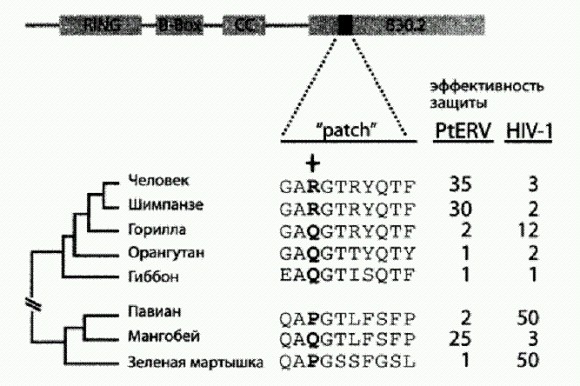
Эффективность белка TRIM5a против вирусов PtERV1 и ВИЧ (HIV-1). Вверху — схема строения белка TRIM5a, показаны основные функциональные блоки (домены). Домен В30.2 служит для узнавания капсидных белков ретровирусов. Показан ключевой участок этого домена (patch), включающий десять аминокислот. Звездочкой отмечена аминокислота, стоящая в 332-й позиции. Внизу слева — эволюционное дерево исследованных видов приматов. Две колонки цифр справа отражают эффективность защиты клеток белком TRIM5a от вирусов. Каждое число показывает, во сколько раз меньше клеток заражает вирус, если клетки производят белок TRIM5а По рисунку из Kaiser et al., 2007. Оказалось, что человеческий TRIM5a весьма эффективно защищает клетки от вируса PtERV1. Вирус заразил 4,1% контрольных "беззащитных" клеток и только 0,03% клеток,вырабатывающих человеческий TRIM5a. Таким образом, люди обладают мощным врожденным иммунитетом к доисторическому вирусу, которого давно нет в природе. Затем исследователи решили выяснить, какие изменения в белке TRIM5a обеспечили его эффективность по отношению к PtERV1. Ранее было установлено, что важную роль в распознавании белком TRIM5a тех или иных вирусов играет маленький участок белковой молекулы длиной в десять аминокислот, с 330-й по 339-ю позицию. Внимание исследователей привлекла позиция 332. У предков человекообразных здесь стояла аминокислота глутамин (Q). Это предковое состояние сохранилось у гиббонов, орангутанов и горилл, а у человека и шимпанзе глутамин заменился аргинином (R). Исследователи модифицировали человеческий белок TRIM5a, заменив аргинин в 332-й позиции "предковым" глутамином. Результат превзошел все ожидания: модифицированный белок стал в 30 раз хуже защищать клетки от ископаемого вируса PtERV1, но зато приобрел способность защищать их от ВИЧ! Это навело ученых на мысль, что, возможно, белок TRIM5a так устроен, что может эффективно распознавать только один из двух типов ретровирусов: если он в ходе эволюции "настроился" на PtERV1, то не может распознать ВИЧ, и наоборот. Для проверки этого предположения они экспериментально определили эффективность белков TRIM5a разных видов приматов в отношении обоих вирусов. Предположение полностью подтвердилось. Белок TRIM5a человека, шимпанзе и мангобея (Cercocebus atys) эффективен против PtERV1, но бессилен против ВИЧ. У гориллы, павиана (Papio anubis) и зеленой мартышки (Cercopithecus aethiops) тот же белок хорошо защищает от ВИЧ, но неэффективен против PtERV1. Это показывает, что белок TRIM5a, по видимому, не может быть одновременно "настроен" на оба типа вирусов. Судя по всему, 3—4 млн лет назад среди африканских человекообразных — предков нынешних горилл, шимпанзе и людей — разразилась эпидемия опасного заболевания, вызываемого вирусом PtERV1. Это способствовало отбору таких мутаций в гене белка TRIM5a, которые повышали устойчивость к инфекции. В частности, у австралопитеков — предков людей и пока не найденных палеонтологами предков шимпанзе — глутамин в 332-й позиции заменился аргинином. Гориллы справились с напастью как-то иначе (не следует забывать, что белок TRIM5a — это лишь один из множества барьеров, стоящих на пути вирусных инфекций). Конечно, возможны и другие варианты объяснения обнаруженных фактов, но этот представляется наиболее вероятным. Почему у шимпанзе и горилл вирус сумел проникнуть в геном половых клеток, а у человека нет — неизвестно но это вполне может быть просто случайностью. Сегодня, когда вируса PtERV1 больше не существует, зато человечеству угрожает эпидемия ВИЧ, вектор отбора должен был измениться. Теоретически, если бы ВИЧ продолжал косить людей, скажем, еще несколько тысячелетий, злосчастный аргинин снова в результате мутаций и отбора заменился бы глутамином и другие полезные мутации генов врожденного иммунитета тоже могли бы закрепиться. Впрочем, будем надеяться, что медицина, вооруженная современными генетическими методами, справится с бедой быстрее, чем это сделала бы эволюция. |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||