|
||||
|
|
ГЛАВА 9. НА ПОДСТУПАХ К НЕВЕДОМОМУУ некоторых читателей при чтении предыдущих глав могло сложиться обманчивое впечатление, что в биологии осталось не так уж много нерешенных проблем. Эта глава написана специально для тех, кто так подумал. На самом деле в сегодняшней биологии нерешенных загадок и тайн, пожалуй, больше, чем когда-либо в прошлом. Это вовсе не значит, что биология удаляется от истины, а ученые все больше запутываются в неразрешимых противоречиях. Тенденция как раз противоположная: большинство возникающих вопросов успешно и довольно быстро разрешается, но каждый полученный ответ порождает новые вопросы. Хорошую аллегорию для этой ситуации придумали еще древние греки — первооткрыватели научного метода познания. Если представить себе область известного как некую замкнутую геометрическую фигуру, допустим, шар, а область неведомого — как все, что находится за пределами этой фигуры, то становится ясно, почему с ростом наших знаний появляется все больше новых вопросов. Чем больше объем шара, читай — количество знаний, тем больше площадь его соприкосновения с неведомым. Эта площадь символизирует количество вопросов, которые уже осознаны человечеством, но еще не получили ответа. Впрочем, эта геометрическая аллегория исходит из допущения, что неведомое бесконечно. В природе это вряд ли так. В конце концов, земная жизнь (а на большее биологи пока не замахиваются) имеет вполне конечную размерность. Время существования, биомасса, численность, занимаемый объем, даже количество атомов, когда-либо побывавших в составе живых существ, — все эти величины далеко не бесконечны, а в масштабах Вселенной даже и не очень велики. И, разумеется, большинство характеристик живых объектов многократно повторяется: от клетки к клетке, от организма к организму, от сообщества к сообществу, поэтому вовсе не обязательно в деталях изучать каждый из этих объектов. "Область неведомого" в биологии не бесконечна, у нее есть границы, но только мы пока не знаем, где они проходят и когда мы до них наконец доберемся. В этой главе мы поговорим о некоторых интригующих научных проблемах, находящихся в разных стадиях разрешения. В одних случаях это нечто совсем непонятное, только начинающее приоткрываться. В других, может быть, нам осталось сделать лишь одно последнее усилие, чтобы головоломка наконец сложилась. Таких "историй с ненаписанным концом" в современной биологии очень много, и нужно помнить, что описанные здесь случаи — лишь капля в море. О сложном и непонятном трудно рассказать понятно и просто. Я уже упоминал в предисловии о том, что современная биология — сложная наука и поэтому для того, чтобы высказывать компетентные суждения по биологическим вопросам, требуются не меньшие профессиональная подготовка и уровень образования, чем, к примеру, в квантовой физике. Очень жаль, что наши доморощенные креационисты этого не понимают. Проблемы, о которых пойдет речь в этой главе, служат хорошей иллюстрацией к сказанному. ПарамутацииКак мы знаем из предыдущих глав, далеко не вся наследственная информация, передающаяся из поколения в поколение, записана в последовательности нуклеотидов в молекулах ДНК. Кроме этой генетической информации есть еще и так называемая эпигенетическая (см. главу "Наследуются ли приобретенные признаки?"). Например, определенные нуклеотиды в ДНК могут подвергаться химической модификации — метилированию. В ходе репликации молекул ДНК специальные ферменты не всегда, но часто метилируют в новой молекуле ДНК те же нуклеотиды, которые были метилированы в родительской молекуле. Таким образом, "рисунок метилирования" может передаваться по наследству, а от него зависят активность генов и, соответственно, фенотипические признаки. Внегенетическая наследственная информация может передаваться и с другими молекулами, например, РНК, которые имеются в цитоплазме половых клеток (см., например, раздел "Контролируемая перестройка генома у инфузорий" в главе "Управляемые мутации"). Эпигенетическая наследственность порой приводит к нарушениям основополагающих законов классической генетики. Многие эпигенетические механизмы в общих чертах уже расшифрованы, но некоторые оказались на редкость неподатливыми. Типичным примером являются так называемые парамутации, обнаруженные полвека назад у кукурузы. Несмотря на упорные усилия, природу этого явления до сих пор так и не удалось разгадать. Парамутация — это устойчивое, наследуемое изменение свойств гена, которое возникает в результате взаимодействия разных вариантов (аллелей) этого гена между собой и при котором в отличие от обычных мутаций нуклеотидная последовательность гена не меняется. Результаты парамутации выглядят очень странно. Свойства организма у парамутантных особей не соответствуют тому, что "записано" в их генотипе. Допустим, вы унаследовали от обоих родителей гены голубых глаз, а глаза у вас при этом почему-то карие, как у одного из дедушек. Но у дедушки-то имеется "ген кареглазости", а у вас его нет! Впрочем, у людей парамутации пока не обнаружены. С парамутациями можно было еще как-то мириться, пока дело касалось только растений. Однако в 2006 году парамутации были обнаружены у животных, а именно у мышей. Это стало одной из самых громких сенсаций последних лет в области генетики. Честь открытия принадлежит французским ученым из Университета Ниццы (Minoo Rassoulzadegan et al. RNA-mediated non-mendelian inheritance of an epigenetic change in the mouse // Nature. 2006. V. 441. P. 469-474.), которые работали с линией лабораторных мышей, несущих мутацию в гене Kit. Этот ген кодирует многофункциональный белок, влияющий, помимо прочего, на образование темного пигмента меланина. В свое время генетики, изучавшие работу этого гена у мышей, искусственно создали неработающий мутантный вариант гена. У мышей, гетерозиготных по этой мутации, то есть имеющих одну нормальную копию гена и одну измененную, Kit+/- , лапки и кончик хвоста остаются белыми. Гомозиготы по этому гену — обладатели двух испорченных копий гена, Kit-/-, — умирают вскоре после рождения. Скрещивая между собой гетерозигот Kit+/-, французские генетики столкнулись с нарушением законов генетики. Согласно этим законам, четверть потомства должна была сразу погибать, получив два варианта испорченного гена Kit-/-, половина — иметь белые лапы и хвост, это генотип Kit+/-, и четверть — иметь нормальную темную окраску, это генотип Kit+/+. Вместо этого из 57 выживших мышат, полученных от восьми скрещиваний, только три оказались нормально окрашенными, а остальные 54 имели белые лапы и хвост. Генетический анализ показал, что половина белохвостых мышат имеет генотип Kit+/+,то есть у них попросту нет мутантного варианта "гена белохвостости". Эти мыши обязаны были иметь нормальную окраску! А получалось, что мыши унаследовали от родителей некий врожденный признак, не унаследовав генов, ответственных за формирование этого признака. Если скрестить этих аномальных мышей — белохвостых, но не имеющих "гена белохвостости" — друг с другом, то потомство их тоже оказывается белохвостым. Правда, в последующих поколениях признак проявляется все слабее и в конце концов сходит на нет. Признаки организма наконец приходят в соответствие с генотипом. Дальнейшие опыты показали, что если хотя бы один из родителей мышонка (неважно, отец или мать) — белохвостый, то и мышонок с большой вероятностью будет белохвостым независимо от того, есть ли "ген белохвостости" у него самого. Стало очевидно, что носителем наследственной информации в данном случае является не последовательность нуклеотидов в молекуле ДНК, а что-то другое. Естественно, подозрение пало в первую очередь на РНК — второй класс "информационных" молекул клетки. Ученые предположили, что белохвостость мышонка с генотипом Kit+/+ может быть вызвана тем, что в оплодотворенную яйцеклетку, из которой он развился, попала родительская РНК, считанная с мутантной копии гена Kit. Хотя у самого мышонка обе копии гена Kit нормальные, присутствие "мутантной" РНК может как-то повлиять на их работу. Это предположение подтвердилось. Исследователи обнаружили, что у гетерозигот Kit+/- с мутантной копии гена Kit считывается "мутантная" РНК, которая в дальнейшем распадается на фрагменты разной величины. Если выделить эти фрагменты и ввести их в оплодотворенную яйцеклетку, полученную от диких серохвостых родителей, из яйцеклетки развивается белохвостый мышонок, не имеющий "гена белохвостости". По-видимому, эти фрагменты РНК не только регулируют прочтение гена Kit, но и каким-то образом самовоспроизводятся, иначе они не могли бы передаваться в ряду поколений. Однако механизм самовоспроизведения этих РНК у мышей разгадать пока не удалось. Ученые также обнаружили, что в сперматозоидах белохвостых мышей Kit+/- резко повышено содержание РНК по сравнению с нормальными сперматозоидами. Это свидетельствует об активной работе ряда генов, в том числе и гена Kit. В норме в сперматозоидах большинство генов "молчит" и РНК почти не образуется. Что бы это значило? Ответа пока нет.
Живые организмы — не компьютеры. Работа французских генетиков, обнаруживших роль РНК в наследовании морфологических признаков у мышей, наряду с другими недавними открытиями показывает, что классические представления о природе "наследственной информации" и механизмах ее "прочтения" слишком упрощены. В действительности все гораздо сложнее. Приходится признать, что аналогии между живыми организмами и искусственными информационными системами, например компьютерами, вошедшие в моду в конце XX века, в значительной степени неправомочны. В отличие от компьютера в живых системах так называемая "информация", ее носители, а также "устройства" для ее прочтения и реализации оказываются слиты воедино и практически неразделимы. Например, РНК оказывается не только "результатом прочтения" генетического кода и средством передачи информации от ДНК к системе синтеза белка, но и активным участником и регулятором самого процесса "прочтения", способным менять смысл читаемых "сообщений" (см., например, раздел "Наследие РНК-мира" в главе "Происхождение жизни"). Представьте себе текст, умеющий сам себя редактировать, или жесткий диск, который в зависимости от записанных на нем байтов информации приобретает разные физические свойства и активно вмешивается в работу считывающего устройства — например, заставляет пропустить или повторно прочесть некоторые участки. Или, как в случае с парамутациями, представьте себе, что вы хотите перенести информацию с одного компьютера на другой при помощи дискеты, однако ваша дискета помнит, в каких компьютерах побывала раньше и какие файлы ей там встречались, и на основе этих знаний она начинает по собственному произволу редактировать записанный на ней текст. В итоге до компьютера-"реципиента" вы донесете не то, что скопировали, а нечто совсем иное. Не случайно некоторые ведущие теоретики в настоящее время ставят под сомнение саму применимость понятия "информация" к последовательностям нуклеотидов ДНК и РНК. Более того, совершенно ясно, что передача информации от родителей к потомкам при помощи РНК является, возможно, необходимым, но явно не достаточным условием парамутации. Это хорошо видно из результатов исследования парамутаций у кукурузы — растения, у которого данный феномен активно изучается уже полвека. Классический пример парамутации у кукурузы дает ген pl1, от которого зависит окраска пыльников, то есть той части тычинки, в которой образуется пыльца. Этот ген при одной и той же последовательности нуклеотидов может находиться в одном из двух состояний: "активном" (в этом случае пыльники получаются пурпурные) и "неактивном" (светлые пыльники). Фокус состоит в том, что неактивное состояние гена является как бы "заразным", то есть активный ген Pl1, побывав в одной клетке со своим неактивным "собратом", сам становится неактивным. Согласно законам генетики при скрещивании двух гетерозиготных растений (то есть таких, у которых одна копия гена активна, а вторая нет) четверть потомков должна иметь пурпурные пыльники. Однако этого не происходит, у всех потомков пыльники оказываются светлыми, и в последующих поколениях пурпурная окраска пыльников тоже не появляется. Это происходит потому, что активный ген, побывав в гетерозиготном состоянии с неактивным, меняет свои свойства и переходит в неактивное состояние. В таком неактивном виде он затем передается по наследству. Это и есть парамутация. Мы уже знаем, что большую роль в поддержании "переключенного" состояния гена при парамутации играют молекулы РНК, передающиеся от родителей к потомкам. Кроме того, в опытах с кукурузой недавно удалось показать, что для устойчивой передачи парамутации из поколения в поколение необходим фермент, размножающий молекулы РНК (РНК-зависимая РНК-полимераза, см. главу "Происхождение жизни"). И еще было установлено, что многие другие гены тоже участвуют в поддержании устойчивости парамутантного состояния, но в чем конкретно состоит функция этих генов, никто до недавнего времени не знал. В отличие от "настоящей" мутации парамутация у кукурузы может сравнительно легко ревертироваться, то есть вернуться в исходное состояние. Например, неактивная версия гена pl1 может превратиться обратно в активную, если произойдут определенные мутации (настоящие, а не "пара-") в других генах. У кукурузы удалось выявить 10 генов, мутации в которых могут приводить к возвращению неактивного гена pl1 в активное состояние. Это значит, что нормальная работа этих генов необходима для поддержания парамутантного состояния. Чтобы понять механизм парамутации, очень важно выяснить, что это за гены и что они кодируют. До недавнего времени была известна функция только одного из них — было показано, что он кодирует РНК-зависимую РНК-полимеразу (см. выше). В 2007 году американские генетики предприняли очередную попытку разгадать тайну парамутаций у кукурузы. И ответ, казалось, был уже почти у них в руках. Еще бы одно маленькое усилие, и... В общем, история получилась вполне детективная (Christopher J. Hale, Jennifer L. Stonaker, Stephen M. Gross, Jay B. Hollick. A Novel Snf2 Protein Maintains trans-Generational Regulatory States Established by Paramutation in Maize // PLoS Biology. 2007.5(10): e275). Исследователи сосредоточили свое внимание на одном из вышеупомянутых десяти генов, необходимых для парамутации. Этот ген называется rmr1, и до сих пор никто понятия не имел, как он работает и что кодирует. Оказалось, что он кодирует не известный ранее белок, похожий по своей структуре на ферменты, управляющие метилированием ДНК. Это позволило предположить, что поддержание "парамутантного" состояния как-то связано с метилированием ДНК. Заодно наметилась и связь с РНК-зависимой РНК-полимеразой, которая тоже нужна для парамутации, как было показано ранее. Дело в том, что РНК-зависимая РНК-полимераза размножает маленькие молекулы РНК, которые тоже участвуют в регуляции метилирования ДНК. Итак, можно было ожидать, что парамутация как-то связана с метилированием ДНК в окрестностях гена рl1. Ученые обратили внимание на то обстоятельство, что перед началом гена pl1 имеется некодирующий участок ДНК, представляющий собой фрагмент транспозона. Надо сказать, что метилирование ДНК используется в том числе и для инактивации транспозонов. Кусочек транспозона, расположенный перед началом гена pl1, как выяснилось, по-разному метилируется у нормальных растений и у мутантов с неработающим геном rmr1 (у первых он метилируется сильнее). Кроме того, при работающем гене rmr1 в клетках растений была выявлена пониженная концентрация молекул РНК, считанных с гена рl1, по сравнению с растениями, у которых ген rmr1 не работал. Скорость транскрипции (считывания) гена pl1, однако, была одинаковой в обоих случаях. Это значит, что от гена rmr1 зависит не скорость считывания, а устойчивость (стабильность) уже считанных с гена рl1 молекул РНК. На этом этапе исследователи, казалось, уже вплотную подошли к пониманию механизма парамутации. Разрозненные факты вроде бы начали складываться в цельную картину. Можно было предположить, что "активное" состояние гена рl1 соответствует низкому уровню метилирования фрагмента транспозона перед его началом, а "пассивное" — высокому; что ген rmr1 регулирует уровень метилирования, а уровень метилирования в свою очередь определяет стабильность молекул РНК, считанных с гена рl1 (и тем самым определяет "активность" гена). Хотя эту схему трудно назвать простой, дальнейшие эксперименты показали, что в действительности все еще сложнее. Стало ясно, что истинный механизм парамутации иной, и загадка в итоге так и осталась неразгаданной. Ученые выявили два факта, которые говорят о том, что уровень метилирования фрагмента транспозона перед началом гена pl1 не является определяющим для возникновения парамутации. Во-первых, если бы это было так, то в случае нормально работающего гена rmr1 уровень метилирования у "парамутантных" растений должен быть выше, чем у "непарамутантных". Но это не подтвердилось: уровень метилирования у таких растений оказался одинаковым (высоким). Во-вторых, оказалось, что ген rmr1 необходим только для устойчивого наследования парамутации, но не для ее возникновения. Таким образом, механизм парамутации у кукурузы по-прежнему неизвестен. Может быть, это явление связано с метилированием каких-то других участков ДНК или с какими-то иными эпигенетическими модификациями. Метилирование кусочка транспозона перед началом гена рl1, очевидно, необходимо для сохранения неактивного состояния гена, но таких "необходимых, но не достаточных условий" в принципе может быть много. Скорее всего, выявленные на сегодняшний день случаи парамутаций — лишь верхушка айсберга, основу которого составляют неизвестные пока аспекты эпигенетической наследственности. Нужно иметь в виду, что существует не так уж много генов, которые так четко и ясно проявляются в фенотипе, как ген рl1, влияющий на окраску пыльников. Не случайно большинство известных парамутаций связаны именно с окраской, будь то пыльники кукурузы или хвосты мышей. Другие парамутации труднее обнаружить, и они пока остаются незамеченными. Что общего у цветковых растений и млекопитающих? Парамутации обнаружены у цветковых растений и млекопитающих — двух групп, венчающих эволюционное древо, соответственно, растений и животных. Очень может быть, что это не случайность. Именно в этих двух группах организмов наибольшее развитие получил родительский геномный импринтинг (см. главу 8). Как мы помним, суть этого явления в том, что родители целенаправленно манипулируют наследственными свойствами потомства, метилируя некоторые гены в своих половых клетках. Ранее мы также упоминали о возможной связи геномного импринтинга с тем обстоятельством, что из всех животных именно у млекопитающих в ходе индивидуального развития очень рано начинают работать собственные гены эмбриона (см. главу 5). Итак, три особенности: парамутации, импринтинг и раннее включение эмбриональных генов. Существует ли между ними реальная связь, и если да, то какова ее природа? Вот еще одна из волнующих неразрешенных загадок, ждущих своего ответа. Может быть, все эти три особенности связаны с тем, что именно у млекопитающих и цветковых растений материнский организм вкладывает очень много ресурсов в свое потомство. Это порождает "конфликт интересов" между полами: отец заинтересован в том, чтобы потомство получило от матери как можно больше ресурсов, а мать пытается сохранить силы, чтобы в будущем произвести новое потомство. Геномный импринтинг — результат этого конфликта. Отец выключает в своих половых клетках те гены, работа которых выгодна матери, но не эмбриону, а мать отключает в своих яйцеклетках те гены, работа которых выгодна эмбриону, но вредна для нее самой. Раннее включение генов эмбриона могло развиться в связи с тем, что как отцу, так и матери выгодно, чтобы "отредактированные" ими гены эмбриона включились пораньше. Может быть, парамутации являются побочным следствием этих приспособлений? Животные держат мобильные генетические элементы под контролемС мобильными генетическими элементами (МГЭ) мы уже познакомились (см. главу "Наследуются ли приобретенные признаки?"), однако у читателя может сложиться неполное и не совсем точное представление об этих удивительных объектах, находящихся на грани живого и неживого, если не упомянуть об одном важном открытии, которое сделали недавно генетики. До сих пор МГЭ обычно воспринимались как активные преобразователи чужих геномов, которые по собственной прихоти прыгают с место на место, встраиваются в разные участки хромосом и вносят элемент хаоса в слаженную работу генетических комплексов. И вдруг оказалось, что геномы высших организмов вовсе не являются пассивными "жертвами" МГЭ. Эукариотическая клетка, как выяснилось, умеет контролировать деятельность этих не в меру шустрых нахлебников. Возможны ли в биологии "открытия на кончике пера"? Открытые недавно молекулярные механизмы, при помощи которых эукариотическая клетка управляет мобильными генетическими элементами, оказались невероятно сложными, запутанными и даже на первый взгляд громоздкими. Для того чтобы разобраться в них, могут понадобиться годы. И все это оказалось полной неожиданностью для ученых. Никто не подозревал, что может существовать такая система. Никакие теории этого не предсказывали. Впору задуматься: сколько еще сюрпризов нас ждет? И когда наконец мы наберем достаточно знаний, чтобы делать открытия "на кончике пера" — так, как астрономы начали открывать не видимые простым глазом планеты Солнечной системы после того, как поняли общие законы движения планет? Пока же открытия чаще всего сваливаются на биологов как снег на голову. Один из редких примеров удачного "умозрительного" открытия в молекулярной биологии, впоследствии подтвержденного экспериментально, — это открытие теломеразы, фермента, который восстанавливает кончики хромосом, укорачивающиеся после каждого клеточного деления. Российский ученый А. М. Оловников "вычислил" теломеразу за много лет до того, как она была реально открыта. Поняв, что кончики хромосом должны укорачиваться (потому что фермент, который копирует ДНК, не может скопировать ту ее часть, к которой он прикрепляется в самом начале процесса копирования), Оловников рассудил, что, следовательно, должен существовать особый фермент, который умеет восстанавливать укоротившиеся кончики. Иначе все клетки очень быстро потеряли бы способность делиться. Самое удивительное, что западные ученые признали это достижение Оловникова, ссылаются на его работы и считают его одним из создателей "теломерной теории старения". Обычно подобные озарения остаются не замеченными и не признанными научным сообществом. Сейчас в цене эксперименты, а не рассуждения. Система управления мобильными элементами впервые была найдена у плодовой мушки дрозофилы в 2006 году (Vagin et al. A distinct small RNA pathway silences selfish genetic elements in the germline // Science. 2006. V. 313. E 320-324.). Оказалось, что в процессе созревания сперматозоидов у дрозофилы "включаются" гены белков семейства Piwi, а также гены особых маленьких регуляторных РНК, которые получили название пиРНК (piRNA, сокращение от Piwi-interacting RNAs). ПиРНК — короткие, длиной в 24-29 нуклеотидов, молекулы, нуклеотидные последовательности которых совпадают с теми или иными участками различных МГЭ. ПиРНК присоединяются к Piwi-белкам и "программируют" их на распознавание и уничтожение молекул мРНК, считанных с мобильных элементов. Тем самым подавляется активность МГЭ. У дрозофилы активность генов Piwi была зарегистрирована только в семенниках самцов (в созревающих сперматоцитах). Почему-то мушки считают необходимым приглушить свои МГЭ именно во время сперматогенеза. Возможно, это объясняется тем, что МГЭ именно в сперматоцитах становятся особенно активными. В дальнейшем выяснилось, что белки семейства Piwi есть и у млекопитающих. Они тоже синтезируются во время сперматогенеза и образуют комплексы с пиРНК. В 2007 году американским биологам удалось показать, что у млекопитающих (а именно у мышей, на которых проводились опыты) Piwi-белки и пиРНК выполняют примерно те же функции, что и у плодовой мушки (Alexei A. Aravin, Ravi Sachidanandam, Angelique Girard, Katalin Fejes-Toth, Gregory J. Hannon. Developmentally Regulated piRNA Clusters Implicate MILI in Transposon Control // Science. 2007. V. 316. E 744-747.). Однако то, что обнаружили исследователи, в действительности похоже на верхушку айсберга и ставит гораздо больше новых вопросов, чем дает ответов. Выяснилось, что мышиные пиРНК весьма многочисленны и разнообразны (как и у дрозофилы). Последовательности многих из них совпадают с участками известных мышиных МГЭ, следовательно, они способны "направлять" деятельность Piwi-белков на МГЭ. Однако есть очень много других пиРНК, последовательности которых совпадают либо с участками рабочих генов, либо с фрагментами генома, функции которых неизвестны. Зачем нужны эти пиРНК, пока невозможно сказать. Ученые установили, что отключение генов Piwi-белков приводит к резкому росту активности мобильных генетических элементов в сперматоцитах. Стало ясно, что система регуляции активности МГЭ при помощи Piwi-белков и пиРНК не является уникальной особенностью насекомых. Скорее всего, она широко распространена в живой природе. Если считать МГЭ "эгоистическими" и чужеродными объектами, своеобразными геномными паразитами, то Piwi-белки и пиРНК можно было бы назвать системой "внутриклеточного иммунитета", в которой роль "антител" выполняют пиРНК. Если же считать МГЭ полноправными составными частями единого генома, эту систему правильнее будет поставить в один ряд с другими известными механизмами генной регуляции, которые обеспечивают своевременное включение и выключение различных участков генома в зависимости от потребностей организма. В пользу второй интерпретации свидетельствует один чрезвычайно важный факт. Оказалось, что набор пиРНК, производимых сперматоцитами, меняется с возрастом, причем весьма резко. Существует два почти непересекающихся "комплекта" пиРНК. Один из них, "ранний", обнаруживается в семенниках мышат примерно до 12-14-дневного возраста. После этого начинают производиться совсем другие, "поздние" пиРНК. Свойством подавлять активность МГЭ обладают оба комплекта, и смысл перемены пока совершенно неясен. Так или иначе, все это больше похоже не на работу иммунной системы, а на генетическую регуляцию индивидуального развития. Хотя, конечно, для окончательных выводов у нас еще слишком мало данных. Ученые также установили, что пиРНК могут влиять на активность МГЭ не только путем "программирования" Piwi- белков, но и другим способом — через механизм метилирования ДНК. Как мы помним, это один из важных способов регуляции активности генов. В общем случае чем сильнее метилирован ген, тем слабее он работает. Метилирование ДНК осуществляется специальными ферментами. Однако вопрос о том, откуда эти ферменты "узнают", какие гены надо метилировать, а какие не надо, пока еще далек от разрешения. На растениях ранее было показано, что определенную роль в этом могут играть маленькие молекулы РНК, которые каким-то образом "указывают" ферментам гены, подлежащие метилированию. Ранее также было установлено, что многие МГЭ у млекопитающих подвергаются усиленному метилированию — это еще один способ держать МГЭ под контролем. Исследователи решили проверить, влияет ли отключение системы Piwi-пиРНК на степень метилирования МГЭ в сперматоцитах мышей. Оказалось, да, влияет, причем весьма существенно. Возможно, это свидетельствует о том, что пиРНК и Piwi-белки каким-то образом направляют деятельность ферментов, ответственных за метилирование, на нужные участки генома. У насекомых в отличие от млекопитающих метилирование ДНК для регуляции работы генов почти не используется. И у мух, и у мышей в работе системы Piwi-пиРНК используется принцип обратной связи. Дело в том, что те "обрезки", которые получаются из считанных с МГЭ молекул мРНК в результате деятельности Piwi-белков, сами могут функционировать в качестве пиРНК, то есть связываться с Piwi-белками и управлять их работой. Чем активнее МГЭ, тем больше с них считывается молекул мРНК. Это расширяет поле деятельности для Piwi-белков, которые режут эти мРНК на кусочки. Чем больше становится в клетке таких кусочков, функционирующих в качестве пиРНК, тем эффективнее действуют Piwi-белки и тем сильнее подавляется активность МГЭ. Очевидно, что исследователи только начали проникать в некую совершенно новую, весьма необычную область. Пожалуй, единственный обоснованный вывод, который можно сделать, состоит в том, что поведение МГЭ не является бесконтрольным, что клетка имеет реальную возможность влиять на их деятельность. Учитывая, что МГЭ играют важнейшую роль в эволюции организмов и даже могут придавать ей отчасти направленный характер, получается, что организмы в принципе способны активно регулировать собственную эволюцию. Это еще один механизм управления наследственными изменениями из числа тех, о которых рассказано в главе "Управляемые мутации". Взаимное узнаваниеМножество захватывающих тайн в биологии связано со способами взаимного узнавания на уровне молекул, клеток и организмов. Как одна молекула находит другую в безумной химической круговерти цитоплазмы? Как транскрипционный фактор находит среди миллиардов нуклеотидов ДНК тот единственный и неповторимый участок, к которому он должен прикрепиться? Откуда знают растущие нервные клетки, в какую сторону им необходимо выпустить отросток и с какой клеткой вступить в контакт? Как удается самцу насекомого безошибочно найти по запаху самку своего вида, особенно если концентрация химического сигнала в воздухе близка к нулю? Как ухитряется самка рыбки колюшки опять-таки по запаху выбрать себе в мужья такого самца, который приходится ей одновременно и не слишком близкой, и не слишком дальней родней? Тема эта необозримо велика, и мы ее до сих пор почти не затрагивали. Не удастся нам подробно раскрыть ее и в этой последней главе. Но о двух удивительных и тесно взаимосвязанных открытиях я все-таки расскажу. Одно из них имеет отношение к иммунитету, другое — к формированию нервной системы в ходе индивидуального развития. Казалось бы, какая тут связь? Самая прямая: в обоих случаях главным действующим лицом оказался один и тот же белок из надсемейства иммуноглобулинов. И белок этот сам по себе заслуживает того, чтобы о нем рассказать. Известный в биологических кругах афоризм гласит: тот, кто не видел кораллового рифа, не зоолог. Примерно то же и здесь: кто не слышал о белке DSCAM, едва ли может представить себе, на что способны белки. Но начнем по порядку. Первое открытие связано с иммунной системой насекомых (Yuemei Dong, Harry Е. Taylor, George Dimopoulos. AgDscam, a Hypervariable Immunoglobulin Domain-Containing Receptor of the Anopheles gambiae Innate Immune System // PLoS Biology. 2006. V 4. Issue 7.). Как мы помним, основная обязанность иммунной системы — безошибочно распознавать любую попавшую в организм заразу, в том числе и такую, с которой раньше не приходилось встречаться. Для этого нужно иметь очень много разных белков, избирательно связывающихся с различными чужеродными веществами (антигенами). Позвоночные животные продуцируют сотни тысяч вариантов таких защитных белков — гораздо больше, чем генов в геноме. Высокое разнообразие защитных белков достигается благодаря прижизненным перестройкам генома в клетках иммунной системы — лимфоцитах. О том, как это происходит, говорилось в главе "Управляемые мутации", а здесь я только вкратце напомню самое основное. В геноме "зародышевой линии", то есть в том геноме, который позвоночное животное получает от папы с мамой, нет генов антител как таковых, а есть наборы заготовок — несколько "кассет" похожих, но немного различающихся фрагментов будущего гена. В зреющем лимфоците специальные ферменты (потомки прирученных транспозонов — RAG-белки) режут и перекраивают геномную ДНК, чтобы собрать из этих заготовок один функциональный ген. При этом из каждой "кассеты", состоящей из десятков похожих фрагментов, случайным образом выбирается какой-то один. В разных лимфоцитах гены антител получаются разными, а общее число теоретически возможных вариантов у человека или мыши достигает трех миллионов. Приобретенный иммунитет формируется за счет того, что те лимфоциты, чьи антитела лучше других связываются с данным инфекционным агентом, усиленно размножаются, а гены их антител вдобавок еще и "подгоняются" к антигену за счет мутирования и дополнительного отбора. Всего этого нет у беспозвоночных. Долгое время считалось, что беспозвоночным удается как-то обходиться одним лишь врожденным, неспецифическим иммунитетом и сравнительно небольшим числом иммунных белков — рецепторов, гены которых в "явном виде" присутствуют в геноме зародышевой линии и не подвергаются прижизненным перестройкам. Учитывая быструю эволюцию и вариабельность микроорганизмов, было довольно удивительно, каким образом беспозвоночные ухитряются при этом выжить. Однако со временем открывалось все больше фактов, показывающих, что у беспозвоночных тоже формируется приобретенный иммунитет. Вот только как им это удается без прижизненных перестроек генов, оставалось неясным. Иммунологи из Университета Джонса Гопкинса (США) обратили внимание на один весьма необычный ген, имеющийся и у позвоночных, и у насекомых. Этот ген называется DSCAM (Down syndrome cell adhesion molecule). Некоторые его мутации у человека ассоциированы с синдромом Дауна. У насекомых он, как было известно, отвечает за регуляцию роста нервных клеток, хотя как именно он это делает, никто не знал. Ген принадлежит к надсемейству иммуноглобулинов, то есть содержит иммуноглобулиновые домены (последовательности нуклеотидов, кодирующие участки белковой молекулы, предназначенные для избирательного связывания других молекул). Иммуноглобулиновые гены есть практически у всех животных. Они выполняют разнообразные рецепторные функции, далеко не всегда связанные с иммунной защитой. Например, тот же рост аксонов направляется определенными химическими сигналами, которые кто-то должен улавливать и распознавать. После того как на матрице гена DSCAM синтезируется его РНК-копия (мРНК), она подвергается особой процедуре редактирования — альтернативному сплайсингу (см. врезку). Альтернативный сплайсинг. Как известно, почти все гены высших организмов состоят из участков, кодирующих белок (экзонов), и вставленных между ними некодирующих фрагментов (интронов). Есть мнение, что некоторые интроны являются потомками мобильных генетических элементов, бурно размножившихся в геноме древнейших эукариот (см. главу "Великий симбиоз"). В ходе прочтения гена (транскрипции) сначала синтезируется "незрелая" матричная РНК (мРНК), представляющая собой полную копию всего гена, включая интроны. Затем интроны один за другим "вырезаются" из молекулы РНК, а экзоны соединяются друг с другом. Это и называется сплайсингом. Обычно существует несколько альтернативных вариантов сплайсинга для одной и той же мРНК. Дело в том, что часть экзонов может быть вырезана вместе с прилегающими к ним интронами. В результате из одной и той же "незрелой" мРНК, содержащей, например, 7 экзонов (1, 2,3,4, 5, 6,7) могут получиться разные "зрелые" мРНК: 12357,12467, 2345 и т. д. Экзоны могут вырезаться из молекулы РНК, но не могут меняться местами. Разные мРНК станут затем матрицами для синтеза разных белков. Таким образом, благодаря механизму альтернативного сплайсинга один и тот же ген может кодировать несколько разных белков. То, какой именно белок будет производиться данным геном в каждой конкретной ситуации, зависит от сложных регуляторных систем, о которых пока еще очень мало известно. Между прочим, тот факт, что благодаря альтернативному сплайсингу один ген может кодировать более одного белка, является явным нарушением принципа "один ген — один белок" (или "один ген — один фермент"), который был сформулирован еще в 40-е годы XX века. Данный принцип сыграл огромную положительную роль в становлении современной молекулярной биологии. На тот момент это было величайшим достижением — догадаться, что загадочные гены, молекулярная природа которых еще не была расшифрована, занимаются не чем-нибудь, а именно кодированием белков, причем каждому белку соответствует свой собственный ген. Но сегодня этот принцип устарел, как и почти все "классические догмы" образца середины прошлого века. Вот вам и еще один пример лопнувшей "абсолютной истины"! Уникальной особенностью гена DSCAM, содержащего 21 экзон, является то, что три из них представлены не в единственном экземпляре, а в виде кассет из множества немного различающихся копий. У малярийного комара, на котором проводилось данное исследование, экзон № 4 представлен в 14 экземплярах, экзон № 6 — в 30, экзон № 10 — в 38. В ходе сплайсинга сохраняется только один вариант каждого из этих экзонов. Таким образом, за счет альтернативного сплайсинга на основе единственного гена DSCAM может быть синтезировано 14 х 30 х 38 = 15 960 разных рецепторных белков. У мушки дрозофилы число вариантов еще больше: 38 016. Такая структура гена DSCAM до боли напоминает те кассеты заготовок, из которых в лимфоцитах млекопитающих конструируются гены антител. Поэтому мысль об участии DSCAM в иммунной защите, по правде сказать, напрашивалась давно, но доказать это удалось лишь недавно, в 2006 году. Ученые обнаружили, что в присутствии разных бактерий иммунные клетки производят разные наборы сплайс-вариантов белка DSCAM. Например, в ответ на заражение кишечной палочкой резко увеличивается частота использования 8-го варианта 4-го экзона, тогда как стафилококк стимулирует синтез белков DSCAM с использованием 1-го варианта того же экзона. Искусственное "выключение" гена DSCAM приводит к резкому снижению способности комара сопротивляться инфекциям; кроме того, в его гемолимфе (аналог крови у насекомых) начинают бурно размножаться бактерии, в норме присутствующие там в небольших количествах. Это доказывает непосредственное участие DSCAM в иммунной защите.
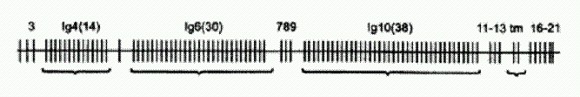
Строение гена DSCAM малярийного комара. Вертикальными отрезками показаны экзоны. Иммуноглобулиновые экзоны 4, 6 и 10 представлены кассетами из 14, 30 и 38 альтернативных вариантов. Зрелая РНК после сплайсинга будет содержать лишь по одному варианту каждого из этих трех экзонов. Ученым удалось показать, что отключение тех сплайс-вариантов белка DSCAM, которые синтезируются в присутствии кишечной палочки, лишает комара способности бороться именно с кишечной палочкой, но не со стафилококком, и наоборот. Выяснилось также, что сплайс-варианты DSCAM, синтезируемые в ответ на заражение той или иной бактерией, лучше других "прилипают" именно к этой бактерии. Изменения в спектре синтезируемых сплайс-вариантов DSCAM, спровоцированные контактом с бактериями, сохраняются в течение как минимум 18 часов после того, как контакт прекратился (что происходит потом, ученые просто не проверяли). Это очень похоже на явление приобретенного иммунитета! Таким образом, различные сплайс-варианты белка DSCAM в известной мере аналогичны антителам позвоночных (хотя антитела, конечно, более избирательны и эффективны). Образование разнообразных сплайс-вариантов DSCAM осуществляется на основе того же комбинаторного принципа, что и образование антител у позвоночных. В обоих случаях используются случайный выбор и комбинирование отдельных фрагментов гена, каждый из которых представлен в геноме в виде нескольких альтернативных вариантов. Только у позвоночных это "перекраивание" генетической информации осуществляется на уровне ДНК, а у насекомых — на уровне РНК. Это исследование, на мой взгляд, представляет собой крупный прорыв не только в изучении иммунной системы беспозвоночных, но и в понимании общих принципов иммунитета в целом. Можно ожидать, что дальнейшие исследования приведут к открытию новых черт сходства между иммунными системами далеких друг от друга групп организмов.
Каждая нервная клетка имеет десятки и сотни отростков, которые в ходе развития организма соединяются в строго определенном порядке. Как отростки нейронов находят друг друга и что позволяет им не ошибиться? Оказалось, что важную роль в этом играет иммунологический механизм различения "своих" и "чужих*. За рамками исследования осталось множество важных вопросов. Например, осталось неясным, каким образом осуществляется регуляция сплайсинга. Откуда комар "знает", какие варианты белка DSCAM нужно синтезировать для борьбы с кишечной палочкой, а какие — для защиты от стафилококка? В любом случае результат удивительный: целая иммунная система — в одном-единственном белке! Второе недавнее открытие, связанное с белком DSCAM, позволило понять, какую роль играет это биохимическое чудо в развитии нервной системы. До сих пор было известно только то, что у насекомых с мутациями в гене DSCAM нервная система развивается неправильно. Механизм участия DSCAM в индивидуальном развитии был неясен, хотя "общую идею" нетрудно было угадать. Чтобы из делящихся клеток зародыша, которые все имеют одну и ту же заложенную в них "программу поведения" (геном), сформировалась не аморфная клеточная масса, а сложный организм, эти клетки должны знать, в какую сторону им расти или переползать, к кому приклеиваться, а от кого, напротив, отделяться. Для этого им нужно как-то узнавать друг друга, понимать, кто есть кто в их окружении. Такое взаимное узнавание клеток особенно важно в ходе развития нервной системы, чтобы отростки нейронов соединялись друг с другом правильным образом и формировали "правильные" нервные контуры и сети. Что касается белков иммуноглобулинового надсемейства, то они как раз и специализируются на выполнении задач такого рода, то есть на персональной идентификации и различении "своих" и "чужих". Поэтому можно было предвидеть, что для этих белков найдется работа не только в иммунной системе, но и в других ситуациях, когда нужно разбираться, кто есть кто в клеточном или социальном окружении (О "социальном окружении" я упомянул не случайно. Оказывается, позвоночные животные (а возможно, и не только они) широко используют иммуноглобулиновые белки для персональной идентификации. Например, белки так называемого "главного комплекса гистосовместимости" составляют важнейшую часть индивидуального запаха и, в частности, позволяют животным отличать родню от чужаков. Даже люди не совсем утратили эту способность. Подробности см. по адресу: http://evolbiol.ru/mate_recognition.htm). Однако, повторю, до недавнего времени никто не знал, каким именно способом белок DSCAM реализует эту функцию в ходе развития нервной системы. В 2004 году у белка DSCAM было обнаружено очередное поразительное свойство (Wojtowicz W. М. et al. Alternative splicing of Drosophila DSCAM generates axon guidance receptors that exhibit isoform-specific homophilic binding // Cell. 2004. V 118. P. 619-633.). Оказалось, что каждый сплайс-вариант этого белка обладает способностью к так называемому "гомофильному связыванию". Это значит, что молекула данного сплайс-варианта "узнает" другую такую же молекулу и прочно связывается с ней. При этом она никогда не связывается с другими сплайс-вариантами того же белка. Совершеннейшая фантастика, если подумать! Всем известно, что молекулы ДНК и РНК легко "узнают" свои собственные копии и склеиваются с ними на основе принципа комплементарности. Но чтобы подобные свойства обнаружились у белков — в это даже поверить трудно. Тем не менее данный факт подтвержден весьма тщательными экспериментами, проверены сотни сплайс-вариантов. Механизм "гомофильного связывания" активно исследуется, но пока еще до конца не расшифрован. Нетрудно догадаться, что эта удивительная особенность делает DSCAM идеальным молекулярным устройством для различения "своих" и "чужих". Оставалось выяснить, как это устройство используется при развитии нервной системы. Биологи из Австрии и США в 2007 году получили ответ на этот вопрос при помощи генной инженерии (Daisuke et al. DSCAM diversity is essentialfor neuronal wiring and self-recognition // Nature. 2007. V 449. E. 223-227.). Они создали три линии генетически модифицированных мух, в каждой из которых ген DSCAM был радикально "упрощен". Из него были вырезаны все альтернативные наборы фрагментов-заготовок, кроме одного-единственного, разного в каждой из трех линий. Модифицированные мухи, таким образом, могли синтезировать только один сплайс-вариант белка DSCAM вместо 38 016. Внесенные в геном изменения оказались летальными. Все мухи, у которых обе копии гена DSCAM были изменены (то есть гомозиготы), погибали на стадии личинки или куколки, и у этих личинок и куколок наблюдались серьезные нарушения в развитии нервной системы. Например, у нормальных мух в обонятельном отделе мозга имеются определенным образом расположенные узлы, к каждому из которых присоединяются отростки чувствительных нейронов определенного типа. У личинок-мутантов данный отдел мозга представлял собой беспорядочную массу нейронов, и отростки чувствительных клеток крепились к нему как попало. При этом ген DSCAM у этих личинок работал, и количество производимого белка DSCAM было таким же, как у здоровых насекомых. Результат был одинаков во всех трех генетически модифицированных линиях. Авторы сделали вывод, что жизненно важным является не только белок DSCAM сам по себе, но и разнообразие его сплайс-вариантов. Дальнейшие исследования показали, что каждый нейрон в норме производит свой собственный уникальный набор сплайс-вариантов белка DSCAM. Таким образом создается уникальная "визитная карточка" данного нейрона, что позволяет нейрону отличать свои собственные отростки от чужих. При помощи сложных экспериментов удалось показать, что нейроны, способные синтезировать только один сплайс-вариант DSCAM, растут неправильно, если они окружены другими такими же мутантными нейронами, однако их рост становится совершенно нормальным, если их окружают обычные нервные клетки, производящие разные сплайс-варианты. Если нейрон вообще не производит белка DSCAM, он растет неправильно в любом клеточном окружении. От того, какой именно сплайс-вариант производят мутантные клетки, как выяснилось, ничего не зависит. Таким образом, сплайс-варианты DSCAM нужны нервным клеткам для создания уникального "молекулярного паспорта", благодаря которому нейроны отличают свои собственные отростки от чужих. Данное открытие подтверждает идею о том, что молекулярные системы различения "своих" и "чужих", основанные на иммуноглобулиновых белках, гораздо шире распространены в живой природе, чем думали когда-то, и роль их отнюдь не сводится к одной лишь иммунной защите. Осмелюсь предположить, что скоро нас ждут новые открытия в этой области. Новые способы работы с информациейОдна из областей, в которых наши знания остаются до обидного неполными, — это изучение той роли, которую играют молекулы РНК в обработке генетической информации. Биологи то и дело открывают новые клеточные "информационные технологии", в которых РНК оказывается главным действующим лицом, и конца этим открытиям пока не видно. Новооткрытые функции РНК подтверждают теорию абиогенеза (самозарождения жизни). Почему раньше биологи не замечали множества разнообразных функций, выполняемых в клетке молекулами РНК? Может быть, слишком привыкли думать, что "всю работу в клетке делают белки"? Похоже на то. Как только ученые осознали, что жизнь началась с РНК (это понимание пришло, как мы помним, в середине 80-х годов XX века), стало ясно также и то, что теория РНК-мира имеет проверяемое следствие. Из нее следует, что, если хорошенько поискать, в современных живых клетках могут найтись ранее незамеченные "следы" эпохи РНК-мира — в том числе разные неожиданные функции, выполняемые молекулами РНК. Это следствие блестяще подтвердилось, и новые открытия продолжают его подтверждать по сей день, так что и конца не видно. Это одно из тех обстоятельств, которые все больше убеждают нас в том, что жизнь действительно возникла естественным путем из неживой материи. Почему? Судите сами. Из теории естественного происхождения жизни (абиогенеза) следовало, что должна существовать молекула, с которой "все началось", — молекула, способная одновременно справляться и с "работой", и с хранением наследственной инофрмации. Это было проверямое следствие — единственный реальный способ проверить научную теорию, которую нельзя подтвердить или опровергнуть прямым наблюдением (а такова большая часть научных теорий). Проверяемое следствие — чрезвычайно ценная вещь! Именно по наличию или отсутствию проверяемых следствий всегда можно отличить научную теорию от ненаучной. Например, креационизм не является научной теорией как раз потому, что не имеет проверяемых следствий. Ведь Бог мог сотворить жизнь и Вселенную с абсолютно любым строением и свойствами. Какое бы неожиданное свойство мы ни обнаружили, всегда можно сказать: это так, потому что так было угодно Богу. Мотивы высшего разума мы постичь не можем, поэтому не можем и предсказать ничего конкретного о тех областях реальности, которые еще не изучены. Наука избегает таких теорий, из которых ничего конкретного не следует. Из теории абиогенеза, напротив, следовало нечто вполне конкретное: должна существовать молекула с такими-то свойствами. Подходящую молекулу нашли — ею оказалась РНК. Проверяемое следствие подтвердилось, и теория абиогенеза заработала себе очередной большой и жирный "плюсик". Теория РНК-мира после этого стала важной составной частью теории абиогенеза. Из нее, в свою очередь, вытекали новые проверяемые следствия, которые сегодня подтверждаются, и тем самым новые "плюсики" зарабатывает и теория РНК-мира, и вмещающая ее теория абиогенеза. Взять, к примеру, тот же альтернативный сплайсинг. Каким образом клетка "решает", какой из вариантов сплайсинга нужно выбрать в данной ситуации (и, следовательно, какой из вариантов белка синтезировать)? Об этом пока известно очень мало. Удалось выяснить, что такая регуляция требует участия особых белков — регуляторов сплайсинга. Не было оснований думать, что сплайсинг регулируется чем-то еще, кроме белков. И вдруг ученые из Йельского университета (США) публикуют статью (Ming Т. Сheah, Andreas Wachter, Narasimhan Sudarsan, Ronald R. Breaker. Control of alternative RNA splicing and gene expression by eukaryotic riboswitches // Nature. 2007. V. 447. P. 497-500.), в которой описан совершенно иной способ регуляции, где белки не участвуют вообще. Ключевую роль в нем играет сама молекула РНК, подвергающаяся сплайсингу. Способность молекулы РНК самостоятельно определять свою судьбу и выбирать способ, каким она будет перекроена, определяется наличием в одном из ее некодирующих участков (интронов) специфической последовательности нуклеотидов, которая сама собой сворачивается в особую трехмерную структуру — РНК-переключатель. О том, что это такое, мы уже рассказывали в главе "Происхождение жизни". Исследование проводилось на грибе Neurospora crassa, известном широкой публике как розовая хлебная плесень. По иронии судьбы, на этом же объекте в 40-е годы прошлого века были получены сенсационные результаты, позволившие сформулировать принцип "один ген — один белок". Сейчас на нейроспоре изучают альтернативный сплайсинг — явление, опровергающее (или, лучше сказать, уточняющее и расширяющее) этот замечательный принцип. У нейроспоры, как и у ряда других эукариот, в генах, участвующих в биосинтезе тиамина (витамина В1, были обнаружены участки, сходные с известными бактериальными РНК-переключателями, которые реагируют на производное тиамина — тиамин-пирофосфат. Большинство известных РНК-переключателей действуют по принципу отрицательной обратной связи. Они реагируют на вещество, синтезируемое белковым продуктом данного гена, и при достаточно высокой концентрации этого вещества отключают ген. Примерно то же самое наблюдалось и в данном случае. Повышение концентрации тиамин-пирофосфата в клетках гриба приводит к снижению производства белков, ответственных за синтез тиамина. Было показано, что если удалить из соответствующих генов участки, похожие на бактериальные РНК- переключатели, то производство тиамин-синтезирующих белков перестает зависеть от концентрации тиамин-пирофосфата. Таким образом, стало ясно, что участки грибных генов, похожие на РНК-переключатели, действительно являются таковыми. Оставалось лишь выяснить механизм их действия, то есть понять, как они блокируют работу "своих" генов. У бактерий РНК-переключатели делают это либо на этапе транскрипции (первичного "прочтения" гена), либо на этапе трансляции — синтеза белка на матрице мРНК. У эукариот, как выяснилось, дело обстоит иначе — работа гена блокируется на этапе сплайсинга. Бактериям это недоступно, поскольку у бактерий сплайсинга нет (почти нет, если быть точным). Тиаминовый РНК-переключатель в генах Neurospora crassa располагается в первом интроне, недалеко от начала гена. Если в клетке мало тиамин-пирофосфата, РНК- переключатель "приклеивается" одной из своих петель к строго определенному месту на молекуле мРНК. Это место является одним из потенциальных мест сплайсинга, то есть именно здесь в ходе сплайсинга молекула мРНК может быть разрезана. Однако приклеившийся РНК-переключатель не позволяет этого сделать, и молекула разрезается в другом подходящем месте по соседству. В результате формируется "правильная" зрелая мРНК, на основе которой синтезируется полноценный белок. Если же в клетке много тиамин-пирофосфата, это вещество присоединяется к РНК-переключателю и изменяет его форму. Переключатель "отклеивается" от места сплайсинга и перестает его защищать. Тогда молекула РНК режется именно в этом месте, которое раньше прикрывалось РНК-переключателем. Это в конечном счете приводит к формированию "бракованной" зрелой мРНК, на базе которой полноценный белок синтезировать невозможно. Таким образом, РНК-переключатель в зависимости от концентрации тиамин-пирофосфата направляет сплайсинг по одному из двух альтернативных путей.
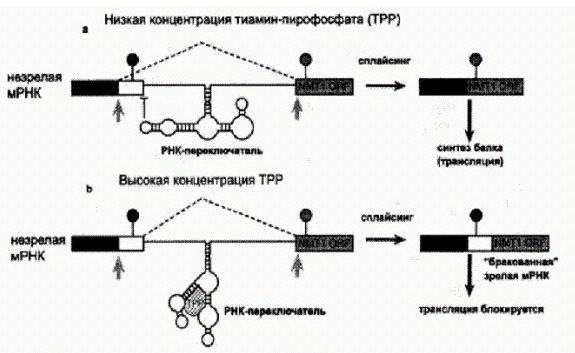
На этом рисунке показано, как РНК-переключатель регулирует альтернативный сплайсинг у розовой хлебной плесени (на примере гена NMT1). Участок мРНК, вырезаемый при сплайсинге, отмечен пунктирными линиями и серыми стрелками. При низкой концентрации тиамин-пирофосфата РНК-переключатель "защищает" потенциальный сайт (место) сплайсинга, отмеченный значком в виде буквы "Т". В результате при сплайсинге вместо этого сайта используется другой, расположенный по соседству (серая стрелка). Участок мРНК, отмеченный белым цветом, не попадает в зрелую мРНК. При высокой концентрации ТРР это вещество связывается с РНК-переключателем и меняет его конфигурацию. В результате молекула РНК режется в том месте, которое раньше было прикрыто РНК-переключателем, белый участок попадает в зрелую РНК и "портит" ее. Судя по некоторым косвенным признакам, регуляция сплайсинга при помощи РНК-переключателей может быть довольно широко распространена у эукариот. Чтобы проверить это предположение, необходима разработка эффективных методов поиска РНК-переключателей в эукариотических геномах — эти методы пока еще далеки от совершенства. Еще одна неожиданная функция РНК обнаружилась недавно в ходе изучения механизмов репарации — починки повреждений в ДНК. Оказалось, что молекулы РНК могут играть роль матриц, информация с которых переписывается в поврежденную молекулу ДНК взамен утерянной (Storici Е, Bebenek К., Kunkel Т. A., Gordenin D. A., Resnick М. А. RNA-templated DNA repair // Nature. 2007. V 447. P. 338-341.). Процесс основан на обратной транскрипции (как мы помним из предыдущей главы, так называют переписывание информации из РНК в ДНК, то есть синтез ДНК на РНК-матрице). Изобретение обратной транскрипции, между прочим, должно было стать важным переломным моментом в развитии РНК-мира, поскольку позволило РНК-организмам перейти к хранению наследственной информации в более надежной и стабильной форме молекул ДНК. В предыдущих главах мы упоминали несколько случаев использования обратной транскрипции современными организмами: это перемещение и размножение ретротранспозонов и ретровирусов, образование ретропсевдогенов, восстановление укорачивающихся при каждом клеточном делении кончиков хромосом — теломер. И вот еще один пункт добавился к этому списку — репарация ДНК. Если молекула ДНК повреждена — например, подверглась разрыву, — для ее починки необходима матрица, в которой последовательность нуклеотидов соответствует исходному, "правильному" состоянию поврежденного участка. Ранее считалось, что в качестве таких матриц всегда используются другие молекулы ДНК. Потом выяснилось, что иногда эти ДНК-матрицы синтезируются путем обратной транскрипции на основе РНК при участии ретротранспозонов. Наконец, совсем недавно ученые из Национального института экологии здоровья (США) сумели показать, что репарация возможна и непосредственно на основе РНК-матриц без предварительного изготовления ДНК-матрицы и без участия специфических ферментов — обратных транскриптаз, кодируемых ретротранспозонами. Исследователи искусственно вызывали у дрожжей разрыв хромосомы в одном и том же строго определенном месте. Затем в клетки добавляли искусственно синтезированные короткие молекулы РНК, последовательности нуклеотидов в которых соответствовали участкам поврежденной хромосомы по краям разрыва. Оказалось, что эта процедура повышает вероятность успешной "починки" разорванной хромосомы в 500 раз.
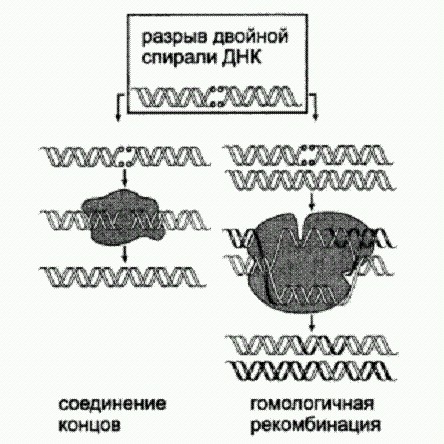
Два основных способа "починки * разрывов двойной спирали ДНК. Первый способ (негомологичное соединение концов) чреват неточностями — потерей или вставкой лишних нуклеотидов в районе разрыва. Второй более точен, но требует наличия "запасной копии" поврежденного фрагмента ДНК. Как выяснилось, эта запасная копия не обязательно должна быть двухцепочечной ДНК (как показано на рисунке), годится и одноцепочечная ДНК и даже РНК. Если в середину молекулы РНК, служащей матрицей для репарации, ввести несколько лишних нуклеотидов, они потом обнаруживаются в "починенной" хромосоме как раз между сшитыми краями разрыва. Это свидетельствует о синтезе ДНК на матрице РНК, то есть об обратной транскрипции. Кроме того, это говорит об отсутствии принципиальных преград для переписывания информации из РНК в ДНК в живых клетках, что может иметь большое значение для эволюции. Уже целый ряд фактов указывает на то, что молекулы РНК иногда могут служить чем-то вроде "резервных копий" особо важных "файлов", записанных в геномной ДНК, и при потере каких-то фрагментов информации (даже целых генов!) эти резервные копии могут идти в ход. Мы уже знаем три таких примера (описанные в главе "Управляемые мутации" геномные перестройки у инфузорий, парамутации, участие РНК в репарации), а есть и другие, не поместившиеся в эту книгу. Ясно, что все это открывает большие возможности для эволюции, хотя о том, в какой мере и для чего именно они используются, мы пока можем только гадать. Сравнение геномов человека и мыши помогло обнаружить новый способ регуляции работы генов. Ну и напоследок — еще одно недавнее открытие, которое как нельзя лучше показывает, что наши знания об устройстве и функционировании живой клетки до сих пор крайне неполны, а сложность и запутанность механизмов внутриклеточной регуляции далеко превосходит все, что мы еще недавно могли себе представить. В основе нового способа генной регуляции, только что открытого биологами из Калифорнийского университета в Беркли, лежит уже знакомый нам альтернативный сплайсинг, а также еще один механизм, называемый nonsense-mediated mRNA decay (NMD). Это можно перевести как "разрушение мРНК, опосредуемое бессмыслицей". Данный механизм представляет собой нечто вроде "внутриклеточной цензуры". Он служит для уничтожения заведомо бессмысленных молекул РНК. Особые молекулярные системы, о которых пока мало что известно, идентифицируют зрелую (то есть прошедшую сплайсинг) мРНК как бессмысленную и приговаривают ее к уничтожению в том случае, если в ней имеется "преждевременный" стоп-кодон (три нуклеотида, сигнализирующие об окончании синтеза белка). В норме стоп-кодон должен располагаться в конце каждого гена. Но в результате мутации он может образоваться в середине гена. В этом случае синтез белка обрывается преждевременно, и весь ген становится бессмысленным. Именно для выявления и "обезвреживания" таких мутаций и существует система NMD. Открытие, о котором идет речь, было сделано в ходе анализа так называемых "ультраконсервативных" участков генома. Как известно, геномы человека и мыши довольно сильно различаются. Однако имеются и довольно длинные (до многих сотен нуклеотидов) абсолютно идентичные участки. Ясно, что такая консервативность нуклеотидных последовательностей должна иметь какой-то смысл. По-видимому, она означает, что любое изменение этих участков неизменно оказывается вредным и для человека, и для мыши, поэтому естественный отбор быстро отсеивает таких мутантов. Некоторые ультраконсервативные участки находятся между генами и могут выполнять регуляторные функции. Другие лежат прямо внутри генов, задевая как интроны, так и экзоны. Это уже более странно, поскольку обычно структура генов и белков довольно пластична, а многие нуклеотидные замены в пределах экзонов вообще не влияют на структуру кодируемого белка. Такие замены в ходе эволюции обычно накапливаются вполне свободно. Ученые заметили, что ультраконсервативные участки имеются во всех без исключения генах семейства SR (splicing regulators). Эти гены кодируют белки, участвующие в регуляции альтернативного сплайсинга. Детальный анализ показал, что гены SR сами подвержены альтернативному сплайсингу, причем в результате могут получаться такие мРНК, которые должны уничтожаться системой NMD. Оказалось, что у каждого SR-гена имеются два альтернативных сплайс-варианта. Один из них представляет собой "нормальную" мРНК, которая может служить матрицей для синтеза полноценного SR-белка. Второй содержит преждевременный стоп-кодон и должен уничтожаться цензурой. Эксперименты показали, что этот второй сплайс-вариант действительно активно уничтожается системой NMD. Обнаруженный регуляторный контур работает по принципу отрицательной обратной связи. SR-белки могут контролировать альтернативный сплайсинг не только "чужих" мРНК, но и своих собственных. Чем больше производит клетка SR-белков, тем чаще они направляют сплайсинг своих мРНК по альтернативному пути, тем самым снижая темп производства новых SR-белков. Так поддерживается некоторое постоянство концентрации SR-белков в клетке. Как мог возникнуть такой причудливый регуляторный контур? Ведь производство SR-белков вполне могло бы контролироваться каким-нибудь менее экзотическим способом — например, при помощи транскрипционных факторов. Видимо, в данном случае при создании контура обратной связи отбор просто "зацепился" за то, что ближе лежало, а именно за способность SR-белков контролировать альтернативный сплайсинг. Аналогичным образом, активность генов, кодирующих транскрипционные факторы, обычно регулируется не чем-нибудь, а транскрипционными факторами (хотя и исключений немало). Это характерный "почерк" эволюции, совсем не похожий на разумное проектирование, а похожий скорее на самосборку чего получится из чего попало (На это можно возразить, что и человеческое инженерно-техническое творчество тоже часто идет по такому принципу. Но от всемогущего Творца мы все-таки вправе ожидать качественно иного уровня креативности). Десять генов, составляющих SR-семейство, родственны друг другу. Общий предок людей и мышей уже имел все десять, но у него самого когда-то был предок только с одним исходным SR-геном, от которого произошли все остальные путем последовательных дупликаций. Самое удивительное, что механизм саморегуляции с участием альтернативного сплайсинга и цензуры, судя по всему, возникал у разных представителей SR-семейства параллельно и независимо. Это видно из того, что преждевременные стоп-кодоны образуются у них в ходе альтернативного сплайсинга разными способами. У одних SR-генов имеется особый экзон со стоп-кодоном, который в норме вырезается из мРНК вместе с интронами. У других к концу мРНК после "законного" стоп-кодона может быть пришита пара-тройка лишних экзонов, в результате чего законный стоп-кодон с точки зрения системы цензуры начинает выглядеть как преждевременный. Очевидно, SR-гены имеют высокую предрасположенность к формированию таких регуляторных контуров. Ультраконсервативными у людей и мышей обычно являются те участки SR-генов, которые непосредственно прилегают к преждевременному стоп-кодону, — но не всегда и не только. Скорее всего, уникальный консерватизм этих участков обусловлен тем, что они необходимы для правильного сплайсинга. Проверить это предположение трудно, поскольку о молекулярных механизмах сплайсинга нам известно пока очень мало. Вместе с тем у асцидии Ciona (далекого родственника позвоночных животных) тоже есть SR-гены с альтернативными экзонами, несущими преждевременные стоп-кодоны. Нуклеотидные последовательности этих генов похожи на человеческие и мышиные, но все же не идентичны им. Это значит, что ультраконсервативность в данном случае не является абсолютной. Ситуация еще сильнее запуталась совсем недавно, когда удалось экспериментально показать, что удаление некоторых некодирующих ультраконсервативных участков из генома мышей совершенно не вредит их здоровью. Не исключено, что новооткрытый способ генной регуляции распространен довольно широко и затрагивает отнюдь не только гены — регуляторы сплайсинга. Дальнейшие исследования должны пролить свет на этот вопрос. На мой взгляд, данное открытие говорит прежде всего о том, как мало мы еще знаем о жизни клетки и о возможных путях ее эволюционных изменений. Сколько еще подобных открытий предстоит сделать, прежде чем у нас появится достаточно оснований для построения всеобъемлющей эволюционной теории, или, как сейчас говорят, "нового эволюционного синтеза"? Думаю, много. (Источник: Liana F. Lareau, Maki Inada, Richard E. Green, Jordan C. Wengrod, Steven E. Brenner. Unproductive splicing of SR genes associated with highly conserved and ultraconserved DNA elements // Nature. 2007. V. 446. P. 926-929.) |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||