|
||||
|
|
ГЛАВА 8. НАСЛЕДУЮТСЯ ЛИ ПРИОБРЕТЕННЫЕ ПРИЗНАКИ?От Ламарка к ДарвинуОтдельные эволюционные идеи высказывались учеными и философами еще в античные времена (Автором двух важнейших эволюционных идей, или моделей, — естественного отбора и "блочной сборки" — был древнегреческий философ Эмпедокл. Он полагал, что живые существа возникли в результате случайного комбинирования частей — голов, рук, ног и т. п. — и последующего отбора удачных вариантов. Другой древний философ, Анаксимандр, в полном соответствии с данными современной науки утверждал, что предками людей были рыбы), и в новое время традиция продолжилась. Дарвин был далеко не первым, кто выступил против догмата о неизменности раз и навсегда сотворенных видов. Считается, что первую более-менее последовательную и внутренне непротиворечивую теорию эволюции живых организмов придумал в начале XIX века Жан Батист Ламарк. В основе теории Ламарка лежали два предположения: о наследовании приобретенных признаков и о внутренне присущем всему живому стремлении к совершенству. Первое из этих предположений объясняло, почему организмы так хорошо приспособлены к условиям своего существования. В течение жизни они используют свои органы по-разному: одни — чаще и интенсивнее, другие — реже и слабее. Те органы, которые все время тренируются, крепнут и растут, а те, которые почти или вовсе не используются, постепенно уменьшаются и слабеют. Небольшие изменения, возникающие вследствие такой избирательной тренировки органов, передаются по наследству потомкам. Например, если животное питается листьями высоких деревьев, ему приходится все время вытягивать шею. Шея тренируется, крепнет и немножко удлиняется. Потомство такого животного получит уже от рождения немного более длинную шею. Так, по мнению Ламарка, появились жирафы. Если какая-то птица перестает летать, переходит к наземной жизни, то ее крылья от долгого неупотребления атрофируются. Так возникли нелетающие птицы с рудиментарными крыльями. Второе предположение Ламарка — внутренняя "тяга к совершенству". Оно объясняло постепенное усложнение организмов, появление новых органов и тканей. Время от времени некоторые ученые продолжают возвращаться к этой идее Ламарка. Например, известный палеонтолог, эволюционист и философ-богослов Пьер Тейяр де Шарден, один из первооткрывателей знаменитого пекинского синантропа, полагал, что неуклонно происходящее в ходе эволюции повышение уровня организации живых существ не может быть объяснено отбором случайных мутаций и служит доказательством присутствия какой-то особой направляющей силы. Шарден называл ее "радиальной энергией", потому что, по его мнению, она движет эволюцию к некому абсолютному средоточию, или центру, к "точке Омега". Что же изменил Дарвин в теории Ламарка? Он отказался от второй посылки своего предшественника, от "тяги к совершенству", и предложил гораздо более простой и понятный механизм эволюционных изменений, которого теория Ламарка не предусматривала, — естественный отбор. Механизм эволюции, по Дарвину, основан на четырех базовых принципах. Первый из них — это борьба за существование: она происходит оттого, что каждый организм производит заведомо больше потомков, чем способно выжить. Второй — изменчивость: Дарвин еще не знал о генетике и не мог точно сформулировать причины и законы изменчивости, но сам факт был очевиден — все организмы немножко разные. Третий принцип — избирательное выживание или избирательное размножение наиболее приспособленных — это и есть собственно естественный отбор. И наконец, четвертая основа эволюции — это наследственность, благодаря которой свойства, обеспечившие данной особи победу в борьбе, передаются ее потомству. В силу странного стечения обстоятельств сейчас, когда противопоставляют "дарвинизм" "ламаркизму", имеют в виду вовсе не отношение к идее "стремления к совершенству", то есть вовсе не то, что действительно различало взгляды двух великих естествоиспытателей. Сложилось ошибочное мнение, что Дарвин якобы опроверг первый постулат Ламарка о наследовании приобретенных признаков и доказал, что наследуются только признаки врожденные. На самом деле Дарвин не только не отвергал эту ламарковскую идею — напротив, она многократно упоминается в знаменитом "Происхождении видов" и признается Дарвином как самоочевидная (Например, в главе 14 "Происхождения видов" ( http://charles-darwin.narod.ru/origin-content.html) Дарвин отмечает: "Изучение наших домашних форм указывает нам, что неупотребление органов ведет к их уменьшению и что результаты неупотребления могут передаваться по наследству"). Дарвин даже развил ее, выдвинув в книге "Изменения животных и растений при одомашнении" теорию пангенеза. Этот факт часто замалчивался сторонниками синтетической теории эволюции (СТЭ), которая сложилась в начале — середине XX века из сплава учения Дарвина и достижений генетики. И это неудивительно, ведь дарвиновская теория пангенеза противоречит основной догме неодарвинизма — утверждению, согласно которому вся информация может передаваться от генов к белкам только в одном направлении, то есть по принципу "генотип определяет фенотип". Теория пангенеза была призвана объяснить механизм наследования приобретенных признаков. Дарвин предположил (не забываем, что дело происходило до возникновения генетики), что в клетках организма образуются особые мелкие частицы. Он назвал их "геммулами", или "пангенами". Геммулы содержат в себе сведения о тех изменениях, которые клетки претерпели в течение жизни. С током крови геммулы разносятся по организму и в конце концов проникают в половые клетки. Таким образом потомству передается информация о приобретенных признаках. Догма о невозможности наследования приобретенных признаков начала складываться через несколько лет после смерти Дарвина, в основном благодаря усилиям немецкого ученого Августа Вейсмана. Он показал, что, если отрубать крысам из поколения в поколение хвосты, это не приводит к рождению бесхвостых крысят. Другой эксперимент состоял в том, что черным мышам пересаживали яичники белых мышей. У тех мышек, которым удавалось выжить после этой экзекуции, мышата рождались белые. На основании этих и других подобных экспериментов был сформулирован принцип "Вейсмановского барьера": клетки тела не могут передавать информацию половым клеткам. Следовательно, ни внешние воздействия, ни приобретенный опыт, ни упражнение органов не могут приводить к адекватному или хотя бы отчасти неслучайному изменению наследственности. Развитие молекулярной биологии еще сильнее укрепило в сознании ученых этот барьер, действительно превратив его в догму. Было установлено, что наследственная информация записана в молекулах ДНК особым кодом, который был расшифрован в 60-е годы XX века. Информация, записанная в ДНК, сначала должна быть "переписана" на молекулу РНК. Затем специальные сложные молекулярные комплексы — рибосомы — считывают информацию с молекулы РНК, синтезируя молекулу белка в точном соответствии с записанной в РНК инструкцией. Белки выполняют огромное множество функций, и в конечном счете именно они в основном определяют облик организма (фенотип). Таким образом, информация движется в одном направлении — от ДНК к РНК, от РНК — к белкам. Никаких механизмов переноса информации в обратную сторону — от белков к РНК или от РНК к ДНК — поначалу обнаружено не было, что и укрепило веру в невозможность такого переноса. Потом, правда, оказалось, что есть вирусы, у которых хранилищем наследственной информации служат молекулы РНК (а не ДНК, как у всех прочих организмов), и у них есть специальные ферменты, которые умеют осуществлять обратную транскрипцию, то есть переписывать информацию из РНК в ДНК. Созданная таким путем ДНК встраивается в хромосомы клетки-хозяина и размножается вместе с ними. Поэтому с такими вирусами очень трудно бороться (один из них — это вирус ВИЧ). Но вот "обратной трансляции" — переписывания информации из белков в РНК — так ни у кого и не обнаружили. По-видимому, такого явления в природе действительно не существует. Обратная трансляция. У современных живых организмов обратная трансляция — переписывание информации с белка на РНК, — судя по всему, не встречается. Однако японскому исследователю Масаюки Насимото в 2001 году удалось экспериментально показать принципиальную возможность обратной трансляции. Насимото изготовил молекулу РНК, которая может совершать два действия. Во-первых, узнавать аминокислоту аргинин и присоединяться к ней. Во-вторых, прикреплять к другой молекуле РНК, которая потом будет кодировать белок, триплет нуклеотидов АГГ, то есть кодон, соответствующий аргинину. Рибозим, изготовленный Насимото, с полным правом можно назвать "обратной тРНК". Напомню, что обычные транспортные РНК (тРНК) узнают кодон на молекуле мРНК и прикрепляют к синтезируемой молекуле белка соответствующую этому кодону аминокислоту. "Обратная тРНК", изготовленная Насимото, совершает противоположное действие: узнает аминокислоту, входящую в состав белковой молекулы, и прикрепляет к синтезируемой молекуле мРНК кодон, соответствующий этой аминокислоте. Таким образом, осуществляется процесс, прямо противоположный трансляции: информация переписывается не с РНК на белок, а, наоборот, с белка на РНК. При помощи таких "обратных тРНК" обратная трансляция, по предположению Насимото, могла происходить в РНК-мире (см. главу 1). Теоретически можно представить себе ситуацию, когда существовало некое равновесие между процессами прямой и обратной трансляции. Молекулы РНК "кодировали" белки, то есть управляли их синтезом, а белки, в свою очередь, управляли синтезом РНК, то есть тоже "кодировали" их. В дальнейшем равновесие сместилось, и белки потеряли способность к кодированию РНК. Возможно, решающую роль в смещении равновесия сыграло то обстоятельство, что молекулы РНК в отличие от белков способны самостоятельно контролировать синтез собственных копий на основе принципа комплементарности. Иными словами, РНК и так кодируют сами себя, не нуждаясь для этого в посредничестве белков. С легкой руки одного из первооткрывателей структуры ДНК Френсиса Крика идея об однонаправленной передаче информации в ряду ДНК — РНК — белок стала именоваться "центральной догмой молекулярной биологии" (Crick F. Central Dogma of Molecular Biology // Nature. 1970. V. 227. E 561-563.). Впрочем, позже Крик признался, что использование термина "догма" принесло больше неприятностей, чем оно того стоило. Но всякое действие рождает противодействие. И иногда "лекарство оказывается хуже болезни". В качестве уродливого и страшного противовеса догматизации достижений генетики в СССР утвердилась лысенковщина. Крестьянский сын Трофим Лысенко открыл способ придавать яровым культурам высокую продуктивность, выдерживая их некоторое время на холоде. Молодой экспериментатор был принят на работу в лабораторию Н. И. Вавилова. Трагические последствия этого шага всем известны. Лысенко, пользуясь далеко не научными аргументами и средствами, подчинил себе руководство советской биологической наукой. Генетика и "вейсманизм" были объявлены лженауками. Официально была принята догма, противоположная вейсмановской и основанная на базовом принципе ламаркизма: приобретенные признаки наследуются; определяющим фактором наследственности являются не мифические гены, а воздействие внешней среды. Как это ни парадоксально, Лысенко считался последовательным дарвинистом. Он как раз обвинял Вавилова в отступлении от теории Дарвина и на этом основывал свои "научные" обвинения. Торжество лысенковщины в СССР и особенно репрессии против генетиков привели к окончательной дискредитации ламаркизма на Западе и догматизации принципа Вейсмана. Наука в очередной раз смешалась с политикой, что ей категорически противопоказано. Это не пошло на пользу ни советской, ни западной биологии. Два противоположных подхода к проблеме наследственности сошлись в смертельной схватке. Вопрос состоял уже не в том, могут ли наследоваться приобретенные признаки. Речь шла о борьбе двух "научно-социальных" систем: социалистической лысенковщины и буржуазного вейсманизма. После того как Лысенко утратил свое влияние, советская биология постепенно вернулась в русло мировой науки, вовсю занявшись генетикой. Но последствия этой коллизии дают о себе знать и по сей день: многих генетиков, как российских, так и зарубежных, до сих пор передергивает при одном упоминании о возможности наследования приобретенных признаков. Однако реальные факты показывают, что приобретенные признаки иногда все же могут передаваться по наследству. Безусловно, это происходит редко, это вообще нетипично, и случается такое только с некоторыми специфическими категориями наследственных признаков, которые можно назвать "приобретенными" лишь с определенной долей условности. Такие банальные вещи, как натренированные мышцы или отрезанные хвосты, конечно, не наследуются никогда. Однако по мере того, как наука все глубже проникает в тайны молекулярной организации живой клетки, становится все очевиднее, что организмы не передают своим потомкам приобретенные ими в течение жизни свойства не потому, что не могут, а потому, что не хотят. С чисто "технической" точки зрения определенные возможности такого рода у живых организмов имеются. Конечно, изменения, происходящие в клетках тела в течение жизни, отражаются в первую очередь на белках, но не только. В каждой клетке есть и РНК, и ДНК, и изменения могут затронуть и их тоже. Перед каждым клеточным делением все молекулы ДНК в клетке удваиваются: ферменты ДНК-зависимые ДНК-полимеразы синтезируют точные копии имеющихся ДНК, которые потом распределяются между дочерними клетками. Однако при копировании иногда возникают ошибки — мутации. Если мутация возникает при образовании половой клетки, она, естественно, передается по наследству. В ортодоксальной СТЭ образца начала 60-х годов ХХ века было принято считать, что мутации происходят совершенно случайно (теперь мы знаем, что это не всегда так: см. главу "Управляемые мутации"). Так возникает изменчивость, служащая материалом для естественного отбора. Но мутации могут происходить при делении любых клеток тела, а не только при образовании яйцеклеток и сперматозоидов. Такие мутации называются соматическими, от "сома" — тело. Они приводят к возникновению участков измененных тканей. Соматические мутации могут быть вызваны различными воздействиями внешней среды и в какой-то мере отражают эти воздействия, то есть несут некую информацию о них. Маловероятно, чтобы такого рода информация могла оказаться полезной следующим поколениям. Хотя возможно и такое, особенно если речь идет о контролируемых перестройках генома соматических клеток, о которых мы говорили в главе "Управляемые мутации". Тем не менее, если бы соматические мутации могли наследоваться, это вполне можно было бы назвать "наследованием приобретенных признаков", хоть и не совсем в том смысле, который вкладывал в это понятие Ламарк. Классическая генетика отрицает возможность наследования соматических мутаций. Считается, что изменения клеток тела никак не могут отразиться на генах половых клеток. По-видимому, в большинстве случаев это утверждение справедливо. Но природа, сколько бы мы ее ни изучали, всегда остается неизмеримо сложнее любых наших теорий, моделей и прогнозов. И из всякого придуманного нами "закона" обязательно находятся исключения. В данном случае исключения тоже существуют. Горизонтальный обмен генамиУ одноклеточных организмов, понятное дело, нет разделения на соматические и половые клетки. Их единственная клетка является одновременно и половой, и соматической, и любые произошедшие в ней изменения генов беспрепятственно и неизбежно передаются потомкам. А гены у одноклеточных организмов изменяются довольно часто. И это не только мутации. У них очень широко распространен так называемый горизонтальный обмен генетическим материалом. Три способа горизонтального обмена генами у бактерий: конъюгация: две бактерии соединяются при помощи специальных белковых трубочек — конъюгационных пилей, и бактерия-донор передает бактерии-реципиенту часть своего генома; вирусная трансдукция: вирусы, переходя из одной бактерии в другую, могут прихватывать с собой куски бактериального генома; естественная трансформация: иногда бактерия просто "всасывает" фрагменты ДНК из окружающей среды и при определенных условиях встраивает их в свой геном. Как мы помним из главы "Великий симбиоз", этот способ межвидового генетического обмена мог сыграть важную роль в становлении эукариотической клетки. Когда бактерия встраивает в свою единственную кольцевую хромосому кусочки чужого генома, она меняет свои свойства, то есть фактически превращается в другой организм. Новые свойства — "приобретенные признаки", — естественно, передаются потомству. В предельном случае возможна даже полная замена собственного генома бактерии чужим геномом. Если последний получен от другого вида бактерий, происходит нечто совершенно чудесное: бактериальная клетка в одночасье меняет свою видовую принадлежность. Микроб, относящийся к виду А, трансформируется в микроба вида Б. Самое удивительное, что это не чисто теоретические рассуждения, а экспериментально доказанный факт. Он был установлен в 2007 году исследователями из института Крейга Вентера (США). Первая в мире операция по пересадке генома позволила превратить один вид бактерий в другой. Ученые из Института Крейга Вентера в течение последних 10 лет уверенно идут к великой цели — созданию искусственных микроорганизмов с заданными свойствами. Практическое значение этих работ может оказаться огромным. Например, планируется создание микробов, которые будут в больших количествах производить дешевое топливо. Генеральная идея состоит в том, чтобы установить минимальный набор генов, необходимый для жизнеобеспечения бактерии, добавить туда гены, кодирующие полезные функции, например, синтез водорода, искусственно синтезировать спроектированный геном и внедрить его в живую бактерию. Ее собственный геном при этом должен быть каким-то образом удален. Работы ведутся в основном с бактериями рода Mycoplasma.
Микоплазмы — довольно обширная (около 180 видов) группа паразитических бактерий, вызывающих всевозможные болезни у растений, животных и человека. Микоплазмы обладают рядом уникальных свойств, которые делают их весьма удобным объектом для подобных исследований. Геномы микоплазм очень малы — от 600 до 1400 тыс. пар нуклеотидов — и хорошо изучены. На сегодняшний день полностью прочтены геномы 14 видов микоплазм. В отличие от подавляющего большинства других бактерий с маленькими геномами микоплазмы не являются облигатными внутриклеточными паразитами. Они могут жить вне хозяйских клеток, поэтому их можно выращивать обычным образом на питательной среде. Правда, среда должна быть весьма богатой: микоплазмы очень требовательны в этом отношении, поскольку у них отсутствуют гены, необходимые для синтеза многих жизненно важных веществ. Наконец, у микоплазм нет жесткой клеточной стенки, характерной для большинства бактерий. Клетки микоплазм окружены лишь тонкой и эластичной мембраной. Это сильно облегчает обмен наследственным материалом между клетками. Изучая геномы микоплазм, Крейг Вентер и его коллеги уже очень близко подошли к пониманию того, что должен представлять собой "минимальный геном" будущих искусственных микробов. Синтез искусственных фрагментов генома уже налажен, синтез целого бактериального генома — дело недалекого будущего. Биологи давно научились внедрять в бактерий отдельные фрагменты геномов. В этом ученым большую помощь оказывают имеющиеся у микробов естественные механизмы для обмена генетическим материалом. Однако до сих пор никому не удавалось пересадить целый геном в живую бактериальную клетку. В июне 2007 года Крейг Вентер и его сотрудники сообщили о первой успешной трансплантации целого генома от одного вида бактерий другому. Правда, ученые пока сами не до конца понимают, как им это удалось и пройдет ли этот номер с другими видами бактерий. Сделано было следующее. Ученые выделили геном из бактерии Mycoplasma mycoides, которая вызывает пневмонию у коров. Геном этого микроба, как и у большинства бактерий, представляет собой одну кольцевую молекулу ДНК. Геном был тщательно очищен от посторонних примесей, в том числе от белков, и добавлен в культуру бактерий Mycoplasma capricolum, возбудителей козьего полиартрита. Предварительно в геном М. mycoides были внесены особые метки, в том числе гены устойчивости к антибиотикам. По этим меткам можно потом определить, успешно ли прошла трансплантация. Спустя недолгое время среди клеток Mycoplasma capricolum появились бактерии с признаками Mycoplasma mycoides. Обработав культуру бактерий антибиотиком, ученые уничтожили тех микробов, которые не вобрали в себя чужую ДНК, а оставшихся подвергли тщательному изучению. По всем признакам это были самые настоящие М. mycoides. Ни генов, ни белков, характерных для исходного вида Mycoplasma capricolum, у них обнаружить не удалось. Антитела, избирательно реагирующие на поверхностные белки Mycoplasma capricolum, не прикреплялись к этим микробам, в отличие от антител, распознающих поверхностные белки Mycoplasma mycoides. Все это свидетельствует о том, что пересадка генома полностью удалась. Авторы предполагают, что бактерии "проглатывали" чужую молекулу ДНК, и в первый момент в них, вероятно, содержались оба генома вместе. Когда такая клетка делилась, одна из дочерних клеток получала геном Mycoplasma capricolum, а другая — геном Mycoplasma mycoides. Последующая обработка антибиотиком уничтожила клетки первого типа. Дальнейшие исследования покажут, можно ли проделывать подобную манипуляцию с другими бактериями и другими геномами. Не исключено, что вобрать в себя целый чужой геном способны только микробы, не имеющие клеточной стенки, — в этом случае микоплазмы, скорее всего, и впредь останутся единственными объектами для таких экспериментов. Так или иначе, проделанная работа сильно приблизила Крейга Вентера к его заветной цели — созданию искусственного микроба. По-видимому, эта цель может быть достигнута уже через несколько лет. Кстати сказать, в США сейчас активно дискутируются этические и юридические проблемы, связанные с близящимся созданием искусственных организмов. Самые горячие споры идут по вопросу о том, можно ли будет эти организмы патентовать. (Источник: Lartigue С. et al. Genome Transplantation in Bacteria: Changing One Species to Another // Science. 2007. V. 317. P. 632-638.) У многоклеточных горизонтальный обмен генами между неродственными организмами играет гораздо меньшую роль. Вместо него развились более совершенные механизмы перемешивания и перекомбинирования наследственной информации, связанные с половым размножением. По сути дела это тот же самый горизонтальный обмен, но только замкнутый в пределах вида (разные особи смешивают свои гены в потомстве, но с представителями других видов обмен генами резко ограничен). К тому же половые железы у животных действительно ограждены от влияний внешней среды особым "вейсмановским" барьером, через который могут проникать только очень немногие вещества, в основном небольшие молекулы. Тем не менее многоклеточные животные и растения время от времени заимствуют гены у микроорганизмов, например, у паразитических или симбиотических бактерий. Поскольку эти бактерии, в свою очередь, могут заимствовать гены у своих хозяев, а также переходить от одного хозяина к другому, они могут служить посредниками при переносе генетического материала между разными видами хозяев. По-видимому, это происходит чрезвычайно редко. Надежные экспериментальные подтверждения переноса генов от бактерий к многоклеточным были получены только недавно, и их пока очень мало. Но нужно иметь в виду, что редкость события вовсе не обязательно означает, что его роль в эволюции мала и незначительна. Ведь ключевые эволюционные преобразования сами по себе являются весьма редкими событиями — это, что называется, "штучный товар". Роль горизонтального переноса генов в эволюции многоклеточных еще предстоит оценить, и некоторые косвенные данные свидетельствуют о том, что она может быть весьма велика. Рассмотрим один из случаев переноса генов бактерий в геном многоклеточного животного, обнаруженный в 2007 году. В данном случае "донором" генетического материала была паразитическая бактерия вольбахия, а "реципиентом" — мушка дрозофила. Этот случай интересен тем, что в геном насекомого встроились не отдельные гены, а целый бактериальный геном.
Вольбахия — паразитическая бактерия, обитающая в клетках многих наземных и пресноводных членистоногих и круглых червей — филярий. Вольбахию называют микробом-манипулятором, поскольку она научилась при помощи специальных регуляторных белков управлять размножением и развитием своим хозяев. Например, она умеет превращать самцов в самок, избирательно убивать зародышей мужского пола, повышать плодовитость зараженных самок и даже делать бесплодными самок, которые ею не заражены. О том, как ей это удается, можно прочесть в популярных статьях: А. В. Марков. Антимужской микроб, http://elementy.ru/lib/164668, А. В. Марков, И. А. Захаров-Гезехус. Бактерия вольбахия — повелитель мух. http://evolbiol.ru/wolbachia.htm. Вольбахия "впрыскивает" регуляторные белки в цитоплазму хозяина при помощи модифицированного конъюгационного аппарата, то есть поступает примерно так же, как ее дальняя родственница агробактерия — природный генный инженер, о котором мы говорили в заключительной части главы "Управляемые мутации". Вольбахия паразитирует в клетках беспозвоночных уже более 100 миллионов лет, да и ее предки — альфапротеобактерии из группы риккетсиевых — тоже были внутриклеточными паразитами. За это время вольбахия и ее хозяева успели приспособиться друг к другу. В ряде случаев вольбахия даже повышает жизнеспособность своих хозяев, то есть выступает в роли полезного симбионта. При таком долгом и тесном сожительстве было бы даже странно, если бы какие-то фрагменты генома вольбахии время от времени не попадали в ядра клеток хозяина и не включались в хозяйский геном. Однако доказать это удалось лишь в 2007 году.
Довольно часто в ходе выполнения проектов по прочтению геномов высших организмов (особенно насекомых) исследователи натыкались на фрагменты бактериальных последовательностей ДНК, но это обычно интерпретировалось как результат загрязнения: предполагали, что при выделении ДНК из клеток исследуемого организма в пробы попало небольшое количество бактериальной ДНК. И соответствующие участки ДНК просто не учитывались при "сборке" генома из прочтенных фрагментов. В середине 2007 года группа американских ученых предприняла широкомасштабный анализ таких "загрязнений" с целью найти реальные случаи переноса генов вольбахии в геномы животных-хозяев (Julie С. Dunning Нotopp et al. Widespread Lateral Gene Transfer from Intracellular Bacteria to Multicellular Eukaryotes // Science. 2007. V 317. P 1753-1756.). Ученые выделяли ДНК из разных видов насекомых и круглых червей — филярий, а также анализировали накопленные в Генбанке (http://www.ncbi.nlm.nih.gov/Genbank/) данные по нуклеотидным последовательностям различных беспозвоночных. Надо сказать, что многие прочтенные "вчерне" геномы до сих пор не подвергались процедуре окончательной сборки. Они хранятся в компьютерных базах в виде набора разрозненных, частично перекрывающихся обрывков разной длины. Если перенос генов от внутриклеточных бактерий к хозяевам действительно имеет место, среди этих обрывков могут обнаружиться такие куски ДНК, которые содержат одновременно и эукариотические, и бактериальные участки. Именно такие обрывки и интересовали исследователей. В результате для четырех видов насекомых и четырех видов филярий удалось получить бесспорные доказательства внедрения генов вольбахии в геном хозяина; еще у трех видов это можно предполагать с большой долей вероятности. Наибольшее внимание авторы уделили тропической плодовой мушке Drosopbila ananassae, потому что в геноме некоторых представителей этого вида обнаружились полные или почти полные копии генома вольбахии. Получается, что в ядрах клеток этих мушек содержится полная генетическая информация сразу о двух разных организмах! Для проверки этого результата ученые провели целый ряд специальных тестов. Мушек вылечили от вольбахии антибиотиком и убедились, что лечение привело к полному исчезновению внутриклеточных паразитов. Из вылеченных мух снова выделили ДНК. Оказалось, что полный набор генов вольбахии по-прежнему присутствует в пробах. Затем проверили наследуемость этих генов по мужской линии. Дело в том, что вольбахия, как и другие цитоплазматические бактерии (вспомним митохондрии!), передается потомству только по материнской линии, вместе с цитоплазмой яйцеклетки. В сперматозоиды вольбахия не проникает — они для этого слишком малы. Поэтому потомство зараженной самки всегда оказывается зараженным, потомство здоровой — здоровым, а от отца это не зависит. Однако если геном вольбахии действительно встроился в геном хозяина, то он должен передаваться по отцовской линии точно так же, как и по материнской, — вместе с ядерными хромосомами. Чтобы проверить это, скрестили вылеченных самцов D. ananassae, в хромосомы которых встроился геном вольбахии, со здоровыми самками, в геноме которых гены вольбахии отсутствовали. В ДНК потомства обнаружились гены вольбахии, что и стало решающим доказательством горизонтального переноса генов от паразита к хозяину. Авторы также показали, что многие гены, заимствованные мухой у бактерии, активно работают (то есть транскрибируются, "считываются"). Полученные результаты показывают, что межвидовой обмен генами может играть более существенную роль в эволюции животных, чем считалось ранее. Источниками нового генетического материала для животных могут служить не только вирусы и мобильные генетические элементы, что было известно и ранее, но и бактерии. Впрочем, пока трудно сказать, насколько широк спектр бактерий, гены которых могут быть заимствованы животными. Горизонтальный перенос генов привлекает в последние десятилетия пристальное внимание ученых — и отнюдь не только потому, что в некоторых случаях он может приводить к "ламарковскому" наследованию. Широкое распространение горизонтального переноса в живой природе заставляет пересмотреть еще одно основополагающее положение классического дарвинизма и СТЭ, а именно — точку зрения об исключительно дивергентном характере эволюции. "Дивергенция" означает "расхождение". Долгое время эволюционная теория базировалась на представлении о том, что виды не могут обмениваться друг с другом наследственной информацией. Как только вид делится на два, потомки теряют способность скрещиваться друг с другом, между ними возникает репродуктивная изоляция. Так что после разделения они эволюционируют изолированно, сами по себе, по схеме "случайные мутации + естественный отбор".
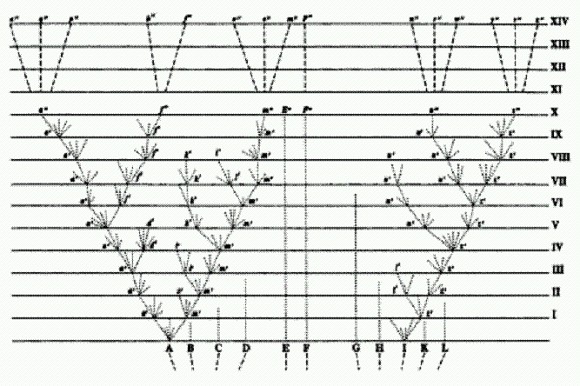
Дарвиновская схема дивергенции. Классический взгляд на эволюцию отражен в знаменитой дарвиновской "схеме дивергенции". Это единственный рисунок, которым Чарльз Дарвин сопроводил свой великий труд о происхождении видов. Эволюционный процесс на нем представлен в виде ветвящегося древа. Исходный вид делится на насколько ветвей — новых видов. Каждая ветвь может делиться дальше, и так до бесконечности. Отсутствие поперечных перемычек между ветвями показывает, что каждый вид эволюционирует сам по себе. Он должен самостоятельно изобретать все полезные адаптации, он не может "посоветоваться" с другими видами, перенять их опыт, заимствовать их "открытия".
Классическая схема дивергенции по Дарвину имеет вид древа, ветви которого, раз разделившись, уже никогда более не сливаются. Примерно так же выглядят практически все эволюционные реконструкции, публикуемые в научных статьях вплоть до настоящего времени. Однако некоторые исследователи выражали сомнение в том, что при такой изолированной эволюции на основе мутаций и отбора жизнь успела бы за сравнительно недолгий срок своего существования (4 млрд лет) развиться от простейших форм до таких высокоорганизованных, как млекопитающие или насекомые.
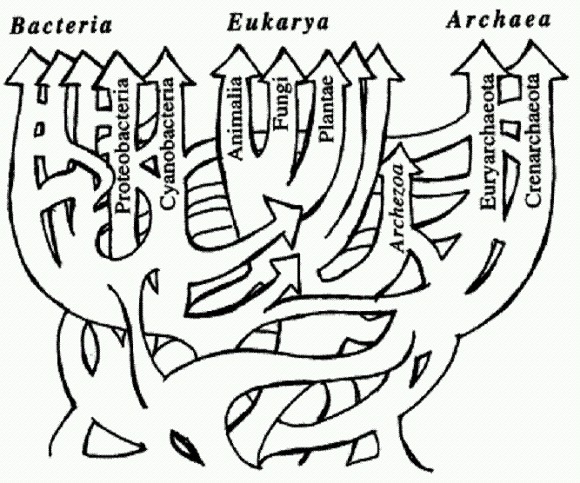
Схема эволюции жизни с учетом горизонтального переноса генов похожа не на дерево, а на запутанную сеть. Из статьи W. F. Doolittle. Phylogenetic Classification and the Universal Tree // Science. 1999. V 284. P. 2124-2128. С открытием горизонтального переноса генов между разными видами и даже царствами живых организмов ситуация изменилась, и эволюция предстает в несколько ином свете. Получается, что "удачные изобретения" одних видов в принципе доступны другим и могут быть ими заимствованы. В этом случае биосфера предстает единой информационной средой, в которой вирусы и различные мобильные генетические элементы (см. ниже) распространяют информацию примерно так же, как в человеческом обществе благодаря устной и письменной речи достижения и открытия одних людей становятся известными другим и могут ими использоваться. Горизонтальный обмен генами вовсе не является бесконтрольным и неограниченным. Он не таков даже у прокариот, которые обмениваются генами относительно свободно и в каком-то смысле могут рассматриваться как единый, огромный и невероятно полиморфный вид. Уже у прокариот выработались различные механизмы выбора партнеров по обмену генами, и чаще всего такой обмен происходит все-таки между родственниками. Эукариоты выработали гораздо более эффективные и сложные адаптации для того, чтобы ограничивать и контролировать этот процесс. Важнейшими из этих адаптаций являются половое размножение и репродуктивная изоляция видов. Именно появление полового размножения и репродуктивной изоляции привело к формированию биологических систем нового типа — эндогамных видов. Эндогамия — избирательное скрещивание с себе подобными, со "своими", в отличие от экзогамии — скрещивания с "чужаками". Однако межвидовая репродуктивная изоляция у эукариот все-таки не абсолютна. В частности, эукариоты тоже способны заимствовать чужие гены. Горизонтальный обмен фактически превращает биосферу в единую "лабораторию" по изобретению новых полезных наследственных признаков. Правда, эффективность работы этой эволюционной лаборатории резко снижается по мере роста сложности организмов и их приспособленности. Большая часть адаптаций у сложных организмов зависит не от одного-двух, а от множества генов, которые должны работать согласованно и которые влияют не только на данный признак, но и на множество других. Поэтому вероятность того, что привнесенный извне чужой ген окажется полезным, у высших организмов значительно меньше, чем у низших. Именно этим, по-видимому, объясняется тот факт, что многоклеточные организмы выработали эффективные, хотя и не абсолютные, средства защиты от горизонтального переноса. Горизонтальный обмен генами может заменить животным половое размножение. Завершая разговор о горизонтальном переносе генов, нельзя не упомянуть о замечательном открытии, сделанном в конце 2008 года. Как выяснилось, существует целый класс многоклеточных животных, для которых горизонтальный обмен генами с неродственными организмами — не исключение, а норма. Разговор об этом открытии нам придется начать издалека. Как мы уже знаем, горизонтальный обмен генами и половое размножение — явления родственные, сходные по своему биологическому смыслу и эволюционной роли. В обоих случаях происходит смешивание генов разных организмов в одном геноме — "межорганизменная генетическая рекомбинация". Прокариоты не способны к настоящему половому размножению и практикуют горизонтальный обмен. Многоклеточные эукариоты предпочитают размножаться половым путем, а горизонтальный обмен пытаются ограничить. Но что происходит с теми многоклеточными, которые по тем или иным причинам отказались от полового размножения? Могут ли они вернуться к более древнему способу межорганизменной рекомбинации — горизонтальному обмену? Существует множество теорий, объясняющих, почему половое размножение получило такое широкое распространение в живой природе (см. одну из них в статье В. П. Щербакова http://elementy.ru/lib/430413). Животные довольно легко утрачивают половое размножение и переходят к партеногенезу, то есть к развитию из неоплодотворенных яиц. Такое не раз происходило и продолжает происходить в разных эволюционных линиях (лишь у одних млекопитающих переход к партеногенезу принципиально невозможен, так как у них многие жизненно важные гены в яйцеклетке отключены, а их работающие копии могут быть получены только со сперматозоидом — см. ниже врезку "Геномный импринтинг"). Однако все виды (или небольшие группы видов) животных, лишенных полового размножения, являются молодыми, они лишь недавно произошли от "нормальных" двуполых предков. Это значит, что виды, отказавшиеся от полового размножения, имеют тенденцию очень быстро вымирать. Они не успевают дивергировать и дать начало, допустим, целому бесполому семейству или отряду. "Очень быстро" по эволюционным масштабам времени — это может означать десятки и сотни тысяч лет, в крайнем случае, первые миллионы. Бделлоидные коловратки (Bdelloidea) — микроскопические обитатели водоемов, одни из самых мелких многоклеточных животных — представляют собой удивительное исключение. Это целый класс животных (около 400 видов), размножающихся исключительно бесполым путем (партеногенетически). Никто никогда не видел самцов бделлоидных коловраток, и, судя по всему, они живут так уже много десятков миллионов лет. Почему все животные не берут пример с коловраток? Бделлоидные коловратки — главный камень преткновения для всех теоретиков, пытающихся объяснить биологический смысл полового размножения. Какое ни придумай объяснение, сразу же возникает "проклятый" вопрос: если половое размножение такое полезное, как же бделлоидные коловратки без него обходятся? И если бделлоидные коловратки нашли способ без него обходиться, почему другие животные не пошли по тому же пути? Ведь половое размножение — весьма "дорогое удовольствие" с точки зрения естественного отбора. При бесполом размножении вы передаете каждому потомку все свои гены, а при половом — только половину. Между тем естественный отбор по определению благоприятствует тем организмам, которые наиболее эффективно "тиражируют" свои гены в следующих поколениях. За половое размножение приходится платить двукратным снижением этой эффективности. Выдающийся биолог Джон Мэйнард Смит назвал этот парадокс "двойной ценой пола" (twofold cost of sex). Другой выдающийся биолог и популяризатор науки, Ричард Докинз, в книге "Рассказ прародителя" подчеркивает, что любое теоретическое построение, указывающее на преимущества полового размножения, обязательно должно как-то объяснять парадокс бделлоидных коловраток (или даже начинаться с такого объяснения). Лишь в 2008 году этот парадокс удалось объяснить. По-видимому, коловратки — единственные животные, которым удалось вернуться к более древнему и примитивному способу межорганизменной рекомбинации — к широкомасштабному горизонтальному обмену генами, который и заменил коловраткам половое размножение. Ученые с факультета молекулярной и клеточной биологии Гарвардского университета, похоже, сумели найти объяснение этой уникальной особенности бделлоидных коловраток. В ходе изучения концевых участков хромосом бделлоидной коловратки Adineta vaga они обнаружили множество генов, не встречающихся ни у каких других животных. Некоторые из этих генов явно имеют бактериальное происхождение: их нуклеотидные последовательности почти идентичны бактериальным аналогам. Другие столь же несомненно происходят от грибов, третьи — от растений. Полные геномы бделлоидных коловраток пока не прочтены. Авторы имели возможность проанализировать лишь около 1% генома изучаемого животного (примерно 1 млн пар нуклеотидов). Были выявлены сотни генов, заимствованных коловратками у представителей других царств живой природы. Степень вероятности того, что данный ген был заимствован не у животного, определялась по сходству нуклеотидной последовательности гена с ближайшим аналогом за пределами животного царства, по сравнению с уровнем сходства между этим геном и его ближайшим "животным" аналогом. Понятно, что таким способом невозможно выявить гены, заимствованные коловратками у других животных или, тем более, у других бделлоидных коловраток. Итак, бделлоидные коловратки активно заимствуют гены у других живых существ. Как мы помним, горизонтальный генетический обмен очень широко распространен у прокариот (бактерий и архей) — он в определенном смысле "заменяет" им половое размножение. Значительно реже меняются генами одноклеточные эукариоты, у которых есть также и настоящий половой процесс (попарное слияние половых клеток). Для многоклеточных горизонтальный генетический обмен — очень большая редкость. Половое размножение, скорее всего, возникло как более безопасная и эффективная альтернатива горизонтальному генетическому обмену. Животные стараются всячески оберегать свои половые клетки от проникновения постороннего генетического материала. У бделлоидных коловраток барьеры, стоящие на пути проникновения чужой ДНК в яйцеклетки, очевидно, сильно ослаблены. Это может быть связано с необычным образом жизни этих микроскопических животных. Они живут в мелких лужах и отлично переносят высыхание на любой стадии жизненного цикла. Потом их, как пыль, может перенести ветром в другую лужу. Однако при высыхании мембраны клеток могут повреждаться, что облегчает проникновение чужеродной ДНК. При высыхании также образуются разрывы в хромосомах, которые клеткам приходится зашивать, когда коловратка снова размокнет. В ходе починки (репарации) разорванных хромосом имеется большая вероятность случайного включения в хромосому чужеродного фрагмента. Ученые показали, что по крайней мере некоторые из заимствованных генов реально работают в клетках коловраток и кодируют функциональные белки. Большинство генов, заимствованных коловратками у бактерий, грибов и растений, кодируют ферменты, не входящие в состав сложных биохимических путей и каскадов, а выполняющие какую-то самостоятельную биохимическую функцию. Это и понятно, ведь именно такие гены могут оказаться полезными, если их заимствовать поодиночке. Впрочем, есть указания и на то, что иногда гены заимствовались сразу по два. Такие гены расположены в непосредственной близости друг от друга и в геноме бактерий-доноров, и в хромосоме коловратки-реципиента. Авторы не делали попыток выяснить, обмениваются ли бделлоидные коловратки генами между собой. Это технически гораздо более трудная задача, чем обнаружение генетического обмена с бактериями и грибами. Однако едва ли коловратки, охотно заимствующие гены у микробов и растений, имеют при этом какую-то особую систему защиты от инкорпорации генетического материала близких родственников. Если же бделлоидные коловратки хотя бы иногда меняются генами друг с другом, то получается, что они на самом деле не отказались от идеи межорганизменной генетической рекомбинации — перемешивания генов разных родителей в геноме потомства. Они просто вернулись от продвинутого варианта такой рекомбинации (полового процесса) к более примитивному варианту — горизонтальному обмену, который был свойствен их далеким одноклеточным предкам. (Источник: Eugene A. Gladyshev, MatthewW Meselson, Irina R. Arkhipova. Massive Horizontal Gene Transfer in Bdelloid Rotifers// Science. 2008. V. 320. P. 1210-1213.) Симбиоз способствует наследованию признаков "по Ламарку". Помимо горизонтального обмена генами есть еще один важнейший механизм, благодаря которому ветви эволюционного древа могут сливаться. Это образование симбиотических систем — "сверхорганизмов" (см. главу "Великий симбиоз"). У многих симбиотических организмов имеется интересная возможность передавать своим потомкам "приобретенные признаки" таким образом, что создается полное впечатление наследования "по Ламарку". Рассмотрим, к примеру, тлей. В отечественной литературе можно встретить описания экспериментов, которые вроде бы подверждают "ламарковское" наследование у этих насекомых (С. В. Мейен. Закон есть закон? 1974. http://www.znanie-sila.ru/people/issue18.html). Например, приспособление к новому кормовому растению у тлей может происходить в ходе партеногенетического (бесполого) размножения, когда потомство развивается из неоплодотворенных яиц и является точной генетической копией матери. При половом размножении происходит перемешивание родительских генов и могут появиться новые удачные генетические комбинации, которые и будут подхвачены отбором. Но при бесполом размножении, казалось бы, можно рассчитывать только на возникновение новых полезных мутаций, а это все-таки вещь довольно редкая. Но тли тем не менее приспосабливаются к новой диете сравнительно быстро — всего за десяток поколений. Возможно, дело тут в том, что тли, как и все насекомые, питающиеся растительными соками, представляют собой симбиотические организмы. Как мы помним из главы "Великий симбиоз", в клетках тлей живут бактериальные симбионты, которые обеспечивают хозяина необходимыми питательными веществами, отсутствующими в растительном соке. За жизнь одного поколения тлей в их клетках могут смениться несколько поколений бактерий, причем симбионты, получая необычную пищу (сок другого растения) будут подвергаться интенсивному отбору. Бактерий много, размножаются они быстро, и вероятность возникновения удачных мутаций хотя бы у некоторых из них достаточно велика. В результате насекомое передаст своему потомству полезный "приобретенный признак" — бактерий-симбионтов с изменившимися наследственными свойствами. Вирусы и мобильные генетические элементыОдин из способов горизонтального обмена генами, от которого не защищены даже многоклеточные, — это вирусный перенос. Известно, что ДНК вируса может встраиваться в геном клетки-хозяина, а потом снова отделяться от него и формировать новые вирусные частицы, которые могут заражать другие клетки. При этом вместе с собственной ДНК вирус может случайно прихватить и кусочек ДНК хозяина и таким образом перенести этот кусочек в другую клетку, в том числе и в клетку другого организма. В большинстве случаев вирусы, размножающиеся в клетках животных, все-таки не могут пробраться сквозь "барьер Вейсмана" и заразить половые клетки. Но все же иногда вирусная инфекция передается потомству. А ведь это не что иное, как наследование приобретенного признака! И неважно, что от такого признака обычно один только вред. Вирус ведь может прихватить с собой и какой- нибудь полезный кусочек ДНК, да и сами вирусные гены могут "пригодиться" хозяину. "Прирученные" вирусы — источник эволюционных новшеств. Хотя вероятность того, что встроившийся вирусный геном принесет хозяину пользу, невелика, целый ряд таких случаев уже известен. Например, гены вируса, встроившегося в геном предка узконосых обезьян свыше 40 млн лет назад, нашли себе несколько применений. Они работают у обезьян и человека в плаценте и выполняют там, по всей видимости, сразу три полезные функции. Первая из них — управление слиянием клеток в ходе формирования наружного слоя плаценты. Этот наружный слой состоит из слившихся клеток, и для его образования необходим какой-то способ нарушать целостность клеточных мембран, то есть протыкать их. Вирусные белки хорошо умеют это делать. Вторая функция — защита эмбриона от иммунной системы матери. Вирусные белки — отличные "специалисты" по подавлению активности иммунной системы. Наконец, третья функция состоит в защите эмбриона от "диких" вирусов. Белки "прирученного" вируса прикрепляются к тем поверхностным белкам человеческих клеток, за которые обычно "цепляются" дикие вирусы, чтобы проникнуть в клетку. В результате диким вирусам становится не за что "ухватиться", и они не могут заразить эмбрион. Другой яркий пример "одомашнивания" вируса описан у наездников — паразитических насекомых, личинки которых развиваются в теле других насекомых, например гусениц. Около 100 млн лет назад предки наездников заразились вирусом и "приручили" его. Геном вируса встроился в геном наездника, и вирусные гены стали помогать насекомому-паразиту бороться с иммунной защитой своих жертв. Самки многих наездников впрыскивают в тело жертвы кроме своих яиц еще и особые "вирусоподобные частицы", внутри которых находятся гены белков, подавляющих иммунитет гусениц. Это позволяет личинкам наездника беспрепятственно развиваться в теле жертвы. Как выяснилось, "вирусоподобные частицы" образуются благодаря деятельности генов прирученного вируса, который давно уже стал неотъемлемой частью генома наездника. Чуть ли не половина генома человека состоит из мобильных генетических элементов (МГЭ) — транспозонов и ретротранспозонов. У других животных и растений дело обстоит примерно так же. У прокариот мобильных элементов меньше, но тоже очень много. Типичный мобильный элемент представляет собой по сути дела упрощенный вариант вируса. МГЭ обладают всеми характерными свойствами вирусов, кроме одного — инфекционности. Вирусы, как известно, могут свободно переходить из одной хозяйской клетки в другую и передаваться горизонтально, то есть заражать другие организмы. МГЭ более ограничены в своих передвижениях. Они могут активно размножаться и перемещаться в пределах генома — перепрыгивать с места на место, встраиваясь в хозяйские хромосомы в разных местах и влияя на работу близлежащих генов. Они, разумеется, передаются вертикально (от родителей к потомкам, то есть наследуются), а иногда и горизонтально — подобно полноценным вирусам. Мобильные генетические элементы впервые были обнаружены Барбарой МакКлинток в 1951 году у кукурузы. Однако МГЭ слишком долго считались "генетической экзотикой", их распространенность и эволюционная роль недооценивались, и в результате свою заслуженную Нобелевскую премию за это открытие МакКлинток получила лишь в 1983 году, когда ей самой было уже за 80. Поначалу эти подвижные вирусоподобные участки генома интерпретировали как "геномных паразитов", "эгоистическую" или "мусорную" ДНК. В последнее время все яснее становится огромная эволюционная роль этих элементов. Они придают геному свойство, которое в зависимости от субъективного восприятия называют либо "нестабильностью", либо "пластичностью". В первом случае подчеркивается потенциальный вред геномных перестроек, индуцируемых МГЭ, во втором — их потенциальная польза, создание материала для отбора, повышение полиморфизма и приспособляемости. МГЭ придают геному нестабильность не только своими беспорядочными прыжками. Если какому-нибудь транспозону удастся как следует размножиться, это значит, что в геноме появится множество одинаковых фрагментов генетического "текста". А это резко повышает вероятность ошибок в ходе копирования ДНК и рекомбинации. Действительно, сложно не ошибиться при переписывании или редактировании текста, изобилующего повторами. Но геномные перестройки, индуцируемые МГЭ, не являются хаотичными. Например, многие транспозоны способны встраиваться не в любое место генома, а только туда, где есть определенные "предпочтительные" для данного МГЭ последовательности нуклеотидов. Это делает их передвижения в известной мере предсказуемыми, закономерными. Распределение повторов по геному повышает вероятность не любых, а строго определенных перестроек. Например, участок генома, заключенный между двумя одинаковыми последовательностями (например, между двумя копиями транспозона), с большой вероятностью может быть "потерян" при репликации. Если такая потеря окажется выгодной, она будет поддержана отбором и закрепится в череде поколений, если нет, отбор будет ее отбраковывать, но тем не менее этот участок все равно будет выпадать из генома снова и снова (такое явление наблюдается, например, у возбудителя чумы Yersinia pestis) (Г. Б. Смирнов. Механизмы приобретения и потери генетической информации бактериальными геномами. 2007. http://evolbiol.ru/smirnov.htm.). Как у бактерий, так и у высших организмов МГЭ могут служить своеобразными "рецепторами стресса", резко активизируя свои прыжки в критических для организма ситуациях и приводя к вспышкам мутагенеза. Это может способствовать приспособляемости видов. Когда условия жизни резко ухудшаются, то это по сути дела означает, что имеющийся у организма геном перестает соответствовать требованиям среды. В этой ситуации рост изменчивости может оказаться единственным возможным выходом (см. главу "Управляемые мутации"). Все это придает эволюционным изменениям, происходящим при участии МГЭ, не совсем случайный характер. Вирусы и мобильные элементы: кто от кого произошел? Родство вирусов и МГЭ не вызывает сомнений, однако не совсем ясно, кто из них появился раньше и кто от кого произошел. Не исключено, что началось все с мобильных элементов, которые могли просто самозародиться в геномах примитивных организмов, и произойти это могло еще на заре жизни. Постепенно усложняясь, МГЭ в дальнейшем превратились в настоящих вирусов. По крайней мере некоторые типы вирусов, скорее всего, возникли именно таким путем. Это прежде всего ретровирусы, к числу которых относится вирус ВИЧ. Ретровирусы отличаются от остальных вирусов тем, что встраивание в хозяйский геном является обязательной частью их жизненного цикла. Наследственный материал ретровируса хранится в форме РНК. Когда ретровирус попадает в клетку, ее рибосомы начинают синтезировать вирусные белки по "инструкциям", записанным в вирусной РНК. Одним из этих белков является фермент обратная транскриптаза (РНК-зависимая ДНК-полимераза), функция которой состоит в переписывании информации из РНК в ДНК. Этот процесс называется обратной транскрипцией; отсюда и "ретро" в названии вируса. Обратная транскриптаза осуществляет "переписывание" вирусного генома в хозяйские хромосомы. Ближайшими родственниками ретровирусов являются ретро-транспозоны — мобильные генетические элементы, широко распространенные в геномах эукариот. Ретровирусы, встроившиеся в геном хозяина, и ретротранспозоны очень похожи друг на друга. Те и другие представляют собой фрагменты ДНК, содержащие более или менее стандартный комплект генов, необходимых для собственного копирования и встраивания в хозяйскую ДНК. Гены эти в большинстве своем сходны у ретровирусов и ретротранспозонов. Обе разновидности "ретроэлементов" размножаются при помощи обратной транскрипции, то есть переписывания информации с РНК на ДНК. Большинство специалистов склоняется к тому, что исторически первыми появились ретротранспозоны, а не ретровирусы. Они проще устроены, и самые простые из них вполне могли "самозародиться" в геномах примитивных организмов в результате случайных мутаций. По-видимому, это произошло еще на уровне прокариот. Ретровирусы, скорее всего, являются результатом некоторого усложнения или, если угодно, "совершенствования" ретротранспозонов. В дальнейшем, конечно, имели место и обратные процессы — ведь ретровирус легко может снова превратиться в ретротранспозон, если потеряет инфекционность в результате какой-нибудь мутации. По-видимому, многие крупные прогрессивные преобразования в эволюции высших организмов были связаны с активностью МГЭ. От "прирученного" ретротранспозона ведет свою родословную фермент теломераза, отвечающий за восстановление кончиков хромомосом, которые имеют обыкновение укорачиваться после каждой репликации. Теломераза играет важную роль в процессах старения и в образовании раковых опухолей. Старение связано с низкой активностью теломеразы, рак — со слишком высокой. Для восстановления кончиков хромосом теломераза использует РНК-матрицу и механизм обратной транскрипции. А это не что иное, как главное "ноу-хау" ретротранспозонов и ретровирусов. Теломеразная регуляция — важнейший механизм поддержания целостности сложного многоклеточного организма, в котором ни одна клетка не имеет права делиться, когда ей вздумается. У мобильных элементов древние позвоночные позаимствовали также и фермент транспозазу, который умеет вырезать и перемещать участки ДНК. Потомки этой транспозазы — белки RAG. Эти белки собирают из кусочков гены антител, по-разному комбинируя фрагменты ДНК в зреющих лимфоцитах. Так достигается огромное разнообразие этих защитных белков при небольшом количестве имеющихся в геноме фрагментов-заготовок (см. главу "Управляемые мутации"). Великолепная иммунная система позвоночных была одной из главных предпосылок их эволюционного успеха. И она, как мы теперь понимаем, является щедрым даром ближайших родственников вирусов.
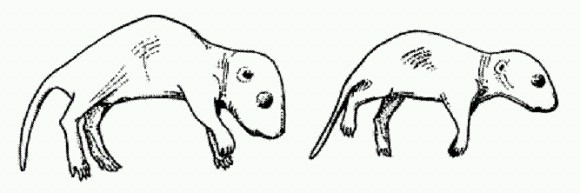
Древние млекопитающие позаимствовали у ретротранспозона ген, необходимый для развития плаценты. Недавно обнаруженный ген Reg10 мог сыграть важную роль в появлении плацентарных млекопитающих. Об этом свидетельствуют результаты исследований сотрудников Токийского медицинского университета. Ученые показали, что у мышиных эмбрионов с выключенным геном Reg10 нарушается развитие плаценты, отчего эмбрион погибает через 10 дней после зачатия. Внешне плацента такого эмбриона выглядит почти нормально, однако в ней отсутствуют некоторые типы клеток, необходимые для эффективной работы органа.
Обычный мышонок (слева) и мышонок с выключенным геном Reg10, которого удалось спасти от верной смерти при помощи пересадки тканей здорового эмбриона. При помощи чрезвычайно сложных манипуляций, связанных с приживлением к дефектному зародышу эмбриональных клеток с нормально работающим геном Reg10, исследователям удалось спасти нескольких обреченных и вырастить из них взрослых мышей, способных к размножению. Правда, они заметно отставали в развитии. При этом ген Reg10 у них по-прежнему не работал. Тем самым было показано, что ген необходим в первую очередь именно для развития плаценты, хотя может выполнять и ряд других, менее важных функций. Обнаружение гена, необходимого для развития плаценты, само по себе очень интересно. Появление плаценты позволило продлить внутриутробное развитие, что, в свою очередь, имело далеко идущие эволюционные последствия. Согласно одной из гипотез, именно плацентарность создала предпосылки для увеличения размеров мозга и быстрого "поумнения" млекопитающих, которое началось около 60 млн лет назад и затронуло только плацентарных. Сумчатые и однопроходные (к которым относятся утконос и ехидна), не имеющие плаценты, так и остались тугодумами. Однако нет никаких оснований говорить, что ген Reg10 "кодирует плаценту". Плацента, хоть и бракованная, развивается и без его помощи. Появление нового эмбрионального органа потребовало согласованных изменений множества разных генов. Reg10 — только один из них. Интересно другое. Ген Reg10 по своей структуре оказался чрезвычайно сходен с мобильным генетическим элементом — ретротранспозоном Sushi-ichi. По-видимому, предки плацентарных млекопитающих подхватили где-то ретротранспозон, который со временем был "приручен", утратил подвижность, а затем один из его генов был рекрутирован для выполнения новой функции — регуляции развития плаценты. (Источник: Ono et al. Deletion of Reg10, an imprinted gene acquired from a retrotransposon, causes early embryonic lethality // Nature Genetics. 2006. V. 38. P. 101-106.) Простейший транспозон устроен еще проще, чем простейший ретротранспозон. Это короткий участок ДНК, на концах которого расположены так называемые обращенные повторы, а в середине имеется ген, кодирующий транспозазу — фермент, необходимый для "размножения" и перемещения мобильного элемента. Обращенные повторы — это последовательности нуклеотидов, комплементарные самим себе (мы помним, что нуклеотид А комплементарен нуклео- тиду Т, нуклеотид Г — нуклеотиду Ц). Последовательности, комплементарные сами себе, называют также палиндромами, потому что они "читаются" при транскрипции одинаково в обе стороны. Вот пример генетического палиндрома: AAGCCCAA..........TTGGGCTT. Если вместо многоточия "вписать" ген транспозазы, получим модель простейшего транспозона. В отличие от ретротранспозонов обычные транспозоны не используют для самокопирования механизм обратной транскрипции, поэтому им не нужна обратная транскриптаза. Чтобы транспозон совершил "прыжок", хозяйская клетка должна для начала прочитать ген транспозазы и синтезировать на его основе белок, то есть саму транспозазу. После этого транспозаза должна найти в хозяйской хромосоме свой транспозон, опознать его по концевым повторам, затем вырезать и вставить в какое-нибудь другое место генома. Итак, транспозаза умеет делать две вещи: 1. узнавать определенные последовательности ДНК и прикрепляться к ним; 2. вырезать и перемещать фрагменты ДНК. Оба "навыка" транспозазы могут быть использованы клеткой, когда ей удается приручить какой-нибудь транспозон, то есть сделать его неотъемлемой функциональной частью своего генома. Для подобных процессов даже придумали специальный термин — "молекулярное одомашнивание" (molecular domestication). Транспозон теряет подвижность просто за счет какой-нибудь мутационной "поломки" и начинает выполнять полезную для организма функцию. Мы уже упоминали о том, что способность прирученных транспозаз — RAG-белков — вырезать и перемещать фрагменты ДНК лежит в основе системы приобретенного иммунитета. Еще больше эволюционных возможностей содержит в себе способность транспозаз распознавать определенные последовательности нуклеотидов ДНК. На специфическом распознавании белками нуклеотидных последовательностей основаны многие важнейшие процессы в живой клетке. Одним из таких процессов является регуляция активности генов при помощи специализированных регуляторных белков — транскрипционных факторов (ТФ). Транскрипционные факторы распознают определенные нуклеотидные последовательности, расположенные в регуляторной области тех или иных генов, присоединяются к ним и тем самым регулируют работу этих генов. Чрезвычайно любопытно, что концевые обращенные повторы многих мобильных элементов, то есть участки ДНК, распознаваемые транспозазами, порой бывают удивительно похожи по последовательности нуклеотидов на сайты связывания ТФ (участки ДНК, распознаваемые транскрипционными факторами). Между прочим, в сайтах связывания ТФ часто встречаются палиндромные мотивы — последовательности ДНК, читающиеся одинаково в обе стороны. Это позволяет предположить, что в ходе эволюции прирученные транспозазы могут иногда брать на себя роль транскрипционных факторов, а фрагменты концевых повторов транспозонов, наверное, могут иногда оказываться в таких позициях, где они способны функционировать в качестве сайтов связывания ТФ. Растения заимствуют гены-регуляторы у "геномных паразитов". В 2007 году был обнаружен первый реальный случай "превращения" прирученной транспозазы в транскрипционный фактор. Открытие было сделано в ходе изучения светочувствительных белков у арабидопсиса — растения из семейства крестоцветных. Как и другие цветковые растения, арабидопсис внимательно следит за освещенностью при помощи сложных молекулярных систем. Это помогает растению оптимизировать свой рост, обмен веществ, выращивать листья и соцветия в "правильное" время. Важную роль в фоторецепции у цветковых играет белок фитохром А, реагирующий на свет с длиной волны 700-750 нм ("дальний красный"). Под действием света фитохром А переходит в биологически активную форму и транспортируется из цитоплазмы в ядро клетки, где он "включает" целый ряд генов, регулирующих цветение и созревание семян. Предполагается, что фитохром А был уже у последнего общего предка цветковых растений и что формирование эффективной светочувствительной регуляторной системы способствовало быстрой экспансии цветковых в меловом периоде. Светозависимый транспорт фитохрома А в ядро осуществляется при помощи белков FHY1 и FHL. Кроме того, были идентифицированы еще два белка — FHY3 и FAR1, без которых транспорт фитохрома А в ядро нарушается, однако конкретная функция этих белков была до сих пор неизвестна. Именно эти два белка и привлекли внимание исследователей. Анализ нуклеотидных последовательностей генов FHY3 и FAR1 показал чрезвычайно высокое сходство с генами транспозаз, входящими в состав транспозонов Mutator и Jittery. Оба эти транспозона широко распространены в геномах цветковых растений. Сходство генов FHY3 и FAR1 странспозазами оказалось настолько большим, что говорить о случайности не приходится — это, несомненно, гены "прирученных" транспозаз. Оказалось, что белки FHY3 и FAR1 необходимы для активации генов FHY1 и FHL. "Прирученные транспозазы" регулируют активность обоих генов не поодиночке, а совместными усилиями. Они проникают в ядро и прикрепляются непосредственно к регуляторной области (промотору) генов FHY1 и FHL, что приводит к резкому росту активности этих генов. Таким образом, "прирученные транспозазы" FHY3 и FAR1 работают как самые настоящие транскрипционные факторы. Кроме того, исследователи установили, что активность самих генов "прирученных транспозаз" подавляется фитохромом А, поступающим в ядро. В результате образуется контур отрицательной обратной связи, благодаря которому сигнальная система срабатывает при определенной освещенности и затем отключается, а не работает постоянно, как пожарная сирена, пока освещенность не изменится. Но главное значение этой работы, конечно, в том, что впервые удалось продемонстрировать превращение "прирученных транспозаз" в полноценные транскрипционные факторы. Авторы предполагают, что приручение одного или нескольких транспозонов произошло вскоре после появления цветковых растений (примерно в середине мелового периода, около 100 млн лет назад) и было связано с освоением первыми цветковыми разных широтных зон, то есть местообитаний с разной сезонной динамикой освещенности. (Источник: Rongcheng Lin, Lei Ding, Claudio Casola, Daniel R. Ripoll, Cedric Feschotte, Haiyang Wang. Transposase-Derived Transcription Factors Regulate Light Signaling in Arabidopsis // Science. 2007. V. 318. P. 1302-1305.) Данные, указывающие на важную эволюционную роль МГЭ, стали стремительно накапливаться в последние несколько лет. Стало ясно, что многие важные генетические инновации — прежде всего новые регуляторные участки ДНК, управляющие работой соседних генов, — сформировались из фрагментов "прирученных" МГЭ. Но до самого последнего времени не удавалось получить сколько-нибудь точных количественных оценок вклада МГЭ в эволюцию. Поэтому ученые не могли сказать определенно, как все-таки следует относиться к обнаруженным фактам приручения МГЭ — как к типичному и массовому явлению, магистральному направлению эволюции, или все-таки как к экзотике.
Короткохвостый опоссум Monodelphis domestica. Этот маленький южноамериканский зверек стал первым сумчатым млекопитающим, чей геном удалось прочесть. Вторым, скорее всего, будет кенгуру. Для получения количественных оценок необходим комплексный сравнительный анализ целых геномов. Как известно, в последние годы мировое научное сообщество прилагает огромные усилия для того, чтобы определить нуклеотидные последовательности геномов как можно большего числа живых организмов — от бактерий до млекопитающих. И эти усилия начинают приносить плоды. Первые количественные подтверждения того, что формирование новых регуляторных участков ДНК из фрагментов МГЭ является правилом, а не исключением, были получены в результате прочтения генома маленького южноамериканского сумчатого зверька — серого короткохвостого опоссума. Геном опоссума был прочтен в мае 2007 года (Т. S. Mikkelsen et al. Genome of the marsupial Monodelphis domestica reveals innovation in non-coding sequences // Nature. 2007. V. 447. P. 167-177.). Этот зверек был выбран для геномных исследований не случайно — он является важным лабораторным объектом, на котором изучают, в частности, регенерацию и формирование злокачественных опухолей. Кроме того, предполагали, что сравнение с геномом сумчатого животного поможет лучше понять прочтенные ранее геномы плацентарных — человека, шимпанзе, макака-резуса, собаки, мыши, крысы. Эти надежды полностью оправдались. Различия в наборе белок-кодирующих генов между опоссумом и человеком оказались очень невелики. Подавляющее большинство генов опоссума имеют бесспорные человеческие аналоги и наоборот. В целом в белок-кодирующих областях геномов сумчатых и плацентарных за 180 миллионов лет, прошедших после разделения этих линий, возникло сравнительно мало эволюционных инноваций. По современным представлениям, ведущую роль в эволюции высших организмов должны были играть изменения регуляторных участков генома, которые сами не кодируют белков, но влияют на работу белок-кодирующих генов. Геном опоссума блестяще подтвердил эту теорию. Сравнительный анализ геномов опоссума, плацентарных и курицы показал, что в эволюции плацентарных подавляющее большинство эволюционных инноваций было связано с появлением новых участков ДНК, которые не кодируют белков, но выполняют важные регуляторные функции. Из всех функционально важных кодирующих участков генома плацентарных лишь около одного процента появились после отделения плацентарных от общего предка с сумчатыми. Что же касается функционально важных некодирующих (то есть регуляторных) последовательностей, то из их числа целых 20% оказались уникальными для плацентарных. Иными словами, скорость появления новых регуляторных участков генома в эволюции плацентарных была в 20 раз выше, чем скорость появления новых кодирующих участков. У читателя может возникнуть резонный вопрос, почему мы говорим об эволюции плацентарных в связи с прочтением генома опоссума — зверька, относящегося не к плацентарным, а к сумчатым. Дело в том, что только сравнение с геномом опоссума позволило ученым установить, какие из некодирующих последовательностей геномов плацентарных являются новыми, то есть появившимися после разделения эволюционных линий сумчатых и плацентарных. Для того чтобы понять эволюционную роль изменений в некодирующих последовательностях, нужно еще знать, какие из этих последовательностей являются функционально важными, а какие нет. Для плацентарных это можно сделать, сравнивая между собой геномы разных видов: если некодирующий участок сходен, например, у человека и собаки, значит, он, скорее всего, является важным (отбор отбраковывал слишком сильные изменения в этом участке). Для сумчатых этого сделать пока нельзя, поскольку прочтен геном только одного вида сумчатых. Именно поэтому геном опоссума позволил гораздо больше узнать об эволюции плацентарных, чем сумчатых. Как и следовало ожидать, особенно много новых регуляторных последовательностей у плацентарных появилось в окрестностях генов, кодирующих ключевые регуляторы индивидуального развития, в том числе Нох-генов (см. главу 5). Сами эти гены отличаются повышенной консервативностью — они очень похожи у плацентарных, опоссума и даже курицы. Получается, что изменения в строении организма у плацентарных млекопитающих были обусловлены в основном добавлением новых регуляторов к генам — регуляторам онтогенеза. Самый яркий результат исследователи получили в ходе изучения происхождения новых регуляторных последовательностей, возникших в ходе эволюции плацентарных. В принципе, эти последовательности могут появляться тремя способами: 1. в результате изменения "до неузнаваемости" каких-то старых, предковых регуляторных последовательностей; 2. в результате дупликации старых регуляторных последовательностей и последующего накопления различий между копиями; 3. заново, из последовательностей, которые у предков были нефункциональными, в том числе из "прирученных" мобильных элементов. Ранее было выявлено несколько случаев, когда в эволюции позвоночных новые регуляторные последовательности формировались из мобильных генетических элементов. Как мы уже знаем, сама структура МГЭ делает их превосходными "заготовками" для создания новых регуляторных элементов в хозяйском геноме. МГЭ обычно имеют свои собственные регуляторные элементы, например, места прикрепления транспозаз — ферментов, осуществляющих перемещения МГЭ. Эти регуляторные элементы легко могут быть адаптированы для регуляции работы генов хозяйского генома. Однако до сих пор оставалось неясным, являются ли выявленные случаи удачного приручения транспозонов редкими исключениями или общим правилом. Теперь наконец можно с уверенностью сказать: это правило. Оказалось, что в человеческом геноме как минимум 16% из числа важных регуляторных последовательностей, уникальных для плацентарных, представляют собой участки мобильных элементов. При создании новых регуляторных последовательностей у плацентарных в ход пошли все основные группы транспозонов и ретротранспозонов. Причем вышеупомянутые 16% — это, несомненно, сильно заниженная оценка. Дело в том, что "прирученный", утративший подвижность транспозон в результате накопления мутаций становится неузнаваемым примерно за 100-200 миллионов лет. Сохранится в целости лишь тот его фрагмент, который оказался полезен хозяйскому геному, но этого, скорее всего, будет недостаточно, чтобы распознать в таком фрагменте бывший транспозон. За время, прошедшее с момента обособления плацентарных, эта судьба должна была постигнуть значительную часть прирученных транспозонов. Таким образом, "одомашнивание" мобильных генетических элементов играет крайне важную роль в эволюции млекопитающих. Скорее всего, это справедливо и для других живых организмов, но чтобы это доказать, необходимы дальнейшие исследования. Но вернемся к наследованию приобретенных признаков. Связь МГЭ и вирусов с "ламарковскими" механизмами наследования может оказаться еще более тесной, чем принято считать. Можно предположить — пока лишь теоретически, — что при помощи МГЭ высшие организмы могут иногда передавать своему потомству вполне исчерпывающую и адекватную информацию о полезных адаптациях, выработанных ими в течение жизни. По сути дела, это и есть "ламарковское" наследование в чистом виде и без всяких оговорок, в том самом смысле, какой вкладывал в это понятие сам Ламарк. Эта смелая гипотеза была предложена и подробно обоснована австралийским иммунологом Э. Стилом и его коллегами (Э. Стил, Р. Линдли, Р. Бландэн. Что если Ламарк прав? Иммуногенетика и эволюция. 2002. http://evolbiol.ru/lamarck.htm.). Мы помним из главы "Управляемые мутации", как лимфоциты млекопитающих производят гены новых защитных белков-антител в ходе выработки приобретенного иммунитета. Для этого исходные генетические заготовки сначала комбинируются разными способами, а затем подвергаются интенсивному мутированию и отбору. Таким образом формируется новый ген, обеспечивающий защиту против какой-нибудь инфекции — например, против новой болезнетворной бактерии. Выработка приобретенного иммунитета требует времени, и не всегда организм успевает справиться с этой задачей. Против некоторых самых опасных возбудителей было бы выгодно иметь врожденный иммунитет, а не приобретать его каждый раз заново при столкновении с инфекцией. Собственно говоря, именно этот "недостаток" нашей иммунной системы и пытается восполнить современная медицина, осуществляя вакцинацию людей и домашних животных. Если бы генетические изменения, возникающие в лимфоцитах при выработке приобретенного иммунитета, могли иногда передаваться потомству, это было бы аналогично естественной, природной вакцинации последующих поколений. Но как такое может произойти? Ведь для этого новый вариант защитного гена, сформировавшийся в лимфоцитах, должен быть перенесен в половые клетки и встроен в их геном. Кто или что может служить переносчиком генов из лимфоцитов в половые клетки? По мнению Стила, на роль таких переносчиков идеально подходит одна из разновидностей МГЭ, которой буквально кишат геномы млекопитающих, — так называемые эндогенные ретровирусы. Это геномы ретровирусов, которым когда-то удалось встроиться в геном половых клеток, или "продвинутые" ретротранспозоны, способные к образованию вирусоподобных частиц. Грань между сложными ретротранспозонами и простыми ретровирусами весьма условна. Эндогенные ретровирусы, разумеется, передаются по наследству точно так же, как любые другие участки генома. При этом они сохраняют способность "оживать", то есть упаковывать свой геном в белковую оболочку (капсид) и переходить из клетки в клетку. Вместе со своими собственными генами обратной транскриптазы, интегразы, капсидного белка эндогенные ретровирусы могут прихватывать с собой и "чужие" молекулы РНК, считанные с каких-нибудь других генов. Например, с гена нового антитела, если дело происходит в лимфоците. Покинув лимфоцит, такой эндогенный ретровирус в принципе может с током крови добраться до половых клеток и проникнуть в них. Здесь в соответствии с "инструкциями", записанными в вирусной РНК, будут синтезированы ферменты обратная транскриптаза и интеграза. Первая произведет ДНКовые копии вирусных генов, а заодно и гена нового антитела; вторая встроит эти фрагменты ДНК в геном половой клетки. Таким образом новый защитный ген будет передан потомству. При выполнении некоторых дополнительных условий это может привести к тому, что потомство будет с самого начала иметь повышенную устойчивость к какой-то инфекции. Самое интересное, что если бы эта гипотеза оказалась верной и такой механизм наследования удалось бы продемонстрировать экспериментально, то тем самым была бы подтверждена "крамольная" и всеми позабытая дарвиновская теория пангенеза, о которой мы говорили в начале главы. Нетрудно заметить, что эндогенные ретровирусы, выступающие в роли переносчиков информации о приобретенных признаках в половые клетки, совершенно идентичны геммулам, или пангенам, о существовании которых говорил Дарвин. Как от теоретических геммул перейти к реальным агентам приобретенного наследования? В этом нам помогут, например, ретропсевдогены, присутствующие в большом количестве в геномах эукариот. Ретропсевдоген — это последовательность нуклеотидов, идентичная кодирующей части какого-нибудь гена, обычно неактивная, неработающая, которая возникла в результате деятельности обратной транскриптазы. Ее нетрудно отличить от "настоящего" гена по отсутствию интронов — некодирующих вставок, которые есть в большинстве генов высших организмов. Ретропсевдоген образуется так. Сначала с обычного гена "считывается" матричная РНК (мРНК). Считывается все подряд — и кодирующие участки (экзоны), и вставленные между ними интроны. Затем интроны удаляются, а кодирующие участки сшиваются друг с другом (этот процесс посттранскрипционной обработки РНК называется сплайсингом). В результате образуется "зрелая мРНК". На ее основе синтезируется белок. Если же зрелая мРНК с удаленными интронами "попадется под руку" обратной транскриптазе, то она может синтезировать ДНКовую копию этой РНК и встроить ее в какую-нибудь хромосому. Так и возникают ретропсевдогены. Они обычно не работают, но не потому, что лишены интронов, а потому, что рядом с ними не оказывается подходящих регуляторных участков ДНК — промоторов. Если около гена нет промотора, ферменту РНК-полимеразе просто не к чему прикрепиться, и ген не может быть прочитан. Впрочем, иногда ретропсевдогену может "повезти", и он случайно окажется рядом с промотором в результате какой-нибудь геномной перестройки. Известен ряд случаев, когда ретропсевдогены становились работающими генами. Существование ретропсевдогенов доказывает, что обратная транскриптаза действительно может "переписывать" в геном половых клеток информацию, содержащуюся в молекулах РНК, считанных с различных генов. Это означает, что у животных есть все составные части предполагаемого механизма "пангенеза". Теоретически дарвиновские геммулы имеют право на существование. Они вполне могли бы работать и обеспечивать наследование приобретенных признаков "по Ламарку". Загвоздка лишь в том, что они, по-видимому, в действительности делают это крайне редко. Почему? Скорее всего, просто потому, что это бесперспективно. От всех инфекционных агентов, которые существуют сейчас и могут появиться в будущем, все равно нельзя запастись готовыми, наследуемыми антителами. Любой организм сталкивается в течение жизни с тысячами и миллионами разных возбудителей, и если бы каждое новое антитело "переписывалось" в геном половых клеток, геном оказался бы неимоверно раздут, а это, как мы знаем, ведет к росту "непроизводительных расходов" для каждой клетки организма (см. раздел "Происхождение птиц" в главе 6). Развитие системы приобретенного иммунитета — способности вырабатывать любые антитела в течение жизни — было величайшим эволюционным достижением, а закрепление в геноме потомства каждого удачного антитела было бы тупиковым путем. Эпигенетическое наследованиеНедавно открыто еще несколько молекулярных механизмов, которые в принципе могут служить для передачи по наследству приобретенных признаков. Эти механизмы не связаны напрямую с изменениями самого "текста", записанного в структуре молекул ДНК, то есть с мутациями. Поэтому такую наследственность называют "эпигенетической", или "надгенетической". Один из эпигенетических механизмов — метилирование ДНК. Оказалось, что в процессе жизнедеятельности к молекулам ДНК в клетках, в том числе и в половых, специальные ферменты "пришивают" метильные группы (-СН3). Причем к одним генам метильных групп пришивают больше, к другим — меньше. Распределение метильных групп по генам зависит от того, насколько активно тот или иной ген используется. Активные гены метилируются слабо, неактивные — сильно. Получается совсем как с упражнением и неупражнением органов, которое Ламарк считал причиной наследственных изменений. Поскольку "рисунок метилирования" может передаваться по наследству и поскольку он, в свою очередь, влияет на активность генов у потомства, легко заметить, что здесь может работать совершенно ламарковский механизм наследования: "натренированные" предками гены будут и у потомства работать активнее, чем "ослабевшие" от долгого неиспользования. Однако и в данном случае природа, судя по всему, не заинтересовалась возможностью наладить наследование "по Ламарку". Наибольшего развития система метилирования ДНК в половых клетках достигла у двух групп высших многоклеточных, венчающих эволюционное древо, соответственно, животных и растений — а именно у плацентарных млекопитающих и покрытосеменных (цветковых) растений. В обоих случаях избирательное метилирование ДНК в половых клетках, так называемый "геномный импринтинг", служит не для передачи по наследству приобретенных признаков, а для регуляции взаимоотношений между зародышем и материнским организмом. Геномный импринтинг — распространенное у млекопитающих и цветковых растений явление, состоящее в том, что некоторые гены в половых клетках родителей особым образом "метятся". К цитозиновым основаниям прикрепляется метильная группа. "Помеченный" ген у потомства просто-напросто не работает. Некоторые гены отключаются в сперматозоидах, другие в яйцеклетках. Если гены отключены в сперматозоидах, то соответствующие признаки потомство наследует только от матери. Если отключены гены в яйцеклетке, то наследуются отцовские признаки. В половых клетках потомства старые метки удаляются и заменяются новыми. В результате у внуков могут проявиться признаки деда или бабки, которые не были выражены у родителей. Импринтинг — это пример так называемой "эпигенетической" наследственности, то есть наследственных свойств, не связанных с изменением последовательности нуклеотидов в молекулах ДНК, генетического текста. Именно благодаря импринтингу при скрещивании разных пород или видов млекопитающих оказывается небезразлично направление гибридизации, то есть кто из двух родителей будет принадлежать к какому виду. Например, при скрещивании осла с кобылой получаются мулы, а при скрещивании жеребца с ослицей — лошаки. Вопреки классическим законам генетики важным для потомства оказывается не только то, какие гены они получили, но и от кого — от отца или матери. Зачем нужен геномный импринтинг, почему он появился? Для объяснения этого существует две гипотезы. Первая — общепринятая — состоит в том, что импринтинг развился вследствие различия интересов полов. У млекопитающих между самкой и ее детенышем во время внутриутробного развития складываются отчасти антагонистические отношения. Говоря упрощенно, эмбрион старается высосать из матери побольше соков, а мать старается сохранить силы и здоровье, чтобы в будущем иметь возможность родить и других детей. Самец в этом конфликте в общем случае — на стороне детеныша. Других-то детей самка еще неизвестно от кого родит, а этот — свой. Поэтому самцы отключают в своих сперматозоидах те гены, которые способствуют защите матери от чрезмерных притязаний эмбриона, а матери, напротив, отключают в своих яйцеклетках те гены, которые могут эти притязания усилить. Действительно, большинство генов млекопитающих, подвергающихся родительскому импринтингу, так или иначе связаны с внутриутробным развитием, строением плаценты и т. п. Из-за этого у млекопитающих (в отличие от многих других животных, таких как насекомые или ящерицы) принципиально невозможно развитие зародыша на основе только материнских или только отцовских генов. Можно взять только что оплодотворенную яйцеклетку какого- нибудь другого животного (не млекопитающего, а, например, лягушки), в которой ядра яйцеклетки и сперматозоида еще не успели слиться, удалить из нее отцовское ядро и заменить его ядром из другой яйцеклетки. Два "материнских" ядра сольются, и из такой яйцеклетки в благоприятных условиях может развиться нормальный организм, все гены которого — материнские. Можно искусственно сделать яйцеклетку с двумя отцовскими ядрами, и из нее тоже может вырасти жизнеспособное животное. Однако с млекопитающими этот номер не пройдет. Без отцовских генов у эмбриона не разовьется плацента, а без материнских плацента разовьется даже лучше, чем надо, но не будет нормально развиваться сам эмбрион. Дополнительная гипотеза, более симпатичная с этической точки зрения, была высказана совсем недавно (Jason В. Wolf, Reinmar Hager. A Maternal-Offspring Coadaptation Theory for the Evolution of Genomic Imprinting // PLoS Biology, 2006. 4(12)). Согласно этой гипотезе основной смысл геномного импринтинга — достижение лучшей совместимости между матерью и плодом, то есть на первое место ставятся не антагонистические взаимоотношения матери и эмбриона, а кооперативные. Если часть отцовских генов будет выключена, то у эмбриона будут работать только материнские копии этих генов, и эмбрион, таким образом, будет по своим физиологическим и биохимическим свойствам больше похож на мать, и им легче будет приспособиться друг к другу. Эта гипотеза предполагает, что в ходе родительского импринтинга должно отключаться больше отцовских генов, чем материнских, и факты это подтверждают. Метилирование и деметилирование генов играют важную роль в процессе индивидуального развития многоклеточного организма, где они служат для контроля работы генов в развивающихся органах и тканях. Кроме того, при помощи метилирования клетки борются с чрезмерной активностью мобильных генетических элементов. Избирательное метилирование МГЭ снижает частоту их "прыжков". Особенно тщательно многоклеточные организмы "следят" за активностью МГЭ при созревании сперматозоидов (см. главу "На подступах к неведомому"). Очень важно, что метилирование дает клетке возможность попутно контролировать и частоту мутирования тех или иных генов. Как уже отмечалось в главе "Управляемые мутации", метилирование цитозина (Ц) резко повышает вероятность мутации, в результате которой цитозин заменяется тимином (Т). Метилирование ДНК активно контролируется клеткой, таким образом, в клетке реально существует механизм, позволяющий целенаправленно регулировать вероятность мутирования определенных участков генома.
Взаимное включение и выключение генов. Еще один возможный вариант эпигенетического наследования приобретенных признаков основан на системах взаимной активации и инактивации генов. Допустим, ген А производит белок, одно из действий которого состоит в блокировании работы гена Б, а ген Б, в свою очередь, кодирует другой белок, способный "выключать" ген А. Такая система может находиться в одном из двух состояний: либо ген А работает, и тогда ген Б выключен, либо наоборот. Допустим, что переход системы из одного состояния в другое может происходить только в результате какого-то особенного внешнего воздействия, и случается такое редко. То состояние, в котором находится эта двухгенная система в клетках матери, будет через яйцеклетку передаваться ее потомству (поскольку сперматозоид содержит пренебрежимо малое количество белков). Если же в течение жизни матери система переключится в другое состояние, то этот приобретенный признак передастся потомству, родившемуся после "переключения". Опять получается наследование по Ламарку. Точнее, возможность такого наследования. И опять, как и в предыдущих случаях, живые организмы, похоже, не очень-то торопятся воспользоваться этой замечательной возможностью. Мы видим, что "ламарковское" наследование приобретенных признаков вполне осуществимо технически. Имеется целый ряд молекулярных механизмов, способных обеспечить целенаправленную передачу потомству наследуемой информации о приобретенных признаках. Тот факт, что живые организмы редко используют эти возможности, говорит о том, что наследование "по Ламарку" им просто не выгодно. Негенетическая "память поколений". Передача информации от родителей к потомкам может осуществляться тремя основными путями, два из которых общеизвестны: это генетическая наследственность, свойственная всем без исключения живым организмам, и обучение, характерное только для животных со сложной нервной системой. Третий путь менее известен и гораздо хуже изучен, однако и он, судя по всему, играет важную роль в жизни многих организмов. Это так называемые "родительские эффекты" — внегенетические изменения у потомства, обусловленные условиями жизни и заботой родителей. Простейший пример — самка, плохо питавшаяся в течение своей жизни, откладывает яйца с меньшим количеством питательных веществ, из которых развивается — даже при "хороших" генах — сравнительно чахлое потомство. Чем не наследование "приобретенного признака"? Более сложные варианты могут включать различные эпигенетические изменения наследственного материала (ДНК), о которых мы говорили выше, в том числе геномный импринтинг, который представляет собой не что иное, как целенаправленное манипулирование наследственными свойствами потомства. Кроме того, известно, что эмбриональное развитие животных, особенно на начальных этапах, во многом зависит от разнообразных молекул (в том числе матричных РНК), поступающих в яйцеклетку из материнского организма (см. раздел "Нужны ли эмбрионам гены" в главе 5). Ясно, что условия жизни матери в принципе могут влиять на количество и состав этих веществ и, следовательно, на развитие зародыша. Изучать родительские эффекты легче всего у тех животных, в жизненном цикле которых присутствует партеногенетическое размножение (развитие потомства из неоплодотворенныхяиц) — как, например, у рачков-дафний. В этом случае геномы матери и ее дочерей идентичны и легче отличить "материнские" эффекты от генетических. Недавно российским ученым удалось показать методом моделирования, что материнский эффект — негенетическая передача от матери к потомству информации о длине светового дня и обилии пищи — играет важную роль в сезонных изменениях численности и поведения дафний и делает популяцию более устойчивой. Наличие материнского эффекта у дафний, вначале предсказанное теоретически, недавно получило экспериментальные подтверждения. Еще в 1996 году А. А. Умнов и В. Р. Алексеев разработали имитационную модель для проверки гипотезы о существовании у ветвистоусых рачков материнского эффекта. В модели предполагалось, что дафнии передают потомству информацию о трофических условиях (то есть о том, насколько хорошо питалась мать). Позже эта гипотеза была подтверждена экспериментально (Alekseev, Lampert. Maternal control of resting-egg production in Daphnia. // Nature. 2001. V. 414. P. 899-901.). Выяснилось, что дафнии передают потомству информацию не только о своем питании, но и об изменениях длины светового дня. Вследствие этого особи, имеющие одинаковый размер и возраст, могут по-разному реагировать на одни и те же пищевые и температурные условия только потому, что их матери имели разную жизненную историю.
Ветвистоусый рачок Daphnia longispina — массовый представитель зоопланктона озер и луж умеренной зоны. На фотографии видны зреющие яйца в выводковой камере. В новой статье В. Р. Алексеева и Т. И. Казанцевой, опубликованной в 2007 году в "Журнале общей биологии", оценивается возможное влияние материнского эффекта на колебания численности популяций дафний, на время перехода от партеногенетического (однополого) размножения к двуполому, на количество зимующих яиц и другие параметры популяции. В качестве "образца" для моделирования использовалась хорошо изученная популяция рачков Daphnia longispina из озера Красненького в Псковской области. Жизненный цикл этих рачков довольно сложен. Весной из зимующих яиц выходит первое поколение самок, которые начинают быстро размножаться путем партеногенеза, производя на свет только самок. В начале лета численность микроскопических водорослей — основной пищи дафний — снижается, и дафнии начинают производить на свет самцов и переходят к двуполому размножению. Образуются покоящиеся оплодотворенные яйца, и наступает "летняя диапауза", длящаяся не более месяца. Затем из яиц выходит новое поколение самок, размножающихся партеногенетически. В конце лета и осенью в популяции снова появляются самцы, начинается двуполое размножение и откладываются зимующие яйца, покрытые плотной оболочкой, позволяющей переносить неблагоприятные условия. Переход дафний от однополого размножения к двуполому регулируется несколькими факторами — температурой, обилием пищи, длиной светового дня. Информация о динамике этих факторов в прошлом и настоящем доходит до дафний двумя путями: из их личного жизненного опыта, а также от матери благодаря "материнскому эффекту". Разработанная авторами модель имитирует жизненный путь каждой отдельной особи. Вероятность перехода особи от однополого размножения к двуполому зависит в модели как от сиюминутного состояния факторов среды (температуры, длины светового дня, количества пищи), так и от индивидуального "потенциала роста" особи, который, в свою очередь, определяется условиями жизни и "потенциалом" ее матери. Потенциал роста определяет максимально возможную скорость роста данной особи. Чем медленнее рост, тем выше вероятность перехода к двуполому размножению. Таким образом, переход к двуполому размножению зависит не только оттого, как питалась данная особь и каковы условия среды в данный момент, но и оттого, как питались ее мать и более далекие предки. Тем самым задается "материнский эффект" — негенетическая передача информации от матери к потомкам. Авторам удалось показать, что при определенных входных параметрах их модель очень точно воспроизводит реальную динамику численности самцов и самок, партеногенетических и покоящихся яиц, наблюдаемую в реальной популяции. Надо сказать, что эта реальная динамика достаточно сложна: например, в течение одного лета наблюдается несколько (обычно 5) пиков численности дафний. Точное соответствие модельной и реальной популяционной динамики дало основания полагать, что модель действительно учитывает все основные факторы и причинно-следственные связи, определяющие эту динамику. Теперь модель можно было использовать для проверки гипотез о роли материнского эффекта. Изъятие из модели материнского эффекта привело к тому, что модельная динамика стала резко отличаться от реальной. Ни один из вариантов модели с отключенным материнским эффектом не позволил воспроизвести динамику численности и формирование банка покоящихся яиц, необходимых для устойчивого многолетнего развития популяции. Например, если потенциал роста был задан высоким, покоящиеся яйца практически не образовывались, выживание популяции в зимний период было возможно только благодаря небольшому количеству перезимовавших самок и в долгосрочной перспективе популяция становилась крайне уязвимой. На этом основании авторы сделали вывод о существенной роли материнского эффекта в формировании популяционной динамики и сезонных адаптаций у дафний. (Источник: В. Р. Алексеев, Т. И. Казанцева. Использование индивидуально-ориентированной модели для изучения роли материнского эффекта в смене типов размножения у Cladocera // Журнал общей биологии. 2007. Т. 68. С. 231-240.) Что почитать на эту тему в ИнтернетеБ. Ф. ВАНЮШИН. Материализация эпигенетики, или Небольшие изменения с большими последствиями. 2004. http://evolbiol.ru/epigeneticai.pdf B. А. ГВОЗДЕВ. Регуляция активности генов, обусловленная химической модификацией (метилированием) ДНК. 1999. http://evolbiol.ru/gvozdev1999.pdf Л. А. ЖИВОТОВСКИЙ. Наследование приобретенных признаков: Ламарк был прав. 2003. http://evolbiol.ru/zh__lamark.pdf C. Г. ИНГЕ-ВЕЧТОМОВ. Цитогены и прионы: цитоплазматическая наследственность без ДНК? 1996. http://evolbiol.ru/inge1996.pdf Ж. Б. ЛАМАРК. Философия зоологии (главы из книги). http://evolbiol.ru/lamark.htm A. В. МАРКОВ. Обзоры на сайте "Проблемы эволюции": Горизонтальный перенос генов и его роль в эволюции, http://evolbiol.ru/latgentrans.htm На что похожа эволюция: на ветвящееся дерево или на сеть? http://evolbiol.ru/reticulum.htm Наследование приобретенных признаков (неоламаркистская страничка) http://evolbiol.ru/neolamarck.htm С. А. НАЗАРЕНКО. Эпигенетическая регуляция активности генов и ее эволюция. 2002. http://evolbiol.ru/nazarenko2002.htm B. А. РАТНЕР, Л. А. ВАСИЛЬЕВА. Мобильные генетические элементы (МГЭ) и эволюция геномов. 1993. http://evolbiol.ru/ratnen.htm Э. СТИЛ, Р. ЛИНДЛИ, Р. БЛАНДЭН. Что если Ламарк прав? Иммуногенетика и эволюция. 2002. http://evolbiol.ru/lamarck.htm C. В. ШЕСТАКОВ. Роль горизонтального переноса генов в эволюции. 2003. http://evolbiol.ru/shestakov.htm |
|
||
|
Главная | В избранное | Наш E-MAIL | Добавить материал | Нашёл ошибку | Вверх |
||||
|
|
||||